普通烟草NtNAC072 基因的克隆、鉴定及表达模式分析
2019-04-09李晓旭郭永峰
李晓旭,郭 存,刘 成,李 虹,李 伟,蒋 勋,郭永峰*
1. 中国农业科学院烟草研究所 烟草行业基因资源利用重点实验室,山东省青岛市崂山区科苑经四路11 号 266101
2. 郑州大学生命科学院,郑州高新技术产业开发区科学大道100 号 450001
转录因子(Transcription factor, TF)又称为反式作用因子,能特异性地结合启动子特定区域DNA序列(顺式作用元件,Cis-acting element),激活或抑制下游基因的转录,从而调控相关的生物学过程。NAC 转录因子是一类植物特有的转录因子,其命名最初来源于矮牵牛NAM(No apical meristem)、拟南芥ATAF1-2 和拟南芥CUC1-2(Cup shaped cotyledon),以三者名称的首字母组合为NAC[1]。NAC 转录因子家族成员在N 端具有高度保守的NAC 结构域,负责与特异性的顺式作用元件结合,大约由150 个氨基酸组成,包含A、B、C、D、E 5 个亚结构域(Subdomain),其中,A、C 和D 在不同的物种间是高度保守的,B 和E 保守性相对较差,亚结构域D 中含有核定位信号(NLS),与NAC 转录因子的核定位相关。C 端为高度变异并具有转录激活功能的调控区[1-3]。
NAC 转录因子家族成员在植物生长发育中起重要作用[2]。最早报道的NAC 转录因子家族成员是矮牵牛中的NAM,矮牵牛nam 突变体在幼苗时期表现为顶端分生组织缺失、子叶融合,进而导致生长停滞[4]。在拟南芥中,NAC 转录因子CUC1和CUC2 高度同源,在顶端分生组织区域表达,cuc1/cuc2 双突变体表型与矮牵牛nam 突变体类似,说明NAC 转录因子对于顶端分生组织的建立和维持具有重要作用[5-6]。在拟南芥中,NAC 转录因子家族成员编码基因SND1 在茎木质部纤维和束间纤维中特异性表达,参与次生细胞壁物质合成的转录调控[7-8]。同时,NAC 转录因子家族成员广泛参与生物、非生物逆境胁迫[9]。拟南芥中,由盐胁迫、干旱胁迫和脱落酸ABA 诱导的基因ANAC072(RD26),过表达时能显著提高转基因拟南芥的抗旱能力[10-11]。在马铃薯中研究发现,ANAC072 的马铃薯同源基因StNAC072 和StNAC101能够被干旱胁迫和盐胁迫所诱导,提示马铃薯StNAC072 和StNAC101 基因可能与非生物逆境响应相关[12]。拟南芥ANAC002(ATAF1)基因不但在响应干旱胁迫时发挥调控作用[13],同样在非生物逆境胁迫中也发挥重要作用[14]。此外,拟南芥中NAC 转录因子家族基因ANAC029(NAP)在衰老时期表达量较高,诱导过表达该基因能够促进叶片衰老,并且参与ABA 介导的信号通路[15-16]。最近的研究表明,参与非生物逆境应答的ANAC072,过表达该基因时能够促进叶片衰老,暗示ANAC072基因可能同时调控非生物逆境应答和叶片衰老[17-18]。
有研究表明,叶片衰老受许多分子机制调控[19],而烟叶成熟落黄对外观品质、化学成分以及香气特征等起重要作用。深入研究烟草叶片衰老落黄的调控机制,对烟草育种具有理论和实践意义[20-21]。同时,烟草响应各种生物、非生物胁迫的分子机制已成为相关领域的研究热点[22-23]。为此,采用比较基因组学方法,在普通烟草中克隆NtNAC072 基因,并对其保守结构域、进化关系、亚细胞定位、转录激活以及基因表达模式进行分析,为揭示NtNAC072 基因在烟草叶片衰老落黄及响应非生物胁迫的作用机理提供依据。
1 材料与方法
1.1 材料
普通烟草品种红花大金元(红大)种植在中国农业科学院烟草研究所烟草行业基因资源利用重点实验室温室。在烟株现蕾期,采集植株茎、茎尖、根、根尖、幼嫩叶片、衰老叶片等,液氮冷冻后放置于-80 ℃冰箱保存,备用;在垂直MS 固体培养基中萌发幼苗,待长至6 片真叶期时,将其置于MS 液体培养基中培养5 d,随后转移至含有50 mmol/L NaCl、10 μmol/L ABA 的MS 溶液以及4 ℃和37 ℃光照培养箱中进行胁迫和激素处理,并将幼苗置于吸水滤纸上进行干旱处理,以未经处理的烟苗为对照。分别在处理1、3、6 h 共3 个时间点采样,每组处理采集3 株长势相近的整株烟苗,液氮冷冻后放置于-80 ℃冰箱保存,备用。
1.2 试剂和仪器
农杆菌GV3101 菌株、酵母AH109 菌株以及pCHF3-cGFP、pBridge 载体由本实验室保存。RNAiso、PrimeScriptTMRT reagent Kit 反转录试剂盒 、SYBR® Premix Ex TaqTM荧 光 定 量 试 剂 、Infusion 连接酶、酵母基本培养基(SD Base)、色氨酸缺失混合物(-Trp)、X-Gal 等购自宝生物工程(大连)有限公司。引物合成和DNA 测序由上海派森诺生物科技有限公司完成。KOD 酶购自日本东洋纺公司。限制性内切酶EcoRI、SacI 购自英国NEB 公司。pEASY-Blunt 载体、T1 感受态细胞、质粒提取试剂盒、胶回收试剂盒购自北京全式金生物技术有限公司。
荧光定量PCR 仪ABI 7500(美国ABI 公司),激光共聚焦显微镜TCS-SP8(德国Leica 公司)。
1.3 方法
1.3.1 RNA 提取及反转录PCR
将不同组织样品在液氮下研磨成粉末,按照说明书利用RNAiso 提取总RNA,使用DNaseⅠ去除基因组DNA 后,参照反转录试剂盒进行cDNA第一条链的合成,合成后的cDNA 稀释至50 ng/μL待用。
1.3.2 基因NtNAC072 的克隆
以拟南芥ANAC072 蛋白序列为query 序列,在茄科基因组数据库(http://solgenomics.net/)中进行BLASTP 比对,数据库(Database)选择N.tabacum K326 protein sequences,获得候选基因(mRNA_47257_cds),根据候选基因CDS 序列,设计特异性扩增引物。上游引物:5'-ATGGGTGTTCAAGAAA AAGA-3',下游引物:5'-CTACTGCCTGAATCCCAG-3',以普通烟草品种红大的根组织cDNA 为模板,使用KOD 酶进行PCR 克隆目的基因。PCR反应总体系为50 μL,其中PCR buffer 5 μL,dNTP 5 μL,镁离子3 μL,引物各1.5 μL,KOD酶1 μL,cDNA 模板1 μL,用ddH2O 补充至50 μL。PCR 反应程序:94 ℃预 变性3 min,98 ℃ 变 性10 s,52 ℃ 退火30 s,68 ℃延伸1 min;32 个循环,最终68 ℃延伸7 min。扩增得到目的片段,经胶回收试剂盒回收。取4 μL 回收片段与1 μL pEASY-Blunt 混合,25 ℃反应15 min 进行连接,转化到大肠杆菌感受态T1中,在含有100 µg/mL 卡那霉素的LB 平板上进行筛选,将PCR 鉴定为阳性的克隆送上海派森诺生物科技有限公司测序,将测序正确的亚克隆载体进行保菌处理,并命名为Blunt-NtNAC072。
1.3.3 生物信息学分析
候选基因所编码的蛋白氨基酸序列由ProtParam 程 序(https://web.expasy.org/protparam/)预测其分子量、等电点等基本理化性质;分别在拟南芥数据库TAIR(www.arabidopsis.org)和茄科基因组数据库(http://solgenomics.net/)中下载拟南芥ANAC072、 ANAC019、 ANAC055、 ANAC002、ANAC081、ANAC029 和 马 铃 薯 StNAC072、StNAC101 等衰老及胁迫相关的NAC 转录因子蛋白序列[12],参照文献[24]、利用MAFFT 在默认参数下进行多序列比对,使用Texshade 程序将结果可视化,分析其保守结构域;在NCBI 中下载水稻等其他物种中衰老、胁迫相关NAC 转录因子蛋白序 列 ,包 括 水 稻SNAC1(AAT02360)、OsNAC4(BAA89798),玉米ZmNAC1(ADK25055),小麦TaNAC2(AAU08786),棉花GhNAC1(ACI15341)、GhNAC2(ACI15342),鹰嘴豆CarNAC4(ACS94037)、CarNAC5(ACS94038),番茄SlNAC1(AAR88435),利用MEME(http://meme-suite.org/)在默认参数下进行保守基序(motif)分析,并使用MAFFT 在默认参数下进行多序列比对,使用MGEA6.06 构建邻接树(Neighbor-Joining, NJ tree)。参数设置为:Bootstrap 检验次数设为1 000 次,并选择Poisson Model 和Pairwise Deletion 进行分析。
1.3.4 亚细胞定位分析
参考文献[25]进行亚细胞定位分析。将含有Blunt-NtNAC072 亚克隆载体的菌株扩大培养并提取质粒,以该质粒为模板进行PCR 扩增。使用Infusion 重组酶将不含终止密码子的NtNAC072 基因CDS 序列,连接到pCHF3-cGFP 亚细胞定位载体上,构建35S 启动子驱动下的C 端GFP 融合表达载体,转化到大肠杆菌感受态T1后,在含有100 µg/mL壮观霉素的LB 平板上进行筛选,将PCR 鉴定为阳性的克隆进行测序,将测序正确的重组载体转化农杆菌GV3101,在含有100 µg/mL 壮观霉素和50µg/mL 利福平的YEP 平板上筛选,通过PCR 进行阳性鉴定,以含有35::GFP 质粒的农杆菌菌株为对照,将两者分别在YEP 液体培养基中震荡培养至OD600约为0.8,5 000 r/min 离心5 min 集菌,用重悬液(150 µmol/L 乙酰丁香酮,10 mmol/L MES,10 mmol/L MS,pH 5.6)重悬并注射到烟草叶片背部,培养3 d 后取适量注射叶片材料在激光共聚焦显微镜下观察GFP 信号,激发光波长488 nm。
1.3.5 转录激活实验
参考文献[26]进行转录激活分析。以Blunt-NtNAC072 质粒为模板,进行PCR 扩增,使用Infusion 重组酶将NtNAC072 基因CDS 全长序列,连接到pBridge 载体EcoRI 位点中,在含有100 µg/mL氨苄青霉素的LB 平板上进行筛选,PCR 筛选阳性克隆并测序验证,构建NtNAC072 与GAL4BD 融合表达载体。将重组质粒与pBridge 空白载体分别转入酵母AH109 菌株感受态中,在-Trp 营养缺陷培养基(SD/-Trp)上进行筛选,随后将所筛选的阳性克隆转移至显色培养基(SD/-Trp/X-gal)上倒置避光培养,直至显色。显蓝色的酵母菌斑,表明其转入片段能够启动报告基因表达,具有转录激活活性。
1.3.6 NtNAC072 基因表达模式分析
利用荧光定量PCR 反应来检测NtNAC072 基因的表达模式。根据该基因的CDS 序列设计特异性qRT-PCR 引物,上游引物:5'-GAATATCCGAGG TAATGCCAAGGTAG-3',下游引物:5'-GTCTGGTT AGGACACTGAATCCCAAA-3',采用烟草26S rRNA基因作为管家基因[27]。培养基中培育的烟苗经胁迫、激素处理分别平行收集3 组样品为3 次生物学重复,每组样品分别提取RNA 并反转录为cDNA,定量分析时设计3 次技术重复,计算其平均值及标准差并根据2-ΔΔCt法计算基因的相对表达量。
2 结果与分析
2.1 NtNAC072 基因全长CDS 序列的克隆及序列分析
基于茄科基因组数据库BLASTP 比对信息,设计候选基因特异性引物,以红大叶片cDNA 为模板进行PCR 扩增,目的片段大小在1 000 bp 左右,泳道1 为不含cDNA 模板的阴性对照(图1)。将目的片段回收后连接至pEASY-Blunt 载体,挑取单克隆进行测序。测序结果表明,NtNAC072 基因的CDS 序列全长1 065 bp,编码354 个氨基酸。ProtParam 工具分析该蛋白的相对分子质量为40 266.28 Da,理论等电点(Theoretical pI)为8.99。
基于新鉴定的NtNAC072 蛋白序列,将其与拟南芥、马铃薯和水稻等物种中衰老、逆境胁迫相关的NAC 转录因子ANAC072 等蛋白序列进行多序列比对(图2),完全保守的氨基酸残基用紫色标注,其余的相对保守的氨基酸残基用蓝色、红色标注,发现NtNAC072 在N 端具有保守的典型NAC结构域。该结构域可以进一步分为A~E 共5 个亚结构域,在其亚结构域D 中发现保守的核定位信号,C 端序列则呈现高度多样性,其可能与转录激活功能相关。
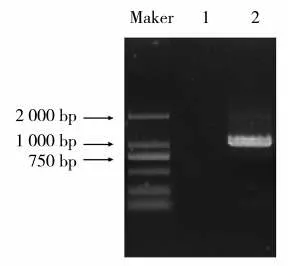
图1 NtNAC072 基因PCR 扩增产物电泳图Fig.1 Electrophoretogram of NtNAC072 PCR amplification


图2 NtNAC072 转录因子NAC 结构域分析Fig.2 NAC conserved domain analysis of NtNAC072 transcription factor
2.2 NtNAC072 转录因子的进化分析和保守基序分析
以拟南芥、马铃薯和水稻等物种中已报道的衰老、胁迫NAC 转录因子为参考进行多序列比对,基于比对结果利用MEGA 构建了邻接树。基于重建的邻接树(图3),参与进化分析的18 个NAC 转录因子家族成员被分为NAP、RD26 和ATAF 共3 个亚家族(Subgroup)。烟草NtNAC072与马铃薯StNAC072、拟南芥ANAC072 聚在一起,说明三者直系同源。利用序列保守基序识别工具MEME 对蛋白序列的保守基序进行分析,结果表明,同一亚家族内的NAC 转录因子家族成员的保守基序种类和组织形式具有较强的一致性,从侧面反映了系统进化分析的可靠性。同时,NtNAC072 与StNAC101、StNAC072 和ANAC072保守基序的种类和组织形式高度一致,暗示NtNAC072 与StNAC101、StNAC072 和ANAC072可能具有相似的功能。
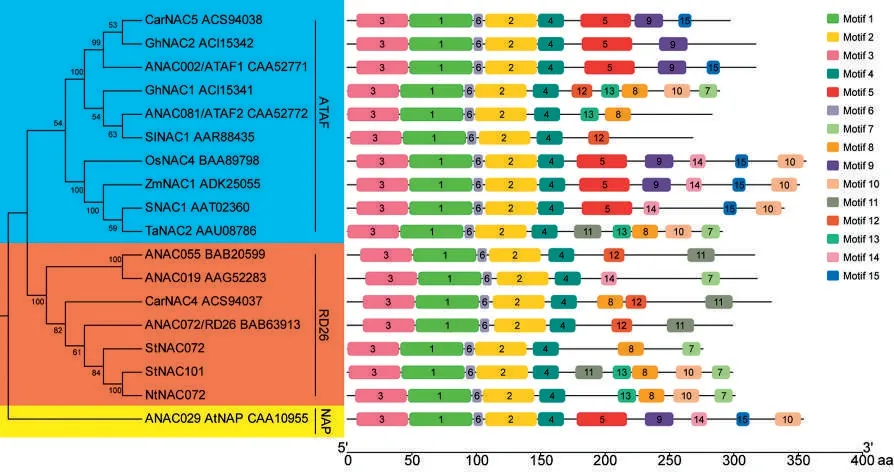
图3 NtNAC072 转录因子系统进化及保守基序分析Fig.3 Phylogenetic and conserved motifs analysis of NtNAC072 transcription factor
2.3 NtNAC072 转录因子的亚细胞定位分析
通过农杆菌侵染,让NtNAC072 基因在烟草叶片中瞬时表达,确定NtNAC072 转录因子的亚细胞定位(图4)。其中,DAPI 指示细胞核,BF 为明场。在35::GFP 瞬时转化对照中,GFP 信号遍布整个细胞,而融合NtNAC072 的GFP 蛋白信号只能在细胞核中观察到,并与细胞核特异性染料DAPI 的信号重叠,这说明NtNAC072 是一个核定位蛋白,符合其转录因子的特性。
2.4 NtNAC072 转录因子的转录激活分析

图4 NtNAC072 的亚细胞定位Fig.4 Subcellular localization of NtNAC072
pBridge 中含有酵母转录因子GAL4 的BD(binding domain)序列,其编码的蛋白能和对应酵母菌株AH109 中的UAS 序列特异性结合,如果GAL4-BD 融合的目的蛋白具有转录激活活性,则能够启动UAS 下游的报告基因,因此能够利用报告基因表达与否,判断融合片段是否具有转录激活活性。将pBridge 空载对照和NtNAC072-pBridge载体分别转化AH109 酵母菌株,在SD/-Trp 平板上,30℃条件下培养3 d 筛选,随后将筛选的阳性酵母克隆转移至显色培养基(SD/-Trp/X-gal)上倒置避光培养。从图5 中可以看出,含有NtNAC072的全长CDS 的酵母表达菌株在X-gal 存在的情况下,能够启动报告基因表达进而显示蓝色。而只含有pBridge 的对照酵母菌株不能激活报告基因表达,说明NtNAC072 具有转录激活活性。

图5 NtNAC072 酵母转录激活实验Fig.5 Transactivation analysis of NtNAC072 in yeast
2.5 NtNAC072 基因的表达模式分析
实时荧光定量PCR 结果表明,NtNAC072 基因在茎(ST)、茎尖(SAM)、根(RT)、根尖(RAM)、幼叶(YL)和衰老叶片(SL)所有测试组织中均有表达,主要在烟草衰老叶片和根等部位表达(图6)。当烟草叶片衰老时NtNAC072 基因表达量显著上升,这说明该基因可能参与烟草叶片衰老落黄。
对NtNAC072 基因在不同胁迫及激素处理下的表达分析结果可见,NtNAC072 基因的表达受多种胁迫的诱导(图6),如:盐胁迫(NaCl)、干旱胁迫等,其中干旱胁迫诱导作用最为明显。在干旱胁迫下,NtNAC072 基因的表达量随着干旱处理时间的延长而显著增高,在6 h 时达到对照(CK)的12.6倍。在盐胁迫下,NtNAC072 基因的转录水平也随着盐胁迫处理时间的延长而增高,并且在处理3 h内急剧上升,为对照的5.7 倍左右,随后略微下降。此外,ABA 能够显著诱导NtNAC072 基因的表达,在处理6 h 后,达到对照的11.1 倍。值得注意的是,冷胁迫和热胁迫处理时,NtNAC072 基因的表达情况变化不明显,说明NtNAC072 基因主要受到盐胁迫和干旱胁迫的诱导,可能在烟草盐胁迫和干旱胁迫等非生物逆境应答方面发挥重要调控作用。

图6 NtNAC072 基因的表达模式分析Fig.6 Expression pattern analysis of NtNAC072
3 结论
利用比较基因组学方法,从普通烟草中分析并克隆得到拟南芥ANAC072 的同源基因NtNAC072。生物信息学分析发现,NtNAC072 蛋白具有保守的典型NAC 结构域,在其亚结构D 中发现保守的核定位信号。进化分析发现,NtNAC072 与拟南芥ANAC072 直系同源,并且保守基序具有很强的一致性。亚细胞定位实验与转录激活实验显示,NtNAC072 定位在细胞核内且具有转录激活活性。表达模式分析发现,NtNAC072 基因主要是在根部和衰老叶片中表达,并且衰老叶片中的表达量明显上升。在盐胁迫处理下,NtNAC072 基因的表达峰值约为对照的5.7 倍。在干旱胁迫下,NtNAC072 基因的表达量随着处理时间的延长而逐渐升高,表达峰值约为对照的12.6 倍。ABA 作为一个重要的信号分子参与植物的胁迫响应,ABA处理能够诱导NtNAC072 的表达,且表达量显著增加。因此,NtNAC072 基因为拟南芥ANAC072 的同源基因,编码典型NAC 型的转录因子,在衰老落黄的烟草叶片中高量表达,并受到盐胁迫、干旱胁迫和ABA 的诱导。NtNAC072 基因可能在烟草叶片衰老落黄以及盐胁迫、干旱胁迫等非生物逆境应答方面发挥重要调控作用。
