三相萃取体系分离富集螺旋藻多糖及其结构特征分析
2019-04-04罗光宏马明辉张喜峰杨生辉王丹霞陈天仁
罗光宏,马明辉,张喜峰*,杨生辉,王丹霞,陈天仁
1(河西学院,甘肃省微藻技术创新中心,甘肃 张掖,734000) 2(甘肃省河西走廊特色资源利用重点实验室,甘肃 张掖,734000) 3(河西学院农业与生物技术学院,甘肃 张掖,734000)
螺旋藻(Spriulinaplatensis)是拉丁美洲和非洲国家的一种传统食品。许多研究表明螺旋藻或其提取物能提高人体细胞免疫和体液免疫功能[1-2],对人类或其它动物具有抑癌作用[3-4]。从螺旋藻中提取的螺旋藻多糖,具有抗氧化、抗病毒、免疫活性、抗炎和DNA修复等多种生物学活性[5-6]。螺旋藻多糖可提高机体SOD的活力,提高酶促防御能力,消除自由基,改善活性氧产生的伤害;抗病毒作用机理通过阻断病毒向宿主细胞吸附,抑制感染细胞内病毒复制过程;抗疲劳作用主要通过减少蛋白质和其他含氮化合物的分解代谢,降低血清尿素氮的形成,提高肝糖原和肌糖原贮备能力,明显延长小鼠游泳运动耐力时间,起到抗疲劳作用;螺旋藻多糖构效关系主要体现在其一级结构和其生物学活性,如螺旋藻多糖相对分子质量、硫酸化等化学修饰、支链分支度结构改变,均对其生物学活性产生影响;如相对分子质量为1 000万螺旋藻多糖比临床多糖制剂激活体外单核细胞能力较强;螺旋藻多糖经硫酸化修饰后,具有更强抑制血管内皮细胞增殖获活性等[7];螺旋藻多糖是一种水溶性多糖,可通过热水浸提、沉淀、去蛋白和各种sephadex、sephacryl和sepharose柱层析方法等一系列步骤进行纯化[8]。但是上述分离方法具有处理量大、得率较低、大量有机溶剂消耗和成本较高等缺点或局限性。此外,TCA(tricarboxylic acid cycle)法、酶解法和Sevage法包括化学试剂和复杂纯化过程,已成为多糖中去除蛋白质的普遍方法[9-10]。
与传统方法相比,三相萃取技术是一种新兴的简单、快速、高效、成本较低,非色谱分离技术[11]。三相萃取通常由一定量的无机盐(如(NH4)2SO4)、含有蛋白质的粗提取液和一定量的有机溶剂(如叔丁醇)混合组成[12]。色素、脂类、抑制剂和疏水化合物富集在上相即叔丁醇相,中间相主要为富集的蛋白质或酶,而糖和其他亲水性物质都集中在下层水相即硫酸铵相。上述三相的形成主要与盐的离子强度、kosmotropy、表面张力增强、渗透应力有关[13]。由于其温和液相环境在分离和纯化生物活性物质方面具有举足轻重作用。近年来,三相萃取已广泛应用于蛋白质、酶、抗氧化物、油脂、金属回收等成分的分离和纯化[14-17]。
本试验采用三相萃取技术分离纯化螺旋藻多糖,分别研究(NH4)2SO4浓度、叔丁醇加入量、pH、萃取温度、时间对螺旋藻多糖得率的影响,并对其结构特征进行了分析,以期为螺旋藻多糖深入研究奠定基础。
1 材料与方法
1.1 材料、试剂与仪器
螺旋藻,由甘肃省微藻创新技术中心提供;(NH4)2SO4、叔丁醇、苯酚、浓H2SO4、葡萄糖,均为分析纯;透析袋(分子截留量8~12 kDa),成都德思特生物技术有限公司。
PL-203 电子天平,梅特勒-托利多仪器有限公司;紫外可见分光光度计,上海谱元仪器有限公司;TG/DTA系列热重差热综合热分析仪,宁波赛茵仪器有限公司;气相色谱质谱联用仪,江苏天瑞仪器股份有限公司;高温凝胶渗透色谱仪,北京亿路达机电设备有限公司;FEI Quanta 450 FEG场发射扫描电镜,FEI公司。
1.2 实验方法
1.2.1 螺旋藻多糖粗提液制备
准确称取10 g螺旋藻粉末,按照固液比1∶0.045(g∶L)加入蒸馏水,在90 ℃水浴处理120 min后,5 000 r/min离心10 min后,上清液为螺旋藻多糖的粗提液[4]。
1.2.2 三相萃取螺旋藻多糖
取1.2.1制备的螺旋藻多糖粗提液10 mL,加入一定量的(NH4)2SO4使其终质量浓度为100~600 g/L,采用HCl或NaOH调节其体系pH为5~9,再加入一定体积的叔丁醇(5~30 mL),充分混匀后,在20~40 ℃ 水浴处理15~90 min,然后在3 000 r/min离心处理10 min,叔丁醇相可通过减压蒸发回收叔丁醇;收集含多糖和硫酸铵的下相,记录其体积,采用蒸馏水透析除盐后,浓缩干燥得到螺旋藻多糖。
1.2.3 多糖得率测定及计算
多糖含量的测定采用苯酚-硫酸法,以100 μg/mL葡萄糖溶液为标准品,所得标准曲线的回归方程为:y=0.113x+0.011 5(R2=0. 996 4)。其中y为490 nm 处的吸光度,x为葡萄糖的质量浓度(μg/mL)。
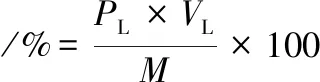
(1)
其中:CL和VL分别为三相萃取平衡后下相中螺旋藻多糖质量浓度和体积;M为螺旋藻粉末质量。
1.2.4 多糖含量测定及计算
将1.2.2制备的多糖加入一定体积蒸馏水,充分混匀后,测定多糖浓度,按式(2)计算多糖含量。
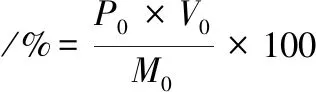
(2)
其中:P0和V0分别为溶解后多糖溶液质量浓度和体积,M0为制备的螺旋藻多糖。
1.2.5 与传统多糖纯化方法的比较
1.2.5.1 碱液冷提法
参考李会端和秦志玉之法[18],按照料液比1∶0.025(g∶L)比例加入浓度为0.4 mol/L NaOH,浸提2 h后,在4 000 r/min离心10 min,取上清液加入5% 的三氯乙酸溶液脱蛋白,采用95%醇沉后,按照1.2.2和1.2.3方法测定多糖得率和含量。
参考贲永光等的方法[19],按照固液比1∶0.025 (g∶L),在温度为50 ℃,超声功率320 W,提取50 min条件下,离心后取上清液,浓缩后醇沉,并采用丙酮洗涤后,按照1.2.2和1.2.3方法测定多糖得率和含量。
1.2.5.3 传统回流提取法
参照张文雄等的方法[20],以固液比1∶0.015(g∶L),在温度为60 ℃,超声功率320 W,提取4 h,醇沉,透析处理后,按照1.2.2和1.2.3方法测定多糖得率和含量。
1.2.5.4 酶解结合超声波提取法
参照王以斌等的方法[21],以固液比1∶0.016(g∶L),在温度为60 ℃,超声功率200 W,加入复合酶,提取时间15 min,经离心醇沉后,按照1.2.2和1.2.3方法测定多糖得率和含量。
1.2.6 螺旋藻多糖理化性质
1.2.6.1 螺旋藻多糖紫外-可见波长扫描
本实验是微组织(微载体复合脂肪干细胞的3D培养)对周围神经再生的体外研究。利用SD乳鼠脂肪干细胞分离培养后与多孔明胶微载体材料复合构建微组织,培养3 d后的微组织与背根神经节共培养,观察其对背根神经节轴突生长的促进作用,并与2D细胞共培养以及单纯背根神经节比较,并从细胞增殖和凋亡等方面分析比较2D、3D细胞培养优劣势。
配制1 mg/mL螺旋藻多糖溶液,在190~400 nm进行扫描,检测其是否含有蛋白质和核酸。
1.2.6.2 螺旋藻多糖红外光谱检测
将冷冻干燥后螺旋藻多糖进行溴化钾压片处理,在4 000~500 cm-1进行红外光谱扫描,分析其官能团组成。
1.2.6.3 螺旋藻单糖组成检测
参照范嘉龙等的方法[22],对螺旋藻单糖进行酸水解及衍生化处理后,采用气相色谱-质谱法(GC-MS)分析其单糖组成及比例。
1.2.6.4 螺旋藻多糖分子质量测定
采用体积排阻色谱-光散射联用(size-exclusion chromatography combined with laser light scattering,SEC-LLS)进行测定。多角度激光光散射仪λ=690 nm,校准常数=8.850 0e-6;色谱柱型号为7.8 mm×300 mm; 溶剂为水。
1.2.6.5 螺旋藻多糖扫描电镜观察
采用Quanta 450场发射扫描电子显微镜对冷冻干燥后多糖样品喷金处理后,观察其表面结构。
1.3 数据统计及处理
以Orgin 8.0作图,所用实验均重复3次,采用Mean±SD表示。
2 结果与讨论
2.1 三相法分离富集螺旋藻多糖
2.1.1 硫酸铵质量分数对螺旋藻多糖得率的影响


图1 不同影响因素(硫酸铵质量分数、叔丁醇加入量、pH、萃取温度、萃取时间)对螺旋藻多糖得率的影响Fig.1 Effect of mass fraction of (NH4)2SO4, amount of t-butanol, pH, temperature, and extraction time on the yield of PSP
2.1.2 叔丁醇加入量对螺旋藻多糖得率的影响
与其他醇类溶剂相比,叔丁醇是一种独特一元醇,除具有溶解非极性成分外,还有醇沉和浮选剂作用,因此,叔丁醇的加入量对螺旋藻多糖得率的影响如图1-b所示。随着叔丁醇加入量逐渐增加,当叔丁醇加入量为15 mL时,螺旋藻多糖得率为8.52%。原因可能是随着叔丁醇加入量增加和硫酸铵质量分数的逐渐减小所呈现协同效应增强,表明叔丁醇作为一种kosmotrope试剂,对硫酸根增强效应具有重要作用,少量叔丁醇对硫酸铵协同效应较弱[24];大量叔丁醇加入会导致下相中多糖含量减少,促使叔丁醇和硫酸根共同竞争水分子,导致得率下降。因此,确定叔丁醇加入量为15 mL。
2.1.3 体系pH对螺旋藻多糖得率的影响
固定硫酸铵质量分数为20%,采用HCl或NaOH调节体系pH分别为5、6、7、8、9,加入叔丁醇15 mL,在25 ℃水浴60 min后,收集下相体积,计算多糖得率。结果如图1-c所示。当体系pH为7时,有利于螺旋藻多糖从三相中分离和富集,多糖得率最高为8.79%;原因可能pH影响生物大分子如蛋白质解离或其表面电荷。此结果与刘杨[25]的研究结论是一致的,因此,确定三相体系pH为7。
2.1.4 萃取温度对螺旋藻多糖得率的影响
固定硫酸铵的质量分数为20%,调节体系pH为7,加入15 mL叔丁醇,分别在20、25、30、35、40 ℃水浴处理60 min后,收集下相体积,计算多糖得率。结果如图1-d所示,在20~35 ℃,多糖得率逐渐升高,此结论与DENNISON等[26]研究结果一致,即温度升高后,有利于多糖分子羟基基团的暴露,利于氢键网络的形成,并促使其亲水性增强,在下相中多糖含量增加,得率升高;当温度超过35 ℃后,高温所需能耗增加。因此,本试验确定萃取温度为35 ℃。
2.1.5 萃取时间对螺旋藻多糖得率的影响
萃取时间不仅影响目标产物质量和得率,且影响整个生产成本。因此,研究萃取时间对螺旋藻多糖得率的影响。由图1-e可知,萃取时间对螺旋藻多糖得率影响不显著,当萃取时间为30 min后,萃取时间继续增加,螺旋藻多糖得率变化无显著差异。因此,确定萃取时间为30 min。
2.2 三相萃取螺旋藻多糖与传统提取方法的比较
不同方法提取螺旋藻多糖得率和纯度如表1所示。

表1 不同方法提取螺旋藻多糖得率和纯度的比较研究Table 1 Comparison of yield and purity of polysaccharide from Spirulina platensis by different methods
由表1可知,采用三相萃取螺旋藻多糖方法与传统方法提取相比,该法制备的多糖具有较高的得率和含量,具有分离和富集多糖的作用;采用三相萃取后,目标产物多糖主要分布在下相,蛋白质主要富集在中间相形成固体,上相主要含有非极性物质,可有效改善多糖纯度,因此,三相萃取作为一种有效的萃取分离方法,具有同时分离和富集目标产物的作用。
2.3 螺旋藻多糖理化性质
2.3.1 多糖紫外扫描图谱
由图2可知,在190~400 nm,260和280 nm处无吸收峰,表明该多糖溶液中不含核酸和蛋白质。

图2 螺旋藻多糖紫外可见波长扫描Fig.2 UV-vis wavelength scanning of the purified PSP
2.3.2 红外光谱分析
由图3可知,在4 000~500 cm-1,在3 384.81 cm-1和2 928.81 cm-1处具有O—H和C—H伸缩振动峰。

图3 纯化后螺旋藻多糖红外光谱Fig.3 The FT-infrared spectra of the purified PSP
1 652.76 cm-1和1 373.74 cm-1处具有酯化羰基和羧基的伸缩振动峰。1 080.67 cm-1和1 035.14 cm-1处有吸收峰,说明螺旋藻多糖为吡喃糖。931.66 cm-1和762.03 cm-1有吸收峰,说明吡喃环有2种差向异构体。
2.3.3 螺旋藻多糖的单糖组成
在相同处理条件下,保留时间是样品单糖组成定性分析依据之一,采用GC对6种单糖标准品进行测定,由图4-A可知,相应色谱峰保留时间分别为:1. 鼠李糖(保留时间tR=12.95 min); 2. 来苏糖(tR=13.57 min); 3.木 糖(tR=14.06 min); 4. 甘露糖(tR=19.65 min); 5.葡萄糖(tR=20.20 min); 6. 半乳糖(tR=21.20 min);对螺旋藻多糖水解单糖组成和标准单糖对比,由图4-B可知,螺旋藻多糖主要由鼠李糖、甘露糖和葡萄糖组成,其单糖组成物质的量比值为5.14∶5.78∶81.37。

图4 标准单糖(A)和螺旋藻多糖(B)的GC图Fig.4 GC spectrum of monosaccharide references (A) and PSP (B)
2.3.4 螺旋藻多糖分子质量测定
由图5可知,螺旋藻多糖重均分子质量Mw为3.597×104, 数均分子质量为Mn=2.189×104,Mw/Mn=1.643,表明分子质量分布具有均匀性。
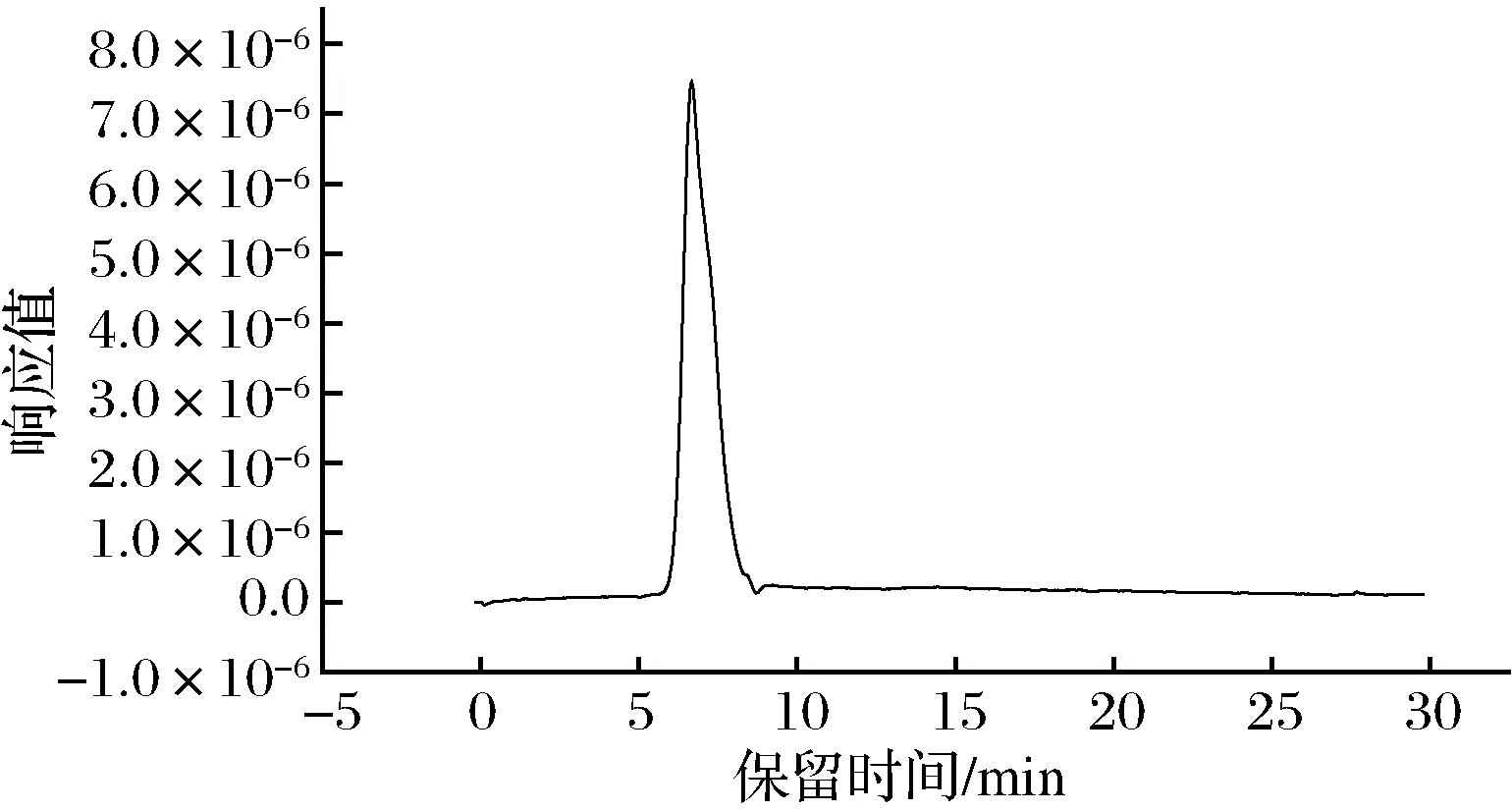
图5 螺旋藻多糖SEC-LLS结果Fig.5 SEC-LLS of PSP
2.3.5 螺旋藻多糖扫描电镜形态观察
图6为不同放大倍数下三相萃取后螺旋藻多糖扫描电镜图,在5 000×放大倍数下观察,螺旋藻多糖表现为具有致密结构的球状;10 000×放大倍数下,其呈现均一紧密球状结构;由于扫描电镜技术用来观察物质表面状态,其结果可能与样品干燥方法、外力作用等因素有关;有关其多糖内部结构及其连接方式,有待进一步分析。

A-10 000×;B-5 000×图6 螺旋藻多糖扫描电镜图Fig.6 Scanning electron microscope(SEM) photographs of the PSP
3 结论
本试验采用三相萃取技术对螺旋藻多糖的分离和富集进行了初步研究,并对制备的多糖结构特征进行了分析,为深入研究多糖结构与生物活性之间的关系奠定基础。
在三相萃取过程中,硫酸铵质量分数、叔丁醇加入量、体系pH、萃取温度和时间均对多糖得率产生一定的影响;通过紫外光谱、红外光谱、扫描电镜、凝胶渗透色谱、单糖组成检测对三相萃取制备的螺旋藻多糖结构进行了表征。当硫酸铵质量分数为20%,叔丁醇加入量为15 mL,体系pH为7.0,在35 ℃条件下,萃取30 min后,螺旋藻多糖得率为(9.25±0.42)%, 含量为(86.17±0.10)%。分子质量测定表明其重均分子质量为3.597×104;螺旋藻多糖主要由3种单糖组成,其摩尔比为:n(鼠李糖)∶n(甘露糖):n(葡萄糖)=5.14∶5.78∶81.37;扫描电镜结果显示其为结构紧密的球状,在一定程度上反应其与样品处理方式有关。
与传统的多糖提取方法相比,三相萃取属于一种绿色、具有广阔前途的萃取技术,具有同时分离目标产物和除去其他杂质的特性,可为其他天然产物中活性成分的有效分离提供技术支撑。
