克氏原螯虾虾头模拟胃肠道消化产物中ACE抑制肽的分离纯化与鉴定
2019-04-04李锐邹茜孙玉林王林冯明会李想
李锐,邹茜,孙玉林,王林,冯明会,李想*
1(岭南师范学院 生命科学与技术学院,广东 湛江,524048)2(四川旅游学院,四川 成都,610100) 3(云南省农业科学院粮食作物研究所,云南 昆明,650205)
据相关统计显示,2017年全世界高血压患病人数高达9.72亿[1]。人体中机体血压和体液平衡主要由肾素-血管紧张素-醛固酮系统来进行调节,而血管紧张素转换酶(angiotensin-converting enzyme, ACE)在系统中起重要作用,它能够调节人体盐-水平衡和动脉血压[2]。血管紧张素转移酶抑制肽(ACE inhibitory peptides, ACE抑制肽) 是一类具有抑制血管紧张素转换酶活性的多肽类物质[3]。ACE抑制剂通过抑制人体内ACE酶的活性,降低对舒缓激肽的破坏作用,从而减少血管紧张素Ⅱ的合成,达到控制血压上升的目的[4-5]。目前,许多人工合成的ACE抑制剂虽然具有良好的降血压疗效(如福辛普利、西拉普利等),但同时会使人体产生头痛、咳嗽、眩晕、疲劳等负面作用[6-7]。食源性生物活性肽是以食源性蛋白质为原料制备的,具有低过敏性、安全、无毒等优点,近年来越来越受到人们的青睐。目前人们已用玉米[8]、魔芋[9]、带鱼脊骨[10]、泰和乌骨鸡肉[11]、沙丁鱼[12]及红松仁[13]等制备得到了ACE抑制肽。
克氏原螯虾(Procambarusclarkia),俗称小龙虾。2016年我国小龙虾总产量达到89.91万t,是全世界世界最大的小龙虾生产国[14]。克氏原螯虾在加工过程中有接近整虾质量50%~ 80%的虾头、虾壳被废弃或者加工成饲料,造成严重的环境污染和资源浪费[15]。据研究,克氏原螯虾虾头中粗蛋白含量为13.13%,同时含有丰富的脂类、虾青素和生物活性物质,可以作为优良的蛋白质来源[16]。利用蛋白酶水解克氏原螯虾虾头,其酶解产物中含有大量的短肽、氨基酸等物质。这些小分子肽具有各种生物活性,经过分离纯化后得到具有特殊生物活性的功能肽,可作为功能食品应用于保健与预防医学领域,具有广阔的市场前景[17-20]。
目前,国内外利用克氏原螯虾虾头模拟胃肠道消化产物制备ACE抑制肽的研究鲜见报道。本研究以克氏原螯虾虾头为原料,通过模拟胃肠道消化制备酶解液。以ACE抑制率为指标,通过超滤、凝胶色谱、离子色谱、反向高效液相色谱对模拟胃肠道消化产物进行分离筛选,以期获得具有较高ACE抑制活性的高纯度单一肽,并对其结构进行解析。
1 材料与方法
1.1 实验材料与仪器
克氏原螯虾虾头,鲜活的克氏原螯虾(Procamb-arusclarkia)购于四川省成都市青羊区麦德龙超市,洗净沥干水分后取虾头,分装保存于-20 ℃备用。胃蛋白酶(酶活力1 200 U/g)和胰蛋白酶(酶活力50 000 U/g),购于国药集团化学试剂有限公司;胰凝乳蛋白酶(1 500 U/g), 购于美国Sigma公司。
ACE、马尿酰-组氨酰-亮氨(N-Hippuryl-His-Leu,HHL),购于美国Sigma公司;马尿酸,购自美国Sigma公司;葡聚糖凝胶(Sephadex G-25、Sephadex G-15)、阴离子交换树脂Capto Q,购于美国GE公司;福林-酚试剂,购自北京鼎国生物科技有限公司;乙腈(色谱纯),其他试剂均为国产分析纯。
真空冷冻干燥机FDU-1100,日本东京理化器械株式会社;LTQ Orbitrap Elite质谱仪,美国Thermo Fisher公司;高效液相色谱仪LC1200,美国Agilent公司;Mini Pellicon超滤系统,德国Merck Millipore有限公司;WTM-CM-01陶瓷膜分离设备,杭州沃腾膜有限公司;高速冷冻离心机HF-2100R,美国Thermo公司。
1.2 实验方法
1.2.1 克氏原螯虾虾头模拟胃肠道消化产物的制备
技术路线:
克氏原螯虾虾头→前处理→绞碎均质→灭酶→模拟胃消化→模拟肠道消化→200目滤布过滤→0.2 μm陶瓷膜过滤→-10 ℃保存备用
模拟胃肠道消化参考JOHNS等[23]的方法,稍作改动。原料预处理:取冷冻的克氏原螯虾虾头置于4 ℃解冻,绞碎后添加适量蒸馏水(质量比1∶2),用高速均质机均质5 min(转速5 000 r/min),于80 ℃的水浴中充分加热20 min,使虾头内源酶失活。体外模拟胃消化:用1 mol/L的HCl溶液将匀浆液pH值调到2.0,按m(酶)∶m(底物)=1∶50添加胃蛋白酶,混匀后于37 ℃下搅拌反应2 h,反应结束后,置于90~100 ℃的水浴中加热10 min,使胃蛋白酶失活。体外模拟肠道消化:用1 mol/L的NaOH溶液将酶解液pH值调到7.5,按复合酶添加量(m(胰蛋白酶)∶m(胰凝乳蛋白酶)=6∶1),底物质量比为1∶25的比例添加复合酶,混匀后于37 ℃下搅拌反应4 h,反应结束后,置于80 ℃的水浴中充分加热20 min,使胰蛋白酶和胰凝乳蛋白酶失活。之后将酶解液用200目的滤布通过三足离心机过滤,可除去大部分固体颗粒,再用陶瓷膜(孔径0.2 μm)过滤,得到的滤液即为克氏原螯虾虾头模拟肠胃道消化产物(SGDP),放置于-10 ℃保存备用。
分别在模拟消化过程 10、30、90、120、150、180、210、240、270、300、330、360、390 min取样;于80 ℃加热20 min终止反应;于4 500 r/min离心10 min,取上清液调节pH值至5.0;于4 500 r/min离心30 min去除大分子蛋白,得到样品液。
1.2.2 ACE抑制活性的测定
马尿酸标准的测定参考朱国萍等[24]的方法。
ACE抑制活性的测定参考王晶晶等[12]的方法,稍作改动。未加样品组:取5 mL离心管依次加入50 μL超纯水和50 μL HHL溶液,37 ℃温浴20 min,再加入50 μL ACE于37 ℃温浴20 min,加入150 μL 1 mol/L HCl终止反应。样品组:取5mL离心管依次加入50 μL 样品溶液和50 μL HHL溶液,37 ℃温浴20 min, 再加入50 μL ACE于37 ℃温浴20 min,加入150 μL 1 mol/L HCl终止反应。高效液相色谱测定条件:Waters C18色谱柱(4.6 mm×250 mm, 5μm);检测波长为228 nm;流速为1 mL/min;流动相A:超纯水(含0.05%三氟乙酸,V/V);流动相B:乙腈(含有0.05%三氟乙酸,V/V);进样量:10 μL;柱温: 25 ℃; 洗脱条件:V(B)∶V(A)=25%∶75%。ACE抑制率的公式如式(1):
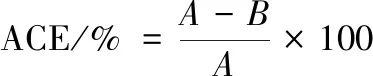
(1)
式中:A,未加入样品组中马尿酸的峰面积,mAU·s;B,加入样品组中马尿酸的峰面积,mAU·s;其中ACE抑制率为 50%时ACE的浓度即为半数抑制浓度(mg/mL),记为IC50。
1.2.3 水解度测定
氨基态氮含量的测定参考NILSANG等[25]的方法。取1 mL的样品溶液和2 mL的去离子水加入250 mL的锥形瓶,再加入10 mL去离子水,用0.05 mol/L的NaOH溶液将pH调到7.0,再加入4 mL体积分数18%的甲醛溶液,混匀后用0.05mol/L的NaOH溶液将pH滴定至9.5,记录滴定消耗的NaOH溶液体积,计算样品中氨基态氮的含量,记为A;原料总氮和非蛋白氮含量采用微量凯氏定氮法测定。
水解度(degree of hydrolysis, DH)按公式(2)计算:

(2)
式中:A,样品中总氮量;B,样品中的氨基氮量;C,样品中游离的氨基氮量;D,样品中的非蛋白氮量。
1.2.4 分子质量测定
分子质量测定参考刘建华等[11]的方法。
1.2.5 超滤分离
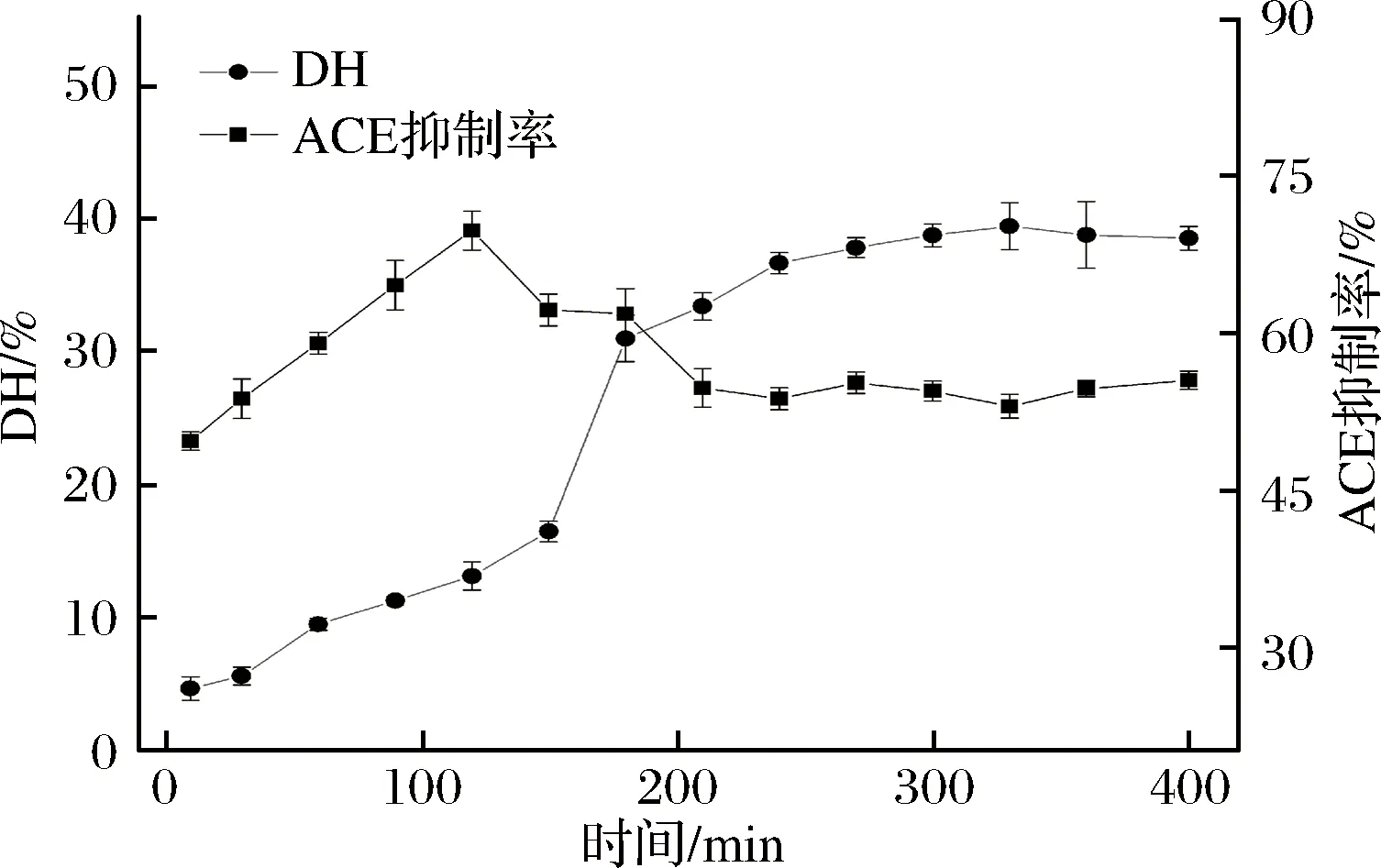
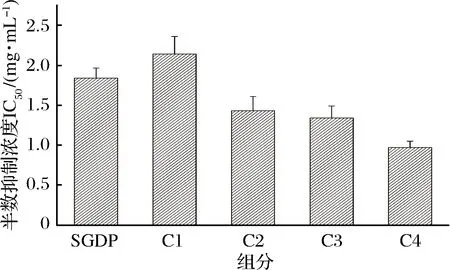
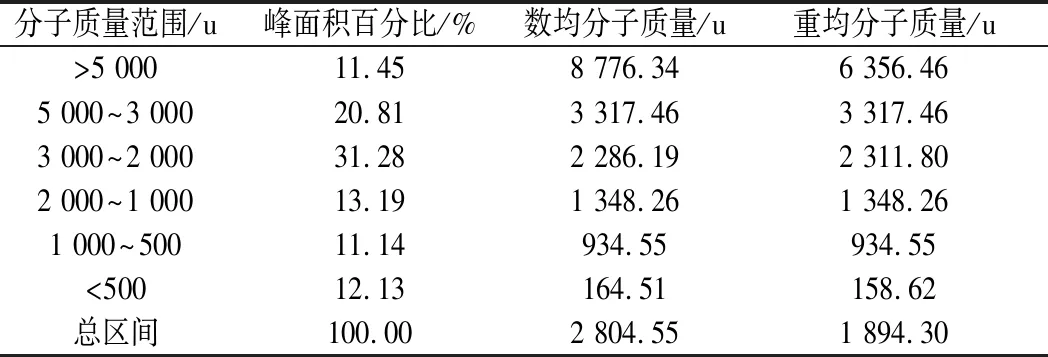
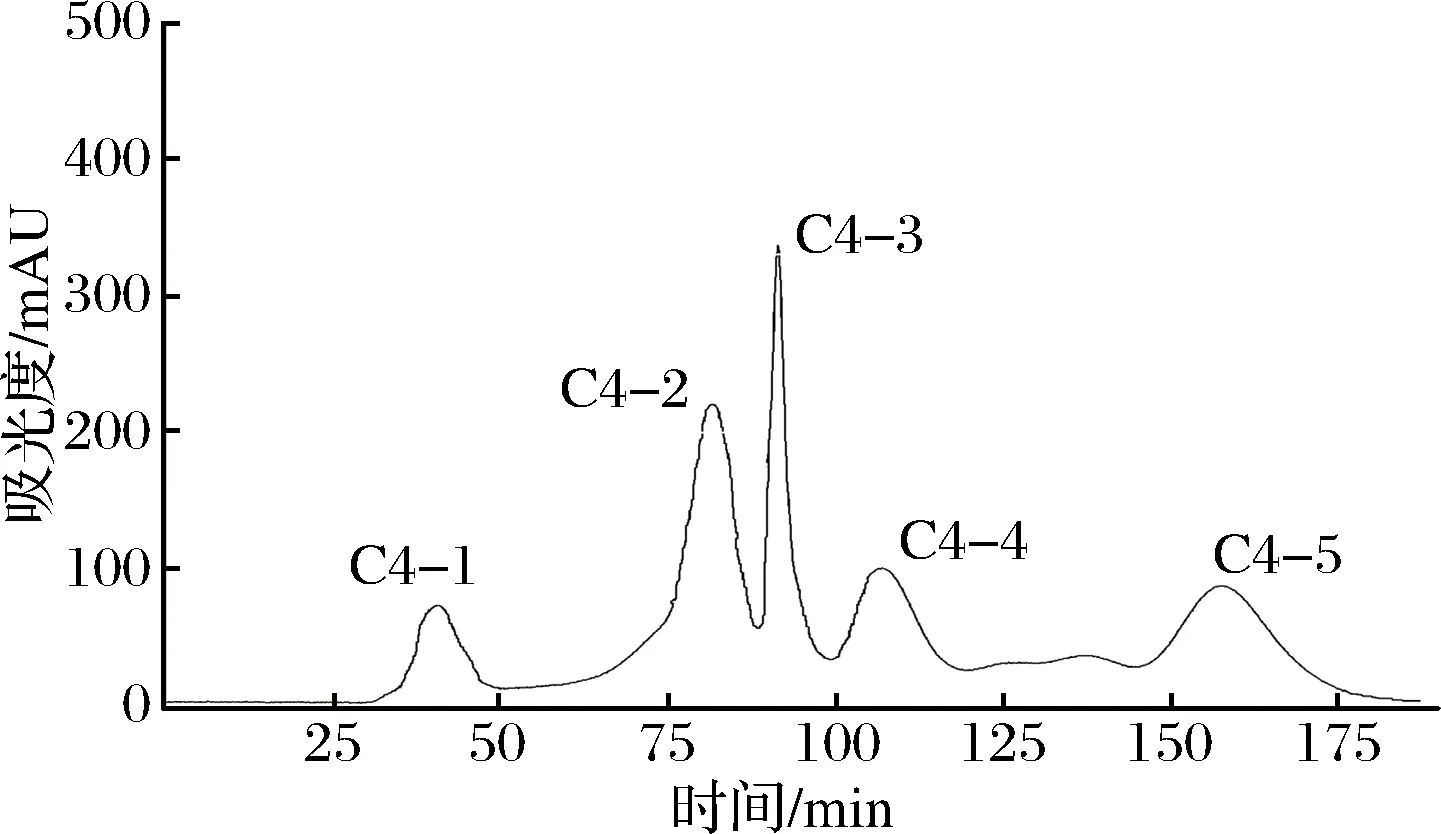
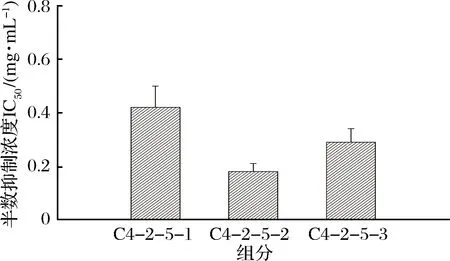
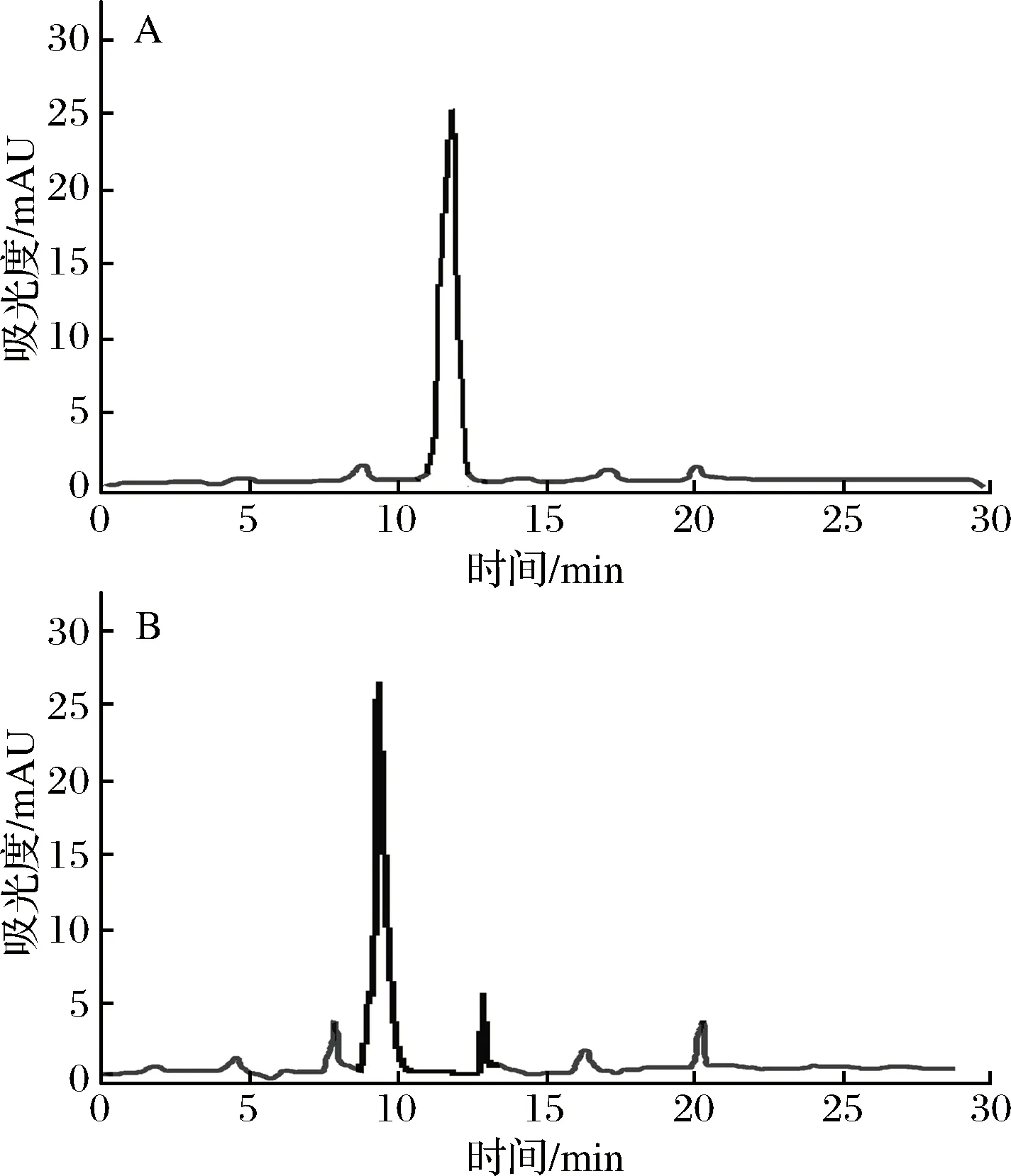
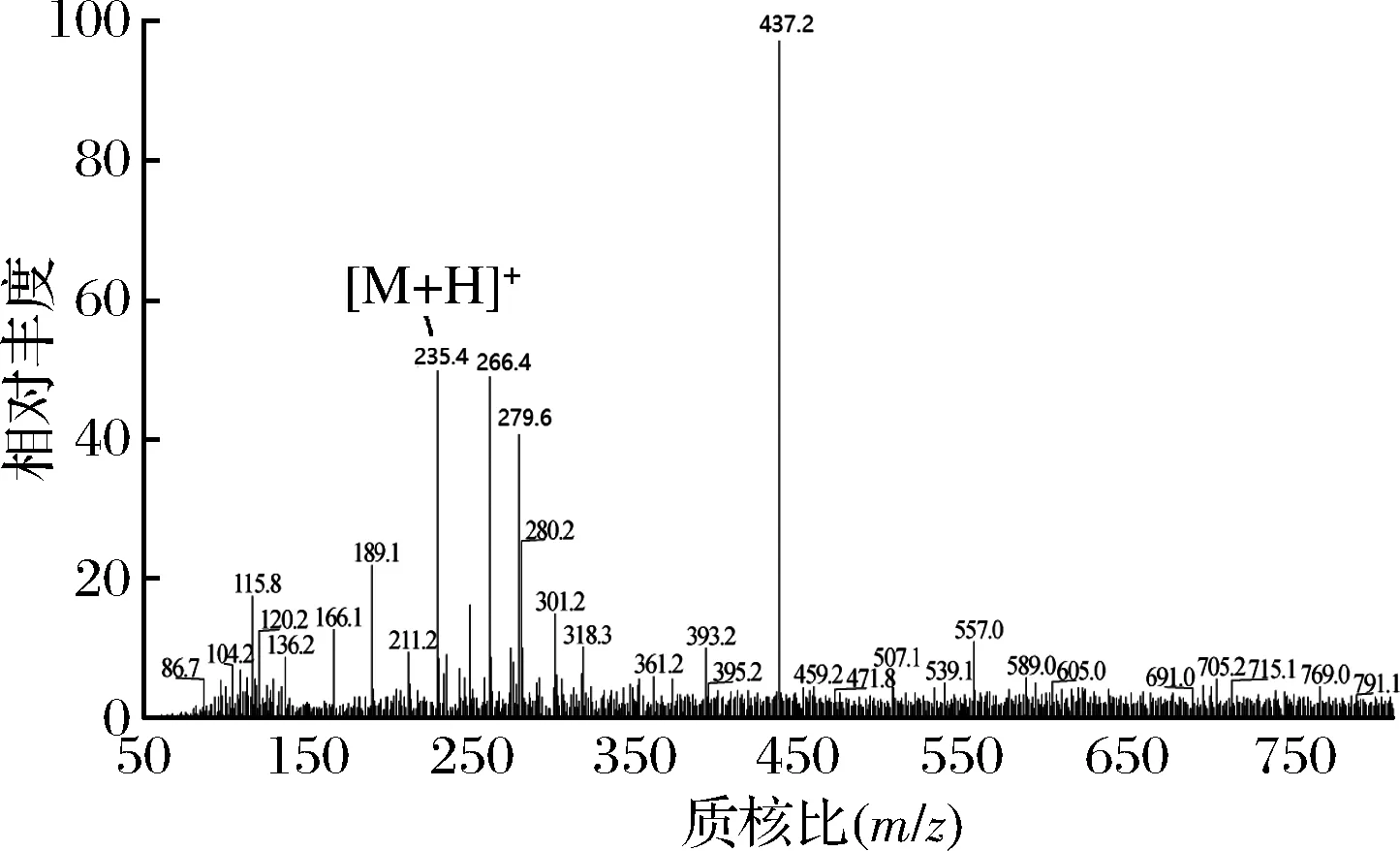
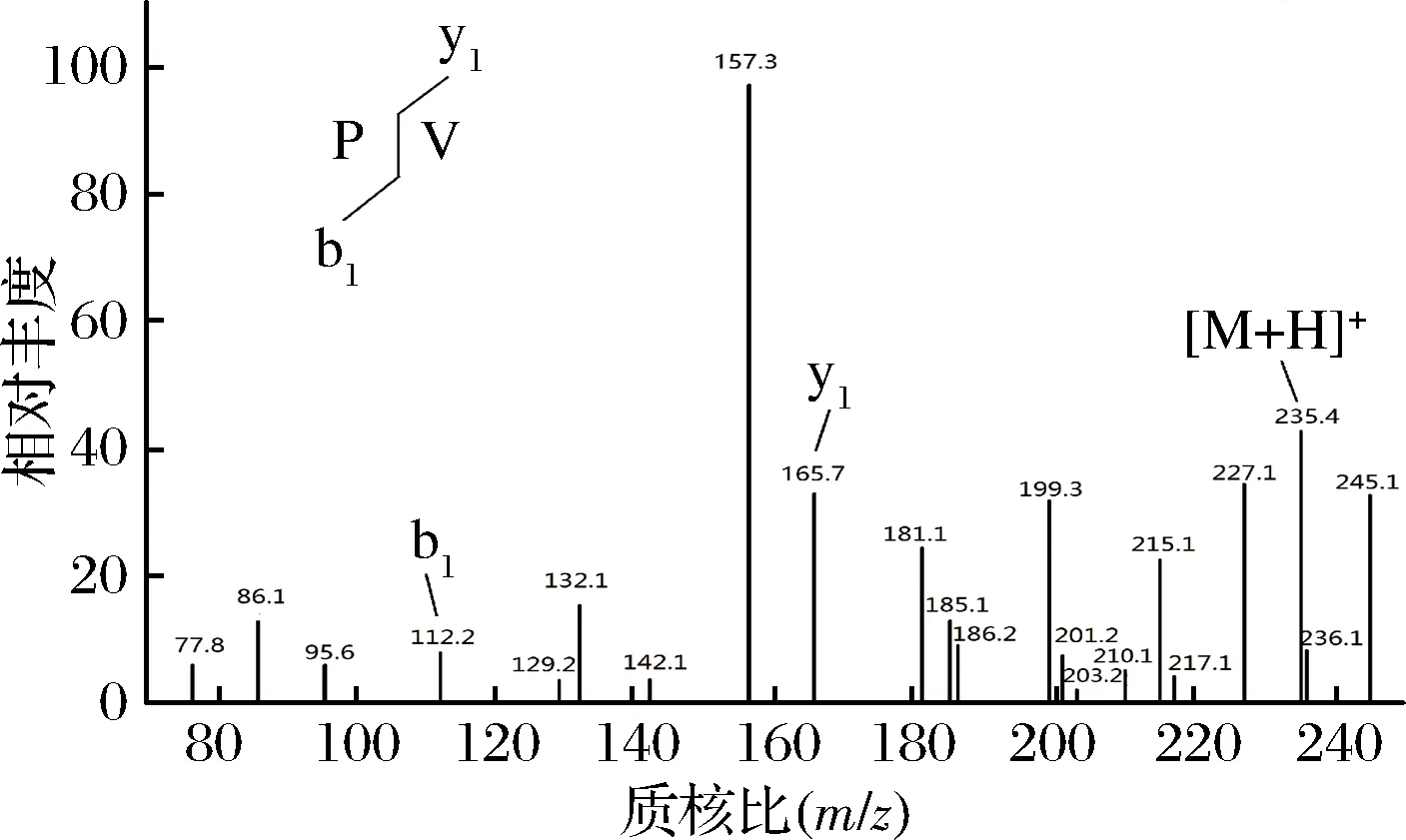
取克氏原螯虾模拟肠胃道消化产物,置于-4 ℃解冻,在温度为25 ℃、压力为40 Psi、流速为0.5 m/s的条件下分别用8 000 u、5 000 u和3 000 u的超滤膜超滤,得到4个不同组分,分别为C1 (MW> 8 000 u)、C2(5 000 u 1.2.6 Sephadex G-25凝胶层析分离 将超滤组分用Sephadex G-25葡聚糖凝胶层析柱(l.6 cm×40 cm)进行层析分离。分离条件为:以超纯水(过0.45 μm滤膜)作为洗脱液,上样浓度为5 mg/mL, 检测波长为220 nm,流速为 1 mL/min,上样体积为2 mL。收集各组分洗脱液冷冻干燥并测定ACE抑制活性。 1.2.7 Capto Q离子交换层析分离 取上一步分离得到ACE抑制活性最高的组分,用Capto Q离子交换柱(2.6 cm×12 cm)进行分离。分离条件为:缓冲液为0.05 mol/mL Tris-HCl溶液(pH 9.5),洗脱液为0.5 mol/mL NaCl溶液,上样体积为10 mL,流速为0.5 mL/min,上样浓度为2 mg/mL,检测波长为220 nm。收集各组分洗脱液冷冻干燥并测定ACE抑制活性。 1.2.8 Sephadex G-15凝胶层析分离 取上一步分离得到ACE抑制活性最高的组分,用Sephadex G-15葡聚糖凝胶层析柱(1.6 cm×70 cm) 进行分离。分离条件为:以超纯水(过0.45 μm滤膜)作为洗脱液,上样浓度为5 mg/mL,检测波长为220 nm,流速为0.5 mL/min,上样体积为2 mL。收集各组分洗脱液冷冻干燥并测定ACE抑制活性。 1.2.9 RP-HPLC分离 取上一步分离得到ACE抑制活性最高的组分,使用YMC-Pack ODS-AQ C18色谱柱(4.0 mm× 250 mm, 5 μm)进行RP-HPLC纯化。分离条件为:流动相A为乙腈,流动相B为超纯水(过0.45 μm滤膜),梯度洗脱程序:0~60 min,乙腈浓度按直线斜率从0%升到60%;上样浓度为5 mg/mL,检测波长为220 nm,流速为1.0 mL/min,上样体积为2 mL。 1.2.10 氨基酸序列鉴定 RP-HPLC分离后得到1个ACE抑制活性较高的组分,使用Thermo LTQ Orbitrap Elite质谱仪进行ESI MS/MS质谱测定其氨基酸序列。样品前处理:将样品冷冻干燥后制成干粉,用超纯水复溶后过0.45 μm滤膜,然后上样。测定条件:上样浓度为300 μg/mL,源加热温度为200 ℃,鞘气流速为8 L/min,辅助气流速为2.5 L/min, 喷雾电压为+3.0 kV,毛细管温度为300 ℃。 1.2.11 数据处理 实验结果用平均值±标准偏差表示(n=3),使用Origin 8.0和SPSS 22.0 软件进行作图和数据分析。 图l为克氏原螯虾虾头模拟胃肠道消化产物不同阶段的水解度和ACE抑制活性。在体外模拟胃消化的阶段中,10~120 min,消化产物的水解度从4.72% 快速上升到13.16%,而其ACE抑制率从10 min 的49.63%缓慢上升到69.73%。由此可知,在体外模拟胃消化的过程中,虾头中的蛋白质在胃蛋白酶的作用下,发生水解,其水解度逐渐增大。 图1 克氏原螯虾虾头模拟消化过程中酶解产物水解度及ACE抑制活性的变化Fig.1 Change of DH and ACE inhibitory activity of the enzymatic hydrolysis products during the simulated digestion of Procambarus clarkia head 同时,由于胃蛋白酶在虾头蛋白上存在特殊作用位点,产生了一部分具有对胃蛋白酶有耐受性,且具有较高ACE抑制活性的多肽,使得消化产物总体的ACE抑制活性缓慢上升。消化产物在模拟肠道消化过程中,120~180 min,消化产物的水解度急剧升高,从13.16%上升到30.98%。这个结果说明,在胰蛋白酶和胰凝乳蛋白酶的作用下,大量虾头蛋白被水解,生成小分子肽类物质。210~390 min,消化产物的水解度变化不大,增加趋势变缓,原因可能是虾头蛋白水解基本完成,并且胰蛋白酶和胰凝乳蛋白酶经过长时间作用,其酶活有所降低[22]。消化产物的ACE抑制活性在进入模拟肠道的消化环境后,开始快速下降,ACE抑制率从120 min的69.73%下降到210 min的54.69%。240~390 min,消化产物的ACE抑制率保持在52.96%~55.43%,整体变化不大。消化产物的小分子肽在模拟胃消化的环境中,对胃蛋白酶的耐受性较强,但对胰酶具有较弱的耐受能力,当进入模拟肠道消化的环境时,部分肽键在胰酶的作用下被切断,导致其ACE抑制活性下降[11,21]。而在240 min后,ACE抑制活性变化不大,说明残留的活性肽在肠道环境中对胰酶具有较强的耐受性,其ACE抑制活性趋于稳定。消化产物在反应结束时,其ACE抑制率为55.43%,此时消化产物一般位于小肠部位,这些小分子肽容易被小肠的上皮细胞吸收到机体内,可以在体内发挥ACE抑制活性。克氏原螯虾虾头模拟消化不同阶段ACE抑制活性的变化规律,与刘建华等[11]报道泰和乌骨鸡肉模拟消化产物ACE抑制活性的结果接近。 通过超滤系统用3 000、5 000和8 000 u的滤膜对克氏原螯虾虾头模拟消化产物进行超滤分级分离,收集透过液和截留液,测定各组分的半数抑制浓度浓度IC50值。结果如图2所示。 图2 模拟消化产物超滤组分的ACE抑制活性Fig.2 ACE inhibitory activity of the ultrafiltration fractions of products under the simulated digestion 测定模拟消化产物(SGDP)和4个超滤组分的ACE抑制活性,其中组分C4(MW<3 000 u)的ACE抑制活性最高,IC50值为0.97 mg/mL。通过超滤膜分离,模拟消化产物ACE抑制活性的IC50值从1.84 mg/mL(SGDP)下降到0.97 mg/mL(组分C4),纯化倍数为1.89倍。 采用高效液相空间排阻法,对ACE抑制活性最高的组分C4分子质量分布进行测定(表1)。组分C4中分子质量分布显示,分子质量在3 000 u以下占67.74%, 其分子质量主要在3 000~2 000 u,占31.28%,数均分子质量和重均分子质量分别为2 286.19 u和2 311.80 u。组分C4的数均分子质量和重均分子质量分别为2 804.55 u和1 894.30 u。研究发现,不同来源的活性肽分子质量各不相同,而同种来源的活性肽在不同的分子质量也会表现出不同的生物活性。国内外的研究学者发现,ACE抑制活性较高的肽类主要集中在3 000 u以下。朱国萍等[24]报道,用虾头制备自溶产物,其3 000 u超滤组分的ACE抑制活性最高。苗欣宇等[13]采用超滤对松仁清蛋白酶解液进行分离,得到3个组分(A1<3 000 u、 A2 3 000~10 000 u和A3>10 000 u),A1组分的ACE抑制率和比活力均高于其他组分。综上,选择组分C4进行Sephadex G-25凝胶层析分离。 表1 组分C4的分子质量分布Table 1 Distribution of peptide molecular weight of fraction C4 利用Sephadex G-25凝胶层析对组分C4进行分离纯化,得到5个组分,分别命名为C4-1、C4-2、C4-3、C4-4和C4-5(图3)。 图3 组分C4的Sephadex G-25分离图谱Fig.3 Chromatogram of fraction C4 separated on Sephadex G-25 将各组分冷冻干燥,取干粉用超纯水溶解,测定各个组分的半数抑制浓度浓度IC50值(图4)。其中组分C4-2的ACE抑制活性最高,IC50值为0.42 mg/mL,与虾头模拟消化产物相比,纯化倍数为4.38倍。因此,选择组分C4-2进行下一步的分离纯化。 图4 Sephadex G-25分离组分的ACE抑制活性Fig.4 ACE inhibitory activity of fractions separated on Sephadex G-25 如图5所示,利用Capto Q离子交换层析对组分C4-2进行分离纯化,得到5个组分,分别命名为C4-2-1、C4-2-2、C4-2-3、C4-2-4和C4-2-5。将各组分冷冻干燥,取干粉用超纯水溶解,测定各个组分的半数抑制浓度浓度IC50值(图6),其中组分C4-2-5的ACE抑制率最高,IC50值为0.29 mg/mL,与虾头模拟消化产物相比,纯化倍数为6.34倍。因此,选择组分C4-2-5进行下一步的分离纯化。 图5 组分C4-2的Capto Q离子交换层析分离图谱Fig.5 Chromatogram of fraction C4-2 separated on Capto Q 图6 Capto Q离子交换层析分离组分的ACE抑制活性Fig.6 ACE inhibitory activity of fractions separated on Capto Q 利用Sephadex G-15凝胶层析对组分C4-2-5进行分离纯化,得到3个组分,分别命名为C4-2-5-1、C4-2-5-2和C4-2-5-3(图7)。测定各个组分的半数抑制浓度浓度IC50值(图8),其中组分C4-2-5的ACE抑制率最高,IC50值为0.18 mg/mL,与虾头模拟消化产物相比,纯化倍数为10.22倍。经过Sephadex G-15凝胶层析分离,组分的ACE抑制活性得到大幅度提升,选择组分C4-2-5-2进行下一步的分离纯化。 图7 组分C4-2-5的Sephadex G-15分离图谱Fig.7 Chromatogram of fraction C4-2-5 separated on Sephadex G-15 图8 Sephadex G-15分离组分的ACE抑制活性Fig.8 ACE inhibitory activity of fractions separated on Sephadex G-15 组分C4-2-5-2经RP-HPLC分离后得到的色谱图如图9所示。 图9 组分C4-2-5-2的RP-HPLC分离图谱Fig.9 Chromatogram of fraction C4-2-5-2 separated on RP-HPLC 由于杂峰较多,选择收集2个主要组分峰,分别命名为C4-2-5-2-1和C4-2-5-2-2,并测定2个组分的半数抑制浓度浓度IC50值(图10),组分C4-2-5-2-1的ACE抑制率最高,IC50值为0.11 mg/mL,组分C4-2-5-2-2的ACE抑制活性稍低,为0.14 mg/mL。对2个组分进行RP-HPLC验证(图11),组分C4-2-5-2-1杂峰较少,成分单一;而组分C4-2-5-2-2的RP-HPLC图谱还有较多的杂峰,成分复杂,因此选择组分C4-2-5-2-1作为单一组分的ACE抑制肽。 图10 RP-HPLC分离组分的ACE抑制活性Fig.10 ACE inhibitory activity of fractions separated on RP-HPLC A-组分C4-2-5-2-1;B-C4-2-5-2-2 图11 组分C4-2-5-2-1和C4-2-5-2-2的RP-HPLC分离图谱Fig.11 Chromagram of fraction C4-2-5-2-1 and C4-2-5-2-2 separated on RP-HPLC 研究表明,高纯度的ACE抑制肽通常采用多种分离方法相结合的方式来进行制备。苗欣宇等[12]采用超滤、Sephadex G-25、Sephadex G-15及反相高效液相色谱对松仁清蛋白酶解液进行分离纯化,获得1个ACE抑制肽Tyr-Leu-Leu-Lys。陈小艺等[26]以鲍鱼内脏多肽酶解液为研究对象,通过超滤、DEAE-52纤维素阴离子交换层析和葡聚糖G-25凝胶层析对其进行分离纯化,最终得到1个胶原ACE抑制肽。朱国萍等[24]从虾头自溶产物中分离纯化得到2条ACE抑制肽(Tyr-Pro和Leu-Pro/Ile-Pro),依次经过超滤、Sephadex G-25 葡聚糖凝胶层析、SP Sephadex C-25离子交换层析及Sephadex G-15葡聚糖凝胶层析纯化,ACE抑制活性提高将近8倍。克氏原螯虾虾头模拟胃肠道消化产物的半抑制浓度IC50值为1.84 mg/mL,依次经过超滤、Sephadex G-25凝胶层析、Capto Q离子交换层析、Sephadex G-15凝胶层析、RP-HPLC,IC50值降到0.11 mg/mL,ACE抑制肽的IC50值纯化了16.72倍(表2)。因此,将组分C4-2-5-2-1作为分离纯化的克氏原螯虾虾头模拟消化产物ACE抑制肽终产物,并对其肽序列进行研究。 表2 模拟消化产物中ACE抑制肽的纯化情况表Table 2 Purification of ACE inhibitory peptide derived from products under the simulated digestion 采用电喷雾静电场离子阱串联质谱(LTQ Orbitrap ESI MS/MS)对组分C4-2-5-2-1的结构进行分析,将分析结果输入PEAKS 7.0 软件通过从头测序法来分析多肽的氨基酸序列[27]。组分C4-2-5-2-1经一级质谱碎裂获得较多的离子片断,从众多离子片断中选择信号较强、分子质量为235.4 u的离子片断进行二级电离(图12、图13)。根据ACE抑制肽二级结构的图谱,通过PEAKS软件的分析推测出b离子碎片和y离子碎片断裂的方式(表3)。对照表3和图13可知,b1=112.2,y1=185.1和离子片段Pro-Val相吻合,因此组分C4-2-5-2-1的氨基酸序列为脯氨酸-缬氨酸(Pro-Val),分子质量为225 u。 研究发现,ACE抑制肽一般是由2~12氨基酸残基组成,大部分为分子质量较小的短肽,其中二肽和三肽居多[28]。KLEEKAYAI等[29]从泰国传统发酵虾膏中分离得到一个ACE抑制肽,其氨基酸序列为Ser-Val。王晶晶等[12]从远东拟沙丁鱼酶解产物中分离出具有较高活性的六肽Lys-Val-Glu-Pro-Leu-Pro和三肽Pro-Ala-Leu,它们的IC50值分别为22.9 μmol/L和12.2 μmol/L。YAMADA等[30]从牛乳酪蛋白水解液中得到一个新型αs2-酪蛋白源新型三肽MKP,其IC50值为0.12 μg/mL。另外,ACE抑制肽的活性也与氨基酸组成由很大的关系。SUETSUNA等[31]对15种鱼虾贝不同来源的ACE抑制肽的结构进行分析,结果发现,贝类ACE抑制肽氨基酸组成多为Asp、Lys和Glu,而鱼类ACE抑制肽氨基酸组成多为Glu、Ile、Asp和Lys。但迄今为止,ACE抑制肽作用机制与结构的关系尚不明确。有研究学者指出,活性肽的C-末端氨基酸残基为芳香族氨基酸残基(Tyr、Trp、Phe)或Pro,N-末端为Pro或疏水性氨基酸残基(Ile、Val、Leu)时,能与ACE产生强烈的结合作用,表现出显著的ACE抑制活性,而C-末端残基在ACE竞争性结合位点上占主导地位[32-33]。组分C4-2-5-2-1的氨基酸序列为脯氨酸-缬氨酸(Pro-Val),其C-末端氨基酸残基为Pro,该结构与前人的研究结果相一致。 表3 组分C4-2-5-2-1可能的几种序列及其b离子与y离子的理论值Table 3 The theory value for b and y ion and the possible sequence of fraction C4-2-5-2-1 图12 组分C4-2-5-2-1的一级质谱图Fig.12 The primary mass spectrogram of fraction C4-2-5-2-1 图13 组分C4-2-5-2-1的二级质谱图Fig.13 Tandem mass spectrum of fraction C4-2-5-2-1 克氏原螯虾虾头通过模拟肠胃道消化进行酶解,消化产物中的ACE抑制肽主要分布在分子质量低于3 000 u 的超滤组分中;通过凝胶色谱、离子色谱、反向高效液相色谱相结合的方法对分子质量小于3 000 u的超滤组分进行分离纯化与筛选,获得了1个新型ACE抑制肽,该活性肽分子质量为225 u,肽序列为Pro-Val;IC50值为0.11 mg/mL,与模拟消化产物相比,IC50值纯化了16.72倍。 本实验研究结果为克氏原螯虾虾头的开发和高附加值利用提供理论依据,同时也可为食源性降血压肽的开发提供研究基础。但本实验仅系统研究了克氏原螯虾虾头模拟胃肠道消化产物ACE抑制肽的分离纯化条件,以及利用质谱鉴定其序列,下一步的工作将人工合成肽与分离的肽相对比,来进一步验证肽序列的准确性,并通过细胞实验和动物学实验来评价降血压功效,2 结果与讨论
2.1 不同阶段消化产物的水解度和ACE抑制活性
2.2 克氏原螯虾虾头模拟胃肠道消化产物的超滤分离
2.3 Sephadex G-25凝胶层析分离

2.4 Capto Q离子交换层析分离


2.5 Sephadex G-15凝胶层析分离

2.6 RP-HPLC分离



2.7 氨基酸序列鉴定

3 结论
