RNAi抑制NOB1表达对肝癌BEL-7402细胞增殖及p38MAPK磷酸化水平的影响
2019-04-03林建清倪亚安毛盛名
张 斌,刘 岳,林建清,倪亚安,毛盛名
广州医科大学附属第六医院(清远市人民医院)肝胆外科 广东清远 511518
肝癌的发生是一个多步骤、多因素引起的复杂病理过程,其受到细胞内多种基因的严格调控[1]。研究[2]显示,肿瘤细胞过度增殖和凋亡减少是肝癌发生及发展的重要原因。Nin1结合蛋白(Nin one binding protein, NOB1)是一种重要的多功能核蛋白,与组织炎症、细胞凋亡等具有密切关系,参与核糖体40S小亚基组成,在肿瘤的发生和发展中发挥促进作用[3-4]。很多研究显示,NOB1在肿瘤中高表达,目前已经证实的有胶质瘤[5]、胃癌[6]、肝癌[7]等。在肺癌细胞中的研究[8]表明,下调NOB1表达可以抑制肺癌细胞的增殖并诱导肺癌细胞凋亡。p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38MAPK)在肝癌中活性降低,阻断其激活可以促进肝癌细胞的增殖[9]。有研究[10]表明,NOB1表达下调可以激活甲状腺癌细胞中p38MAPK信号通路。本研究观察了下调NOB1对肝癌细胞增殖、凋亡及p38MAPK磷酸化水平的影响,探讨靶向NOB1治疗肝癌的可行性,为研究NOB1在肿瘤中的作用机制提供参考。
1 材料与方法
1.1细胞及主要试剂阴性对照(siRNA-NC)慢病毒和NOB1 siRNA慢病毒由上海吉凯基因化学技术有限公司构建包装,siRNA-NC序列为5’-TTCTC CGAACGTGTCACGT-3’,NOB1 siRNA序列为5’-CCAAGGAAGTGCAATTGCATA-3’;肝癌BEL-7402细胞购自南京科佰生物科技有限公司 ;NOB1、β-actin引物由苏州金唯智生物科技有限公司合成;NOB1抗体、p38MAPK抗体购自上海科顺生物科技有限公司;磷酸化p38MAPK(p-p38MAPK)抗体、活化的Caspase-3(C-Caspase-3)抗体购自美国Santa Cruz 公司;CCK-8细胞增殖检测试剂盒购自上海翊圣生物科技有限公司。
1.2细胞分组和慢病毒感染将肝癌BEL-7402细胞接种到24孔板内,每孔1 000个细胞,当细胞融合度达到50%时添加慢病毒颗粒(MOI=10)继续培养10 h,把培养液更换成含体积分数10%胎牛血清的DMEM,培养2 d后以嘌呤霉素筛选稳定感染的肝癌细胞用于后续研究。肝癌细胞分为空白对照组、siRNA-NC组、NOB1 siRNA组 3组,其中siRNA-NC组、NOB1 siRNA组分别为稳定感染siRNA-NC和NOB1 siRNA慢病毒的肝癌细胞,空白对照组为不做慢病毒感染的肝癌细胞。
1.3qRT-PCR检测NOB1表达水平在3组细胞中添加1 mL的Trizol裂解液,吹打混合后,按照Trizol试剂说明书提取总RNA,反转录合成cDNA。反转录体系:10.0 μL的2×反转录缓冲液,1.2 μL的50 nmol的反转录引物,2.0 μL的RNA,0.2 μL的MMLV反转录酶,加DEPC水至20.0 μL。反转录程序:42 ℃ 30 min,85 ℃ 10 min。NOB1 上游引物5’-GAACCGGAGGAAGGAACTCACC-3’,下游引物5’-CCCAGATTTCTCATCTTCCAGTTTG-3’;β-actin 上游引物5’-GGACCTGACTGACTACCTC-3’,下游引物5’-TACTCCTGCTTGCTGAT-3’。PCR反应体系:10.00 μL的2×定量PCR Master Mix,0.08 μL的上、下游引物,2.00 μL的cDNA模板,0.40 μL的Taq DNA聚合酶,2.00 μL的cDNA模板,添加ddH2O至20.00 μL。PCR程序:95 ℃ 180 s;95 ℃12 s,62 ℃ 40 s,共40个循环。采用2-ΔΔCt法计算目的基因的相对表达量。实验重复3次。
1.4Westernblot检测NOB1、p38MAPK、p-p38MAPK、C-Caspase-3表达水平在3组细胞中添加蛋白裂解液,完全裂解后4 ℃高速离心10 min,吸取蛋白上清液,添加Loading Buffer混合,100 ℃反应5 min。配制50 g/L的浓缩胶和100 g/L的分离胶,每孔中添加40 μg的蛋白样品,电泳2.5 h。把PVDF膜放在转移缓冲液中浸泡10 min,以30 mA电流进行半干转移,用50 g/L牛血清白蛋白封闭2 h,再把PVDF膜放在按1∶600稀释的一抗反应液中室温反应2 h。将PVDF膜与二抗孵育反应1.5 h后,添加ECL显色液。用Image J进行灰度值分析,以β-actin作为内参,以目的蛋白与β-actin条带灰度值的比值作为目的蛋白的相对表达量。实验重复3次。
1.5CCK-8法检测细胞增殖情况取3组细胞,用细胞培养液将细胞密度调整为5×105个/mL,接种到96孔培养板中,每孔100 μL,放于体积分数5%CO2、37 ℃的培养箱中孵育,分别在培养1、2、3、4 d后取出培养板,吸弃上清液,加入100 μL新鲜培养液和10 μL的CCK-8反应液孵育4 h,在酶标仪上检测波长450 nm处的吸光度(A)值。实验重复3次。
1.6流式细胞仪检测细胞凋亡情况取3组细胞,用2.5 g/L胰蛋白酶消化后,1 000×g离心10 min,添加冰预冷后的PBS洗涤3次,与300 μL的Binding Buffer混匀,再添加PI和Annexin V-FITC工作液各5 μL,加入200 μL的Binding Buffer混匀,放在避光条件下孵育15 min,在60 min内用流式细胞仪检测细胞凋亡情况。实验重复3次。
1.7统计学处理采用SPSS 21.0进行统计分析。各组间NOB1 mRNA、蛋白相对表达量,A值,凋亡率,C-Caspase-3、p38MAPK、p-p38MAPK蛋白相对表达量的比较均采用单因素方差分析,组间两两比较采用SNK-q检验。检验水准α=0.05。
2 结果
2.1 3组细胞NOB1mRNA、蛋白表达水平的比较NOB1 siRNA能够下调BEL-7402细胞中NOB1的表达,结果见图1和表1。
2.2 3组细胞A值比较NOB1 siRNA组BEL-7402细胞在450 nm处的A值均降低,见表2。

1:空白对照组;2:siRNA-NC组;3:NOB1 siRNA组

组别nNOB1 mRNANOB1蛋白空白对照组31.00±0.010.68±0.09siRNA-NC组31.01±0.150.67±0.06NOB1 siRNA组30.43±0.06∗0.28±0.04∗F38.01235.211P<0.001<0.001
*:与空白对照组、siRNA-NC组比较,P<0.05

表2 3组细胞A值比较
*:与空白对照组、siRNA-NC组比较,P<0.05
2.3 3组细胞凋亡率和C-Caspase-3、p38MAPK、p-p38MAPK蛋白表达的比较NOB1 siRNA组BEL-7402细胞凋亡率升高,细胞中C-Caspase-3、p-p38MAPK蛋白表达水平升高,见图2、3和表3。

1:空白对照组;2:siRNA-NC组;3:NOB1 siRNA组

1:空白对照组;2:siRNA-NC组;3:NOB1 siRNA组
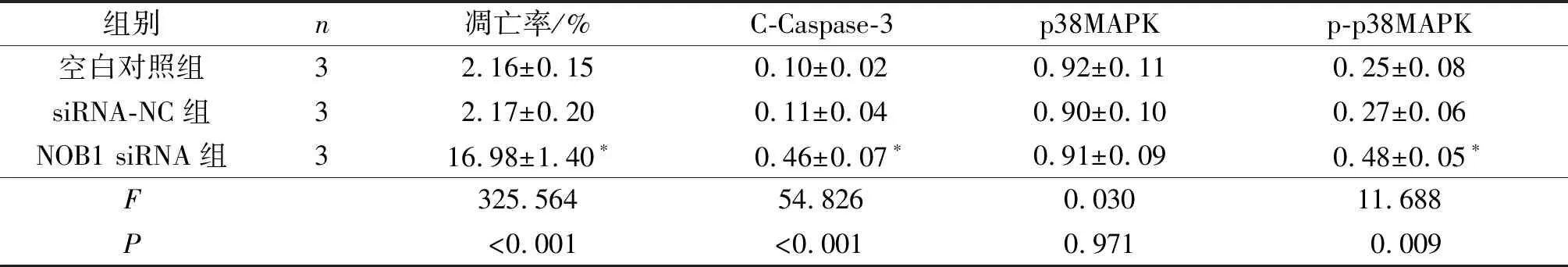
组别n凋亡率/%C-Caspase-3p38MAPKp-p38MAPK空白对照组32.16±0.150.10±0.020.92±0.110.25±0.08siRNA-NC组32.17±0.200.11±0.040.90±0.100.27±0.06NOB1 siRNA组316.98±1.40∗0.46±0.07∗0.91±0.090.48±0.05∗F325.56454.8260.03011.688P<0.001<0.0010.9710.009
*:与空白对照组、siRNA-NC组比较,P<0.05
3 讨论
NOB1具有多种生物学功能,不仅参与调控20S蛋白酶体的成熟,还是19S核糖体调节亚基的组成部分,参与核糖体40S小亚基的组装过程[11],其表达水平的变化可以影响蛋白酶体及核糖体的合成。NOB1在人体的肝脏、脾脏等组织中表达,在结肠、胎盘等组织中低表达,参与人体组织发育和疾病发生[12]。NOB1在卵巢癌组织中的转录和蛋白表达水平均明显高于卵巢良性肿瘤组织和正常卵巢组织,下调NOB1表达可以抑制卵巢癌细胞的增殖能力[13]。在甲状腺癌[10]、卵巢癌[12]、食管癌[14]等肿瘤组织中均已证实NOB1是一种癌基因,下调其表达可以降低癌细胞的增殖能力。NOB1在肝癌组织中的表达水平高于正常肝组织和肝硬化组织,且NOB1表达水平的高低与肿瘤的大小有关[7]。
增殖和凋亡是细胞重要的生物学特性,是细胞维持内环境稳定的重要途径之一,细胞恶性增殖、凋亡减少是肿瘤发生的重要原因[15]。Caspase-3是目前公认的细胞凋亡促进因子,其在正常情况下以没有活性的酶原形式存在,只有活化后才具有诱导细胞凋亡的作用,Caspase-3活化也是细胞凋亡不可逆反应的标志[16]。研究[17-18]表明,下调NOB1可以通过激活Caspase诱导细胞凋亡。本研究结果表明,RNAi下调NOB1表达后的肝癌BEL-7402细胞增殖能力降低,同时细胞凋亡率升高,细胞中Caspase-3活化水平升高,下调NOB1具有抑制肝癌细胞增殖并诱导肝癌细胞凋亡的作用。
p38MAPK蛋白是由360个氨基酸组成的蛋白质,其在人体组织中均有表达,在细胞凋亡、炎性反应、氧化应激等过程中具有关键调控作用,参与多种疾病的发生[19]。研究[20]显示,p38MAPK过度激活抑制肿瘤的发生,p38MAPK在肿瘤组织中磷酸化水平降低,促进其激活后可以逆转肿瘤细胞过度增殖等恶性表型。p38MAPK不仅参与肿瘤细胞的凋亡过程,还参与NOB1调控肿瘤细胞增殖的过程,在甲状腺癌的研究[10]中发现,NOB1具有负调控细胞中p38MAPK活化水平的作用。本实验结果表明,下调NOB1后的肝癌BEL-7402细胞中p38MAPK磷酸化水平升高。
NOB1在肝癌中发挥癌基因的作用,可能是肝癌治疗的潜在靶点,下调NOB1具有抑制肝癌细胞增殖并诱导肝癌细胞凋亡的作用,其作用机制可能与激活p38MAPK有关,这证实了NOB1在肝癌细胞中的作用。本实验没有对其具体的作用机制进行验证,在后续实验中会对上述部分进行深入研究。
