大鼠皮肤癌痛模型的建立
2019-04-03黄厚芹刘岳鹏何学明
黄厚芹, 刘岳鹏, 吴 晓, 何学明
1)蚌埠医学院附属连云港市东方医院老年医学科 江苏连云港 222042 2)蚌埠医学院附属连云港市东方医院转化医学中心 江苏连云港 222042 3)东南大学附属江阴医院老年科 江苏江阴 214400
15261379088@139.com;吴晓,通信作者,女,1991年10月生,硕士,主治医师,研究方向:慢性疼痛的发病机制,E-mail:15743968068@qq.com
为了阐明癌痛的机制,合适的动物模型不可或缺。骨癌痛模型是目前应用最广泛的动物模型,但是其制作较为复杂[1]。皮肤癌痛模型以其便利性获得了较为普遍的关注[2-4]。目前最常用的皮肤癌痛模型是在小鼠足底皮下注射B16黑色素瘤细胞制作而成[2-3],然而,该模型在实践过程中显示出易转移、成模时间长、小鼠存活率低等缺点,因此有必要建立一种新的皮肤癌痛模型。另外,大鼠是疼痛机制研究较常用的动物,已经积累了丰富的研究资料。研究[5]显示,将大鼠乳腺癌Walker256细胞接种到大鼠胫骨或跟骨骨髓腔内制作的骨癌痛模型表现出对骨组织明显的侵蚀,体现了癌痛发生的特点之一 ——破坏机体组织,提示Walker256可能是一种适用于制作大鼠皮肤癌痛模型的细胞。作者探讨了将Walker256细胞接种于大鼠足底皮下建立大鼠皮肤癌痛模型的可行性。
1 材料与方法
1.1材料健康成年雄性SD大鼠,体重180~220 g,购自南京医科大学。分笼饲养,实验室温度保持在22~24 ℃,湿度保持在40%~60%,12 h昼夜周期光照,自由进食、饮水。本实验遵守实验室操作规范及国际疼痛学会关于应用清醒动物进行疼痛实验研究纲要的要求。Walker256细胞系购自中科院上海生命科学研究院细胞库,由作者所在医院转化医学中心实验室冻存备用。Masson染色试剂盒购自福建迈新公司。山羊抗鼠GFAP抗体购自Santa Cruz公司,山羊抗鼠Iba1抗体购自Abcam公司,神经生长因子(nerve growth factor, NGF)ELISA检测试剂盒购自RD公司,白细胞介素-1β(interleukin-1beta, IL-1β)ELISA检测试剂盒购自Alpco公司,肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)ELISA检测试剂盒购自Merck Millipore公司。VonFrey动态足底触觉测量仪(意大利UGO公司),辐射热测痛仪(IITC公司),PV-200足趾容积测量仪(成都泰盟科技有限公司)。
1.2Walker256细胞的复苏取出Walker256细胞的冻存管,37 ℃水浴中快速振荡解冻。细胞复苏后放入离心管中,1 000 r/min离心 5 min,弃上层液体,加入等量的PBS,轻轻吹打混匀,再次1 000 r/min离心 5 min,弃上层液体,加少量PBS悬浮细胞。吸取细胞悬液并用PBS稀释至3 mL,轻轻吹打混匀;利用细胞计数器计数细胞,并以PBS配制密度为 4×107个/mL的细胞悬液,置于冰箱内备用。
1.3大鼠皮肤癌痛模型的制备及分组30只大鼠随机分为正常对照组、假接种组及模型组,每组10只。后2组大鼠以异氟烷麻醉,用体积分数75%乙醇消毒足垫皮肤,模型组用1 mL注射器将密度为4×107个/mL的 Walker256细胞悬液(200 μL)缓慢注入大鼠足垫皮下,针头停滞 30 s~1 min后缓慢退针,局部按压 1 min;假接种组接种等量高温灭活Walker256细胞。大鼠苏醒后送回笼中继续饲养。正常对照组不接种。
1.4大鼠后足跖面肿瘤生长情况观察接种前1天及接种后第 2、5、8、11、14、17天,异氟烷麻醉大鼠,观察足跖面肿瘤生长情况,并用PV-200足趾容积测量仪测量大鼠足体积。以接种前1天所测足体积为基础值,接种后所测足体积减去基础值即为增量足体积。
1.5机械痛敏检测分别于接种前1天,接种后第2、5、8、11、14、17天采用VonFrey动态足底触觉测量仪测定大鼠机械缩足阈值。将大鼠置于底部为金属网格的有机玻璃盒子(30 cm×20 cm×15 cm)中,适应20 min后于静息状态下开始测定。VonFrey丝由下向上垂直刺激大鼠足垫部皮肤,设定10 s内刺激强度由0逐渐升高,当出现快速缩足反应时,刺激自动停止,记录刺激强度(以g为单位)。共测3次,每次间隔3 min,取其平均值作为该时间点的机械缩足阈值。
1.6热痛敏检测分别于接种前1天,接种后第2、5、8、11、14、17天采用辐射热测痛仪测定大鼠热缩足潜伏期。将大鼠置于22 cm×12 cm×12 cm的盒中,底部为光滑透明玻璃板,适应20 min后,用辐射热测痛仪照射大鼠后肢足垫部(左、右足不拘,习惯性选右足)。当大鼠抬足回避时停止照射并记录照射时间,即为大鼠的热缩足潜伏期。热辐射强度设定为能引起大鼠在20 s内缩足的强度,为了防止大鼠足底被烫伤,将热缩足潜伏期的上限设为30 s,如果超过30 s大鼠仍未抬足,热刺激将自动终止,并记录为30 s。照射3次,每次间隔5~6 min,取其平均值作为该时间点的热缩足潜伏期。
1.7大鼠皮肤组织细胞因子水平测定另取大鼠,分为3组,同上处理,分别用于1.7和1.8中检测。假接种组(接种后第3天)和模型组(接种后第3、7、14天)各取6只大鼠,取接种皮肤组织,采用ELISA法检测NGF、IL-1β和TNF-α水平,实验步骤按照说明书进行。
1.8足底皮肤组织病理学检测和脊髓星形胶质细胞和小胶质细胞活化检测接种后第7、14天,热痛敏及之前的检测完成后,3组各取4只大鼠,麻醉下迅速暴露心脏,用40 g/L多聚甲醛经左心室灌注处死大鼠,分别取足底皮肤组织和L4~L6段脊髓组织。皮肤组织用40 g/L多聚甲醛固定24 h后,加入400 g/L蔗糖脱水,冰冻切片,Masson染色(参照试剂盒说明书),显微镜(×200)下观察。脊髓组织常规固定,加入400 g/L蔗糖脱水,冰冻连续切片(片厚15 μm),免疫组化法检测星形胶质细胞标志物GFAP和小胶质细胞标志物Ibal的表达。首先用体积分数3%双氧水处理10 min以灭活内源性过氧化物酶,然后加入含体积分数5%驴血清的封闭液,室温孵育30 min,再加入山羊抗鼠GFAP抗体(1∶200稀释)或山羊抗鼠Iba1抗体(1∶400稀释),4 ℃孵育12 h后,PBS洗涤3次,加入相应辣根过氧化物酶标记的二抗,室温孵育2 h后,PBS洗涤3次,DAB显色,脱水透明后封片,显微镜下观察。
1.9统计学处理用 SPSS 22.0处理数据。采用重复测量数据的方差分析比较3组大鼠疼痛行为学数据的差异;采用单因素方差分析比较大鼠形态学数据和细胞因子水平的差异,两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1肿瘤生长情况及足体积的变化模型组从接种后第2天开始出现不同程度的红肿,随着时间的推移,红肿情况进一步加重,至观察结束仍无消退迹象。假接种组从接种后第2天开始出现红肿,第8天红肿消退。正常对照组无变化。见图1。
模型组大鼠增量足体积从接种后第2天开始逐渐增加,假接种组个别大鼠增量足体积在接种后第2、5、8天出现小幅升高,正常对照组无变化(图2)。
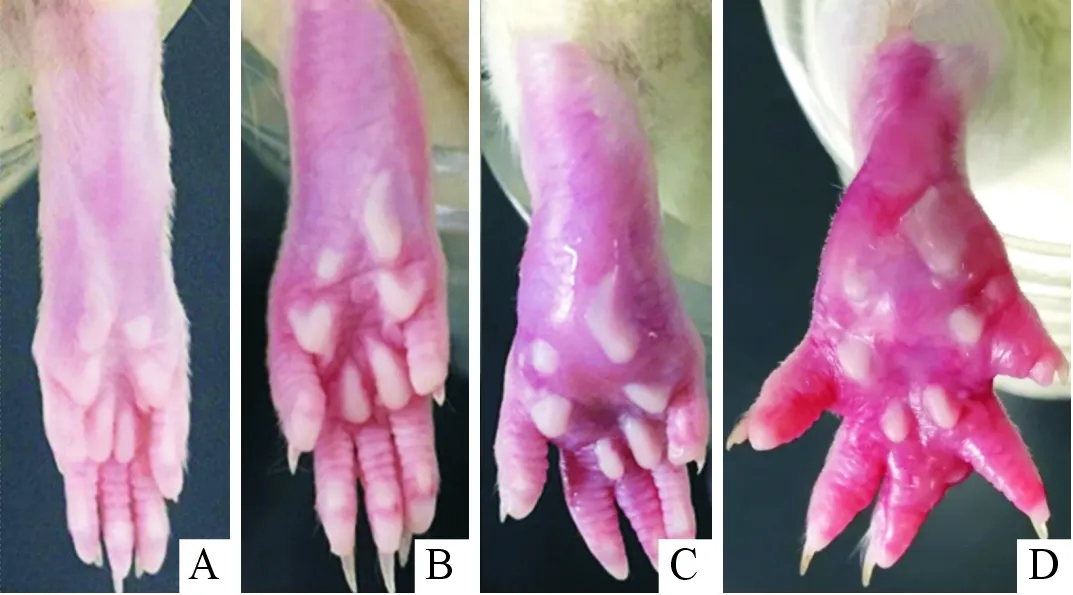
A:正常对照组;B:假接种组(接种后第5天);C:模型组(接种后第14天);D:模型组(接种后第17天)
图1接种不同时间3组大鼠足底的大体形态

图2 接种不同时间3组大鼠增量足体积比较
2.2机械痛敏检测接种前1天及接种后第2、5天,各组大鼠机械缩足阈值比较差异无统计学意义。正常对照组和假接种组的机械缩足阈值稳定在一定的水平。模型组的机械缩足阈值逐渐降低,与假接种组比较,在接种后第8、 11、14、17天,差异有统计学意义(表1)。

表1 不同接种时间3组大鼠机械缩足阈值比较(n=10) g
F组间=455.756,F时间=49.339,F交互=81.762,P均<0.001;*:与假接种组比较,P<0.05
2.3热痛敏检测接种前1天及接种后第2、5天,各组大鼠热缩足潜伏期比较,差异均无统计学意义。正常对照组的热缩足潜伏期稳定在一定的水平。假接种组的热缩足潜伏期在接种后第2天最低,随后上升,在接种后第8天与正常对照组相当。模型组的热缩足潜伏期逐渐降低,与假接种组比较,在接种后第8、 11、14及17天差异有统计学意义(表2)。

表2 不同接种时间3组大鼠热缩足潜伏期比较(n=10) s
F组间=254.245,F时间=35.689,F交互=75.658,P均<0.001;*:与假接种组比较,P<0.05
2.4模型组和假接种组皮肤组织细胞因子水平检测模型组大鼠接种肿瘤细胞后,荷瘤皮肤组织内NGF、IL-1β和TNF-α的水平随肿瘤的生长而增加,与假接种组(接种后第3天)比较差异有统计学意义(表3)。假接种组的细胞因子水平以接种后第3天为代表,因为预实验显示随时间延长假接种组细胞因子水平无明显变化。
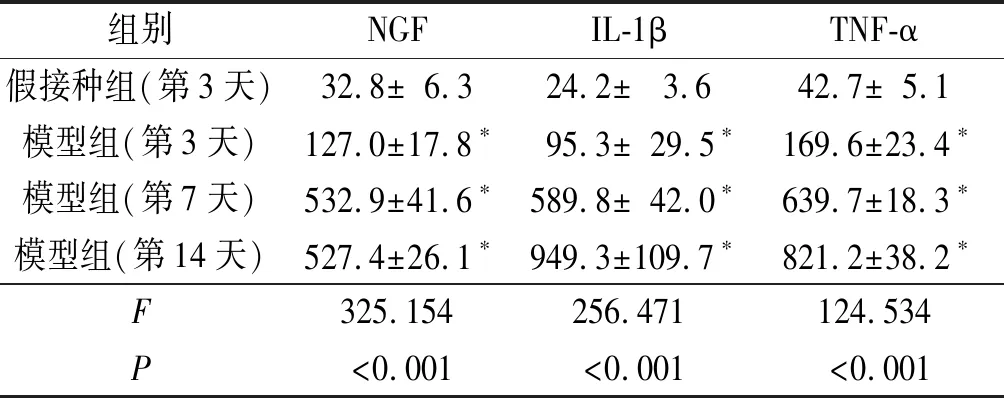
表3 3组大鼠接种部位皮肤 组织内NGF、IL-1β、TNF-α水平比较(n=6) pg/g
*:与假接种组比较,P<0.05
2.5足底皮肤组织病理学表现Masson染色后光镜下可见模型组接种后第14天大鼠足垫部皮下组织
出现大量肿瘤细胞浸润,肿瘤细胞生长活跃(图3)。
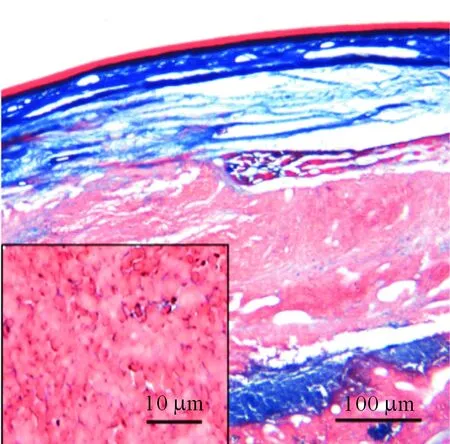
小图为肿瘤细胞放大显示图;红色染色为肿瘤组织,其间夹杂部分蓝染细胞
图3模型组(接种后 第14天)皮肤组织肿瘤细胞生长情况
2.6脊髓星形胶质细胞和小胶质细胞活化检测假接种组接种后第3天大鼠脊髓无明显活化的小胶质细胞及星形胶质细胞,而模型组接种后第7天及14天脊髓背角小胶质细胞及星形胶质细胞活化明显(图4)。

A:假接种组(接种后第3天)GFAP的表达;B、D:模型组(接种后第7、14天)GFAP的表达;F:假接种组(接种后第3天)Iba1的表达;G、I:模型组(接种后第7、14天)Iba1的表达;C、E、H、J:各自图片指示位置的放大图,黑色三角符号指示放大图所在位置
图4 3组大鼠脊髓星形胶质细胞及小胶质细胞活化检测(×200)
3 讨论
本研究尝试将Walker256细胞注射到大鼠足底皮下,以制作大鼠皮肤癌痛模型,结果显示,接种后大鼠足底皮肤红肿,同时,接种后第8、11、14、17天,大鼠机械缩足阈值和热缩足潜伏期均逐渐降低,较高程度模拟了癌症造成的疼痛。癌痛发生的机制现在还不完全清楚,有两点是较为公认的:第一,神经损伤因素,即瘤体扩张机械压迫或者肿瘤细胞浸润破坏周围组织结构和神经纤维而引起疼痛。骨癌痛模型和小鼠皮肤癌痛模型都显示出肿瘤细胞对原有组织的破坏[4,6]。疼痛刺激传入中枢会迅速激活星形胶质细胞,阻断星形胶质细胞激活或其相关信号通路均可镇痛[7],表明星形胶质细胞在疼痛中发挥了重要作用。另外,癌痛刺激传入中枢使小胶质细胞被大量激活[8],脊髓小胶质细胞活化是神经损伤的常见表现之一[9],小胶质细胞活化在骨癌痛模型已经被发现[10],但在皮肤癌痛模型中是否存在尚未见报道。本研究中Masson染色显示,接种的癌细胞破坏了皮肤组织,且免疫组化显示脊髓有星形胶质细胞和小胶质细胞的活化。第二,化学因子致痛。肿瘤微环境中产生的化学因子降低了局部神经纤维的反应阈值,引起神经过敏。研究[8]表明 NGF、脑源性神经营养因子、 IL-1β、TNF-α、白细胞介素(interleukin 6,IL-6)和转化生长因子β(transforming growth factor, TGF-β)等都参与了癌痛的形成。本研究显示荷瘤皮肤组织内NGF、IL-1β和TNF-α的表达增加,提示炎症因子可能参与了Walker256细胞导致的痛觉过敏。
该模型还体现出以下优点。首先,制作过程简便。骨癌痛模型的制作要求培养的Walker256细胞要经过腹腔接种培养出活性较好的细胞[1],而在本研究中,培养的Walker256细胞直接接种即可成功在皮下生长;其次,动物死亡率低,实验过程中未观察到动物死亡;第三,肿瘤局限,不转移。
模型制作中需要注意以下几点。①建立此癌痛模型时宜选用大鼠建模。预实验过程中曾试用昆明小鼠建模,未观察到肿瘤细胞的生长。②假接种组在最初几天,动物足部也会表现出一定程度红肿,足体积测量也有一定程度的增加,但是随后红肿情况消失,猜测为灭活肿瘤细胞诱导大鼠短暂免疫反应所致。
总之,SD 大鼠足底注射乳腺癌Walker256细胞可建立皮肤癌痛模型,该模型成功率高,死亡率低,简单易行,为探讨癌痛机制提供了便利的研究工具。
