芹菜品种‘津南实芹’AgICE1基因的克隆及其对非生物胁迫的响应
2019-04-02杨青青刘洁霞徐志胜熊爱生
杨青青, 刘洁霞, 徐志胜, 冯 凯, 黄 莹, 熊爱生
(南京农业大学园艺学院 作物遗传与种质创新国家重点实验室 农业部华东地区园艺作物生物学与种质创制重点实验室, 江苏 南京 210095)
芹菜(ApiumgraveolensLinn.)隶属于伞形科(Apiaceae)芹属(ApiumLinn.),是一种重要的叶菜类蔬菜作物。芹菜原产于地中海和中东地区,在中国有着悠久的栽培历史[1]。芹菜具有较高的营养和药用价值,富含类胡萝卜素、维生素、类黄酮以及挥发性芳香成分,全株可入药[2]。非生物胁迫是影响芹菜生长发育、产量和品质的重要因子,如高温、低温、干旱和盐胁迫会破坏芹菜细胞的膜结构,打乱植株自身的水分平衡,对芹菜植株的生长发育产生较大的影响,进而影响芹菜的产量和品质[3]。
ICE(inducerofCBFexpression)基因是诱导CBF基因家族表达的转录激活因子,在植物中普遍存在。已有研究结果[4]表明:ICE蛋白定位于细胞核中,在低温条件下,ICE蛋白被激活,达到活跃状态,可以和CBF基因启动子区的顺式作用元件有效结合,激活植物体内响应冷胁迫相关的代谢来抵御寒冷胁迫。对植物抗寒分子机制的研究结果[5]表明:冷胁迫会诱导植物体内抗冻相关基因的表达,并且冷诱导基因(COR)在高等植物体内普遍存在。ICE基因在植物遭遇低温胁迫时,能够识别CBF基因启动子中的冷调控元件ICE box,诱导CBF/DREB调控下游基因的转录表达,从而提高植物的抗寒性[6-7]。ICE蛋白可以通过多种方式调控不同低温应答基因[7]。近年来,人们对植物抗寒基因ICE的研究取得了一定的进展,ICE1基因的发现为提高植物的抗寒性提供了新的途径。目前,已经从茶树〔Camelliasinensis(Linn.) O. Ktze.〕[4]、拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕[8]、异色菊〔Chrysanthemumdichrum(C. Shih) H. Ohashi et Yonek.〕[9]、萝卜(RaphanussativusLinn.)[10]、苹果(MaluspumilaMill.)[11]和胡萝卜(Daucuscarotavar.sativaHoffm.)[12]等植物中分离鉴定出ICE基因,且通过转基因验证发现,转入ICE基因的植物抗逆性均有提高[13]。
芹菜品种‘津南实芹’(‘Jinnan Shiqin’)植株紧凑直立、分枝少、颜色淡绿、叶片肥大、不易先期抽薹,在中国南北地区四季均可以栽培[14]。本研究从芹菜品种‘津南实芹’中克隆得到AgICE1基因,对该基因进行生物信息学分析,利用实时荧光定量PCR(RT-qPCR)检测AgICE1基因在高温、低温、干旱及高盐4种非生物胁迫下的相对表达水平,以期为进一步开展芹菜ICE转录因子的逆境调控机制研究奠定基础,并为深入了解AgICE1基因在芹菜抵御非生物胁迫中的功能提供依据。
1 材料和方法
1.1 材料
芹菜品种‘津南实芹’由南京农业大学作物遗传与种质创新国家重点实验室提供。供试材料栽植于昼温25 ℃、夜温18 ℃、光照时间16 h·d-1、光照强度300 μmol·m-2·s-1、空气相对湿度60%~70%的人工气候室内。采集4月龄植株的根、叶柄和叶片,样品采集后立即用液氮速冻后置于-80 ℃冰箱,用于总RNA提取、cDNA合成及基因表达分析[15]。此外,选取长势均一的4月龄植株进行高温(38 ℃)、低温(4 ℃)、干旱(质量体积分数20% PEG6000)和高盐(0.2 mol·L-1NaCl)4种非生物胁迫处理,对照组用ddH2O处理,每个处理设置3组生物学重复。分别取处理0、1、2、4、8和24 h植株上部生长健康的叶片,采用上述方法速冻,用于总RNA提取、cDNA合成及基因表达分析。
大肠杆菌菌株DH5α为南京农业大学作物遗传与种质创新国家重点实验室保存;凝胶回收试剂盒购自康宁生命科学(吴江)有限公司;引物合成由南京金斯瑞生物科技有限公司完成;pMD19-T质粒载体、TaqDNA聚合酶、DNA marker DL2000、SYBR®PremixExTaqTM试剂盒均购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 基因克隆 基于作者所在课题组保存的芹菜转录组和基因组数据库[16],通过与其他物种ICE基因序列BLAST比对分析获得芹菜品种‘津南实芹’ICE1基因的序列。根据开放阅读框(ORF)序列设计扩增引物,芹菜品种‘津南实芹’ICE1基因正向引物AgICE1-F的序列为5′-A ̄T ̄G ̄C ̄T ̄C ̄C ̄C ̄C ̄A ̄C ̄C ̄T ̄C ̄A ̄A ̄A ̄C G ̄A ̄C ̄G ̄T-3′,反向引物AgICE1-R的序列为5′-C ̄T ̄A A ̄A ̄T ̄T ̄G ̄C ̄G ̄C ̄C ̄A ̄T ̄G ̄A ̄A ̄A ̄A ̄C ̄C ̄A ̄G-3′。以‘津南实芹’叶片的cDNA为模板进行PCR反应,PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s、54 ℃退火30 s、72 ℃延伸60 s,34个循环;72 ℃延伸10 min。PCR反应体系总体积20 μL,包含cDNA模板1 μL、正向引物和反向引物各1 μL、ddH2O 7 μL以及ExTaq酶10 μL。PCR反应产物用质量浓度12 g·L-1的琼脂糖凝胶电泳进行分离检测,回收产物连接pMD19-T质粒载体,并转化到大肠杆菌菌株DH5α中,挑取单菌落摇菌,经PCR检测后交由南京金斯瑞生物科技有限公司进行测序验证。
1.2.2 氨基酸序列分析 各植物ICE转录因子氨基酸序列均来自NCBI数据库,采用ExPASy网站(https:∥web.expasy.org/protparam/)的相关软件对芹菜品种‘津南实芹’ICE1转录因子的氨基酸组成、理论相对分子质量和理论等电点(pI)进行分析[17];采用DNAMAN软件进行ICE1转录因子氨基酸序列的多重比对及蛋白质的亲水性和疏水性预测,利用Blast Conserved Domains Search(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)对芹菜品种‘津南实芹’ICE1转录因子氨基酸序列进行保守域预测,采用MEGA5对进化树进行测试和编辑,生成报告图形[18]。
1.2.3 RT-qPCR 根据SYBR®PremixExTaqTM试剂盒操作说明进行RT-qPCR,然后通过IQTM5 Real-time PCR System完成RT-qPCR检测。相对表达水平的计算采用参照基因的ΔCT法,相对表达水平是基于处理组与对照组之间目标基因相对内参基因表达量的比较[19]。以芹菜的actin基因作为内参基因,该基因正向引物的序列为5′-A ̄G ̄A ̄A ̄G ̄T ̄C ̄C ̄T ̄G ̄T ̄T ̄C ̄C ̄A G ̄C ̄C ̄G ̄T ̄C ̄T ̄T-3′,反向引物的序列为5′-C ̄G ̄A ̄A ̄C ̄C ̄A ̄C C ̄A ̄C ̄T ̄G ̄A ̄G ̄C ̄A ̄C ̄T ̄A ̄T ̄G ̄T ̄T-3′。用于AgICE1基因表达分析的正向引物AgICE1-qF的序列为5′-C ̄T ̄G ̄C ̄T ̄T ̄T A ̄T ̄C ̄C ̄C ̄C ̄T ̄G ̄C ̄A ̄T ̄T ̄T ̄C ̄C ̄T-3′,反向引物AgICE1-qR的序列为5′-C ̄A ̄G ̄T ̄A ̄C ̄T ̄A ̄G ̄T ̄T ̄A ̄A ̄C ̄A ̄A ̄A ̄G ̄C ̄T ̄A ̄A-3′。同时扩增内参基因与目标基因,每个样品分别设置3个生物学重复和3个技术重复。PCR反应体系总体积20.0 μL,包含ddH2O 7.2 μL、SYBR Green Ⅰ mix 10.0 μL,cDNA模板2.0 μL以及正向荧光定量引物和反向荧光定量引物各0.4 μL。RT-qPCR反应程序为:95 ℃预变性30 s;95 ℃变性5 s、60 ℃退火延伸20 s,共40个循环;通过从65 ℃至95 ℃逐步扩增加热获得熔解曲线。
采用Duncan’s新复极差法对数据进行多重比较,采用one-way ANOVA对数据进行差异显著性分析,采用EXCEL 2007和SPSS 20.0统计分析软件分析RT-qPCR数据。
2 结果和分析
2.1 芹菜品种‘津南实芹’ICE1基因的克隆
以芹菜品种‘津南实芹’未经胁迫处理叶片的cDNA为模板,用引物AgICE1-F和AgICE1-R进行PCR扩增,得到1条长约1 400 bp的目的片段(图1),片段大小与预期一致。将回收产物依次进行连接、转化及测序,获得芹菜品种‘津南实芹’ICE1基因的开放阅读框(ORF)序列,命名为AgICE1基因。测序结果(图2)显示:克隆得到的AgICE1基因含有1个长度为1 455 bp的开放阅读框,编码484个氨基酸。
2.2 芹菜品种‘津南实芹’AgICE1转录因子的氨基酸序列及其理化性质分析
通过DNAMAN软件对氨基酸序列进行比对,结果表明:芹菜品种‘津南实芹’AgICE1转录因子的氨基酸序列与大豆〔Glycinemax(Linn.) Merr.〕、拟南芥和欧洲油菜(BrassicanapusLinn.)等植物的ICE1转录因子的氨基酸序列一致性较高(图3)。
氨基酸组成及理化性质分析结果(表1)显示:芹菜品种‘津南实芹’AgICE1转录因子和其他植物ICE1转录因子的氨基酸序列的理论相对分子质量在36 000~59 000之间,氨基酸残基数在340~540之间,脂肪族氨基酸的比例明显高于芳香族氨基酸的比例,芹菜品种‘津南实芹’AgICE1转录因子中酸性氨基酸的比例高于碱性氨基酸的比例,而其他植物ICE1转录因子中的碱性氨基酸的比例均高于酸性氨基酸的比例。

*: 终止密码子Stop codon.

Ag: 芹菜品种‘津南实芹’Cultivar ‘Jinnan Shiqin’ of Apium graveolens Linn.; Gm: 大豆Glycine max (Linn.) Merr.; At: 拟南芥Arabidopsis thaliana (Linn.) Heynh.; Bn: 欧洲油菜Brassica napus Linn.; Sl: 番茄Solanum lycopersicum Linn.; Mp: 苹果Malus pumila Mill.; Rs: 萝卜Raphanus sativus Linn.; La: 独行菜Lepidium apetalum Willd.; Bro: Brassica rapa subsp. oleifera (DC.) Metzg.
表1芹菜品种‘津南实芹’AgICE1转录因子和其他植物ICE1转录因子的氨基酸组成及理化性质
Table1AminoacidcompositionandphysicochemicalpropertyofAgICE1transcriptionfactorfromcultivar‘JinnanShiqin’ofApiumgraveolensLinn.andICE1transcriptionfactorsfromotherspecies

种类1)Species1)登录号Accession No.氨基酸残基数Number of amino acid residue理论相对分子质量Theoretical relative molecular mass理论等电点Theoretical isoelectric point比例/% Percentage碱性氨基酸Basic amino acid酸性氨基酸Acidic amino acid脂肪族氨基酸Aliphatic amino acid芳香族氨基酸Aromatic amino acid总平均疏水性Grand average of hydrophobicityAgAgr22229484531 3615.0911.613.056.47.5-0.533GmNM_001254339.1531494 1475.4112.610.274.46.5-0.524AtAY195621.1404535 3895.5311.69.669.36.7-0.519BnJF268687.1499532 1415.0511.48.868.26.4-0.415SlJX625139.1531583 3715.3811.89.669.07.0-0.569MpEF495202.1531574 0015.5112.010.172.25.5-0.532RsHQ891287.1421457 9545.4112.812.173.36.9-0.444LaAGZ13680.1344368 3599.7213.27.380.07.3-0.032BroADZ24264.1497530 4945.1111.49.071.76.2-0.417
1)Ag: 芹菜品种‘津南实芹’Cultivar ‘Jinnan Shiqin’ ofApiumgraveolensLinn.; Gm: 大豆Glycinemax(Linn.) Merr.; At: 拟南芥Arabidopsisthaliana(Linn.) Heynh.; Bn: 欧洲油菜BrassicanapusLinn.; Sl: 番茄SolanumlycopersicumLinn.; Mp: 苹果MaluspumilaMill.; Rs: 萝卜RaphanussativusLinn.; La: 独行菜LepidiumapetalumWilld.; Bro:Brassicarapasubsp.oleifera(DC.) Metzg.
利用Blast Conserved Domains Search分析芹菜品种‘津南实芹’AgICE1转录因子氨基酸序列的保守域,结果(图4)显示:AgICE1转录因子氨基酸序列在第300位至第346位氨基酸间含有bHLH保守域。

图4 芹菜品种‘津南实芹’AgICE1转录因子氨基酸序列的保守域预测
2.3 芹菜品种‘津南实芹’AgICE1转录因子的进化分析
根据芹菜品种‘津南实芹’AgICE1转录因子与其他植物的ICE1转录因子的氨基酸序列构建系统进化树。
结果(图5)显示:伞形科的芹菜品种‘津南实芹’与蔷薇科(Rosaceae)的苹果的进化关系最近。十字花科(Brassicaceae)的欧洲油菜、Brassicarapasubsp.oleifera(DC.) Metzg.、拟南芥和萝卜聚为同一分支,茄科(Solanaceae)的番茄(SolanumlycopersicumLinn.)以及芹菜品种‘津南实芹’和苹果聚为同一分支,但是豆科(Fabaceae)的大豆和十字花科的独行菜(LepidiumapetalumWilld.)分别聚为单独的分支。总体上看,ICE1转录因子在不同植物间呈现明显的种属特性,同科植物的亲缘关系更近。
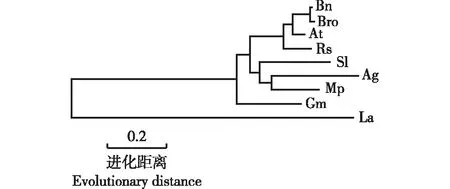
Ag: 芹菜品种‘津南实芹’Cultivar ‘Jinnan Shiqin’ of Apium graveolens Linn.; Gm: 大豆Glycine max (Linn.) Merr.; At: 拟南芥Arabidopsis thaliana (Linn.) Heynh.; Bn: 欧洲油菜Brassica napus Linn.; Sl: 番茄Solanum lycopersicum Linn.; Mp: 苹果Malus pumila Mill.; Rs: 萝卜Raphanus sativus Linn.; La: 独行菜Lepidium apetalum Willd.; Bro: Brassica rapa subsp. oleifera (DC.) Metzg.
2.4 芹菜品种‘津南实芹’AgICE1转录因子氨基酸序列的亲水性和疏水性分析
采用DNAMAN软件对芹菜品种‘津南实芹’AgICE1转录因子氨基酸序列进行亲水性和疏水性分析,结果(图6)表明:AgICE1转录因子氨基酸序列的亲水性区域中,第300位至第312位氨基酸亲水性最强;疏水性区域中,第441位至第447位氨基酸疏水性最强。总体上看,AgICE1转录因子氨基酸序列的亲水性区域多于疏水性区域,为亲水性蛋白。
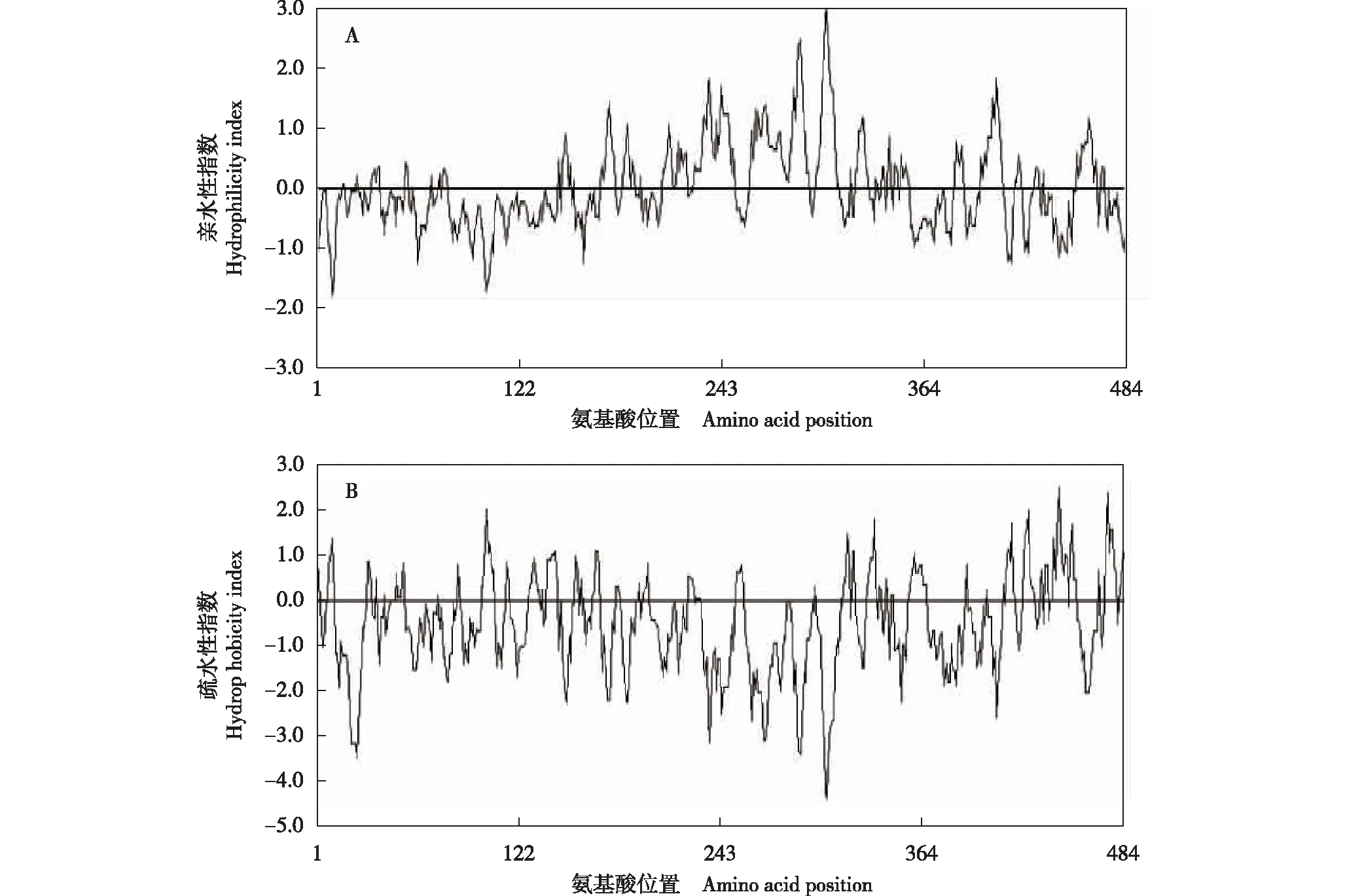
图6 芹菜品种‘津南实芹’AgICE1转录因子氨基酸序列的亲水性(A)和疏水性(B)
2.5 芹菜品种‘津南实芹’AgICE1基因在不同组织和逆境处理下的表达特性分析
RT-qPCR检测结果(图7)表明:芹菜品种‘津南实芹’根、叶柄以及叶片中均能够检测到AgICE1基因的表达,但其在不同组织中相对表达水平的差异较大。AgICE1基因在叶片中的相对表达水平显著高于根和叶柄中的相对表达水平,且根和叶柄间相对表达水平的差异不显著。
高温(38 ℃)、低温(4 ℃)、干旱(质量体积分数20% PEG6000)和高盐(0.2 mol·L-1NaCl)4种非生物胁迫处理下芹菜品种‘津南实芹’叶片中AgICE1基因的相对表达水平见图8。结果表明:不同非生物胁迫处理下芹菜品种‘津南实芹’叶片中AgICE1基因的相对表达水平差异较大。
高温处理1 h,AgICE1基因的相对表达水平较处理0 h略有降低;高温处理2、4和8 h,AgICE1基因的相对表达水平较处理0 h有所升高,分别为处理0 h的2.48、4.67和2.61倍;高温处理24 h,AgICE1基因的相对表达水平较处理0~8 h显著升高,为处理0 h的9.45倍。
低温处理1 h,AgICE1基因的相对表达水平较处理0 h升高,为处理0 h的1.66倍;低温处理4 h,AgICE1基因的相对表达水平较处理0 h有所降低;低温处理8 h,AgICE1基因的相对表达水平与处理0 h相比无明显变化;低温处理2和24 h,AgICE1基因的相对表达水平均显著增加,分别为处理0 h的3.17和4.53倍。

不同的小写字母表示在0.05水平上差异显著Different lowercases indicate the significant difference at 0.05 level.

不同的小写字母表示在0.05水平上差异显著Different lowercases indicate the significant difference at 0.05 level.A: 高温(38 ℃)High temperature (38 ℃); B: 低温(4 ℃)Low temperature (4 ℃); C: 干旱(质量体积分数20% PEG6000)Drought (mass volume fraction of 20% PEG6000); D: 高盐(0.2 mol·L-1 NaCl)High salt (0.2 mol·L-1 NaCl).
干旱处理1 h,AgICE1基因的相对表达水平较处理0 h显著升高,为处理0 h的4.29倍;干旱处理2和8 h,AgICE1基因的相对表达水平均较处理0 h有所升高,分别为处理0 h的1.24和2.02倍;干旱处理4 h,AgICE1基因的相对表达水平最高,为处理0 h的9.03倍;干旱处理24 h,AgICE1基因的相对表达水平较处理0 h略有降低。
高盐处理1~24 h,AgICE1基因的相对表达水平均较处理0 h有不同程度的升高,分别为处理0 h的3.30、1.55、2.30、2.54和2.95倍,其中,高盐处理1 hAgICE1基因的相对表达水平最高。
3 讨论和结论
低温胁迫是植物生长发育过程中常见的一种非生物胁迫,不仅会导致作物产量降低,严重时还会导致植株死亡[20]。芹菜作为重要的叶菜类蔬菜作物,在其栽培过程中经常受到因气候变化及不良土壤环境引起的非生物胁迫,严重影响芹菜的正常生长发育。本研究从芹菜品种‘津南实芹’中克隆获得AgICE1基因。该基因的开放阅读框编码484个氨基酸,其氨基酸序列的第300位至第346位氨基酸间包含bHLH保守域。与其他植物ICE1转录因子的氨基酸序列的多重比对结果表明:ICE1转录因子在进化上具有保守性。通过系统进化树的分析可发现,ICE1转录因子在同科植物间的亲缘关系更近。RT-qPCR结果显示:芹菜品种‘津南实芹’AgICE1基因在根、叶柄和叶片中均可表达但是相对表达水平差异较大,其在叶片中的相对表达水平显著高于根和叶柄,说明该基因的表达存在明显的组织特异性。高温(38 ℃)、低温(4 ℃)、干旱(质量体积分数20% PEG6000)和高盐(0.2 mol·L-1NaCl)4种非生物胁迫处理下芹菜品种‘津南实芹’AgICE1基因的相对表达水平总体上有不同程度的升高,说明AgICE1转录因子与非生物胁迫调控相关。
已有研究结果表明:植物中许多基因家族的转录因子与植物的抗逆性有关,这些转录因子通过特异性识别并结合下游基因启动子中的顺式作用元件来调控植物的抗逆应答,如CBF/DREB是一类可以调控多个与干旱、高盐及低温胁迫相关的功能基因表达的转录因子家族,在植物抵抗非生物胁迫中起重要作用[21-22]。ICE1转录因子可以与CBF3基因上游启动子结合从而激活CBF3基因的表达。黄莹等[12]认为,缺失ICE1基因的拟南芥会引起CBF3基因表达变化,使植物丧失抗寒能力;但在高温条件下,拟南芥中CBF3基因未被激活,由此推测ICE1转录因子与CBF3基因上游启动子的结合存在低温诱导型的修饰调控。也有研究发现,与对照组相比,过量表达CBF3基因的转基因拟南芥不仅抗寒性增强,而且对干旱和高盐胁迫也具有一定的抗性[23]。目前对ICE转录因子激活CBF类转录因子家族的研究多集中于其在抗低温胁迫中的重要作用,而对其他非生物胁迫响应的研究报道较少,因此,关于ICE1基因在非生物胁迫中具体的作用机制还有待进一步的深入研究[24]。
高等植物抵抗非生物胁迫的生理生化过程非常复杂,有研究认为,植物的耐受性与其体内的抗氧化酶活性相关[25]。当植物受到逆境胁迫时,体内会产生过量的活性氧毒害细胞,植物本身可以通过产生抗氧化酶来清除这些有害物质,从而增强其抗逆能力[26-27]。已有的抗逆性相关研究结果[28]表明:植物在抵抗逆境过程中有着复杂的分子调控网络。本文研究了芹菜品种‘津南实芹’AgICE1基因对非生物胁迫的响应,对了解AgICE1基因在芹菜抗逆境胁迫中发挥的作用提供了参考,但对芹菜的抗逆性研究还需从分子及生理生化等方面进行深入探讨。
