特殊生境微生物培养技术研究进展
2019-03-23,,
, ,
(济南大学生物科学与技术学院, 山东济南250022)
据生物多样性研究统计,地球上的微生物总数远大于动植物总数之和,达300万种,但是已被研究发现的还不到1/10。此外,在已发现的微生物中,只有不到1%的种类被利用[1],这些尚未开发的微生物资源有待于进一步挖掘,尤其是特殊生境微生物资源亟待开发。 特殊生境是指那些在结构与功能上具有明显的特殊性或异质性的生态环境, 其生态元的数量或品质具有明显差异[2]。 分布在极地冰川、火山口、海洋、盐碱地等生境的微生物统称为特殊生境微生物。特殊生境的微生物具有在高温、高寒、高压、高盐碱等极端环境中生存的优势,其抗逆基因及其代谢产物具有重要的研究价值[3]。特殊生境微生物的分离筛选是天然活性物质筛选的前提。
特殊生境微生物的分离要充分考虑自然环境中的各种影响因素,如温度、pH、群落关系等,培养方法和技术的研发至关重要。本文中从培养基、培养条件、新培养技术等方面综述目前特殊生境微生物分离培养技术的研究进展。
1 制约特殊生境微生物培养的因素
微生物在实验室中培养时,因环境的改变,无法立即适应而进入一种只维持代谢活动、不生长繁殖的休眠状态,称为“活的非可培养状态”[4]。影响微生物培养的原因复杂多样,非生物因素、生物因素及两者之间的互相作用等均会影响微生物在人工环境中的生长。生长时间、温度、pH、氧浓度、压力、氧化还原电位和盐浓度等是直接影响微生物生长和新陈代谢的重要理化因素,这些条件能决定每个物种的特征和生长速度。在某些情况下,环境的改变也会影响微生物的生长,如从深海中分离到的耐压菌无法在常压下存活,微好氧菌仅在低氧分压下生长繁殖,因此,微生物分离技术应考虑设计合适的物理、化学和生物参数[5]。群体感应( quorum sensing,QS)也是制约特殊生境微生物难培养的关键因素。QS是细菌自发产生的一种群体行为,细菌释放一些特定的信号分子,通过感知其浓度变化,调控微生物的生物行为[6]。环磷酸腺苷( cAMP)、酰化高丝氨酸内酯类( AHLs)等是目前发现的QS信号分子[7-8]。除了生物因素和非生物因素之外,影响特殊生境微生物生长的因素还包括特殊生境的难复原性,如海洋热液喷口、火山喷口、极地寒冷环境等特殊生境微生物生长条件极其复杂,因此无法人工模拟。总之,微生物不可培养的原因主要有以下2个方面:一是某些自然环境很难模拟,因此不可能人为地完全复制其真实生长环境;二是目前研究能力有限,对微生物生长条件、规律及其生存环境的复杂性认识还不够充分[9]。
2 经典培养方法优化
2.1 设计合适的培养基
合适的培养基是微生物分离培养的先决条件,设计满足不同生境微生物生长的培养基对微生物工作者来说任务非常艰巨。改变培养基成分是提高微生物的可培养性的常用策略。目前,实验室常用培养基为富营养培养基,但是特殊环境微生物大多在低营养环境中生存。尤其是专性寡营养微生物的生存环境中有机碳质量浓度仅为mg/L水平[9],将这类嗜寡营养微生物转移到营养充沛的人工培养基时,高浓度营养物质反而会抑制它们的生长[10],因此,研究者在分离寡营养环境中的微生物时,大多采用稀释传统培养基的方法,如Janssen等[11]分离土壤样品时采用稀释培养基、延长培养时间、超声波处理样品相结合的方法,成功获得多个门类的新微生物。低浓度营养成分的培养基虽然能使微生物生长,但是营养成分过少无法满足微生物的生长需求,会阻碍微生物的生长[12-13],因此,增加营养成分种类能大幅提高微生物分离培养的出菌率。近几年,一种被称为土壤提取物琼脂培养基的新型培养基用于分离培养土壤中的微生物,获得了一些新的细菌和放线菌[14]。
在研究微生物的新陈代谢时,微生物学家发现培养基中不同的电子供体、电子受体和碳源对很多微生物有影响。Santini等[15]从金矿中分离出一种未知的化能自养型亚砷酸盐氧化细菌,命名为NT -26,该菌株以氧为受体,亚砷酸盐为电子供体,其16S核糖体DNA(rDNA)基因序列比对结果显示,NT - 26为α - 变形菌门的根瘤农杆菌分支中的一个新种。Schink等[16]从海洋沉积物中筛选到一种新的无机化能自养细菌,即亚磷酸氧化产脱硫菌,该菌株以亚磷酸为电子供体,以硫酸盐为电子受体。Uphoff等[17]在研究北海水样微生物多样性过程中发现,碳源质量是微生物生长繁殖的决定因素,与仅含有一种碳源的培养基相比,含有多种复杂化合物碳源培养基能获得多种菌株。许多自养微生物无法在一个固定碳源的培养基上生长[18]。Rettedal等[19]对人类肠道微生物种群进行研究,采用优化选择培养条件的方法,在培养基中添加不同碳源、微量元素混合物、抗生素等,分离出4种典型菌株,其中2种为新菌种。Kawanishi等[20]设计开发了2个限制条件的高度选择性培养基,应用该选择培养基,分离出水稻谷枯病原菌、青枯病原菌等。
琼脂对某些微生物的生长有抑制作用,选用琼脂替代物培养特殊生境微生物能提高其可培养性。微生物学家发现,吉兰糖胶能有效分离培养淡水沉积物中迄今未发现的微生物。Tamaki等[21]的研究表明,吉兰糖胶培养基上的菌落数比琼脂培养基上的多10倍,约60%为新种;在相同条件下,吉兰糖胶培养基上分离出的新菌种仅有约1/2能在琼脂培养基上形成菌落。
2.2 摸索合适的生长条件
特殊生境微生物的生长条件极其严格,限制其生长的因素主要包括生长时间、接种量、温度、pH和空气条件。
2.2.1 生长时间
由于微生物的生长周期存在差异,因此分离生长慢的微生物时,可采用增加培养时间的方法。延长培养时间能够增加环境中非优势微生物的分离成功率。倍增时间为48 h的慢增长微生物从单一细胞长成一个肉眼可见的菌落需要30 d左右[22]。Janssen等[11]采用延长培养时间的方法从土壤中分离得到多种酸杆菌门和疣微菌门的新种,但是,微生物培养周期不能无限增加,原因是延长微生物培养时间易导致污染,对培养环境的无菌要求会越高[23]。
2.2.2 接种量
减少接种量能促使活菌数增加,但并不影响微生物菌落的形成[24]。Davis等[24]研究发现,接种量每减少1/10,最终活菌计数增加2倍,活菌计数的精确度随着每个板上菌落数的减少而降低,并且随着接种量的减少,活菌数量会增加。
2.2.3 温度
低温会降低微生物的代谢率,同时生长抑制物质的生产率也会下降,会诱导出更多菌株,如土壤细菌在20~25 ℃时的生长效果比30 ℃时的好[25]。特别是来源于寒冷地区的样品,培养温度应与其环境条件接近。例如,在古老的多年冻土沉积物中,采用低温恢复策略成功分离出多种微生物。延长低温培养时间可使一些以前不可培养的菌类获得分离,如蛋白菌、高G - C含量(鸟嘌呤和胞嘧啶在DNA的4种碱基中所占的分数)革兰氏阳性菌和低G - C革兰氏阳性菌[26]。
2.2.4 pH
pH是影响微生物生长的关键因素,可以根据实际采样pH进行调整[25]。最常用的营养培养基pH接近中性。泥碳中的大部分细菌在pH为3.5~5.5的酸性泥碳水培养基上生长,而在传统培养基上不生长,因此一些泥碳甲烷氧化菌用温和酸性培养基分离出来[27]。土样中的酸杆菌用中等酸性条件分离出来[28]。
2.2.5 空气条件
不同来源的微生物对空气条件需求各异。根据微生物对氧气的需求程度,将其分为好氧、微好氧、厌氧、兼性厌氧型等。Janssen等[29]利用稀释培养技术分离水稻缺氧土样中的糖分解菌,分离出3株疣微菌目的兼性厌氧超微细菌;模拟自然条件,通过多因素实验发现产甲烷菌在自然有氧条件下仍能产生甲烷,在有氧条件分离了2株能产甲烷的细菌[30]。
2.3 群体培养与共培养
Kaeberlein等[31]发现,环境中的大部分微生物会抵触实验室培养,一些分离的菌株能在模拟的自然环境中生长,在人工培养基上无法独自生存,有其他微生物存在时便能形成肉眼可见的菌落,这说明微生物种间与种内需要信号分子进行交流。信号分子cAMP和AHLs被添加到培养基中来满足微生物生长繁殖的需求。与AHLs相比,cAMP能使更多细菌得到培养[8],但是仅添加某些化合物很难将有些微生物分离出来,可通过群体培养或共培养的方法进行分离。如Plugge等[32]采用透析培养系统富集生长缓慢的中度嗜热厌氧菌,以谷氨酸盐为唯一碳源和能源的谷氨酸降解菌在1 a内细胞数量增加了400倍,并且发现了一株能降解谷氨酸的新产甲烷菌Z,菌株Z的存在促进了谷氨酸降解菌的生长。Kaeberlein等[31]发现,从扩散盒中分离的很多细菌只能与同一环境中的其他细菌共存。Egan等[33]发现,短双歧杆菌UCC2003仅在双歧杆菌PRL2010存在时才能利用黏蛋白。Dubey等[34]用金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌研究细菌间通讯时,发现细胞荧光物质能在相邻细胞之间转移,原因是相邻细胞间有不同大小的纳米管存在。纳米管是自然界中细菌间通讯的主要形式,为物种之间的分子交换提供了一个网络。
2.4 高通量培养技术
特殊生境中的寡营养微生物在人工培养时,其中的优势微生物会抑制寡营养微生物的生长。为了解决这一问题,Button等[35]提出稀释培养法,即通过极限稀释减少优势微生物对寡营养微生物的影响,提高寡营养微生物的可培养性。Hahnke等[36]将藻华水样稀释后,用含有微摩尔底物养分的人造海水培养基分离出极易引起藻华的浮游细菌。Connon等[37]基于稀释培养法提出高通量培养法,使用微量滴定板和新开发的制备细胞阵列的方法来提高高通量速率和检测灵敏度,用该方法培养了海洋中数量多达14%的细菌。高通量培养技术分离出的菌株数量比传统微生物培养技术分离出的菌株数量增加了14~1 400倍。Colin等[38]利用高通量培养方法对河口底泥样品进行分析,从384孔微孔板中成功获得了许多硫酸盐还原菌的纯培养。Rappé等[39]利用高通量培养法,设计难培养海洋细菌SAR11的同源分子探针,获得了18种细菌的纯培养物。高通量培养技术能同时操作多个单元,大幅提高了微生物的分离效率,显著增大了分离出新菌种的可能性。
2.5 原位培养技术
在实验室中难以完全复制微生物的自然环境,使得微生物在生长过程中某些营养物质匮乏和与其他生物的联系被破坏,导致微生物难以在人工培养基上生长。Bruyn等[40]利用悬浮滤膜技术分离出中等嗜热细菌、嗜热嗜酸生物体氧化硫杆菌, 有效地增强了铁氧化菌的可培养性。Kaeberlein等[31]设计了扩散盒装置来分离海洋微生物,成功分离出一株新菌株,图1所示为原位培养扩散生长盒,由1个环状不锈钢垫圈和2个孔直径为0.03 μm的滤膜组成,滤膜允许环境中的营养物质自由出入,但是细胞不能通过,比较真实地模拟了微生物所处的自然环境,有效地保证了微生物生长所需的营养物质及其信号分子交流。扩散盒进一步改进为原位培养陷阱捕集器,由2个半透膜(孔径为0.2~0.6 μm的底膜和孔直径为0.03 μm的顶膜)组成。将捕集器粘合到具有无菌琼脂或结冷胶的塑料洗涤器内,底膜限制真菌的渗透,使用时直接将原位培养陷阱的生长盒置于自然环境中,以保证底部半透膜与土样紧密接触,半透膜允许环境样品中放线菌和丝状真菌的菌丝体进入到生长盒中,将细菌和单细胞真菌阻挡在盒外[41]。该装置比常规平板培养分离到的放线菌更丰富多样。Ferrari等[42]基于扩散盒的技术原理,开发了一种用于筛选土壤中难培养微生物的土壤基质滤膜系统,该系统使用聚碳酸酯膜和土壤提取物的固体琼脂作为生长底物,使用全细菌染色结合荧光原位杂交显示不同的菌落,从土壤中分离得到难培养的TM7类细菌。姜明国等[43]将自制的原位培养装置埋于红树林根际附近土壤中俘获放线菌,共分离到113株放线菌。原位培养技术最大程度地还原了微生物生长的自然环境,保证了微生物间的相互作用,提高了微生物可培养性。

(a)由环状不锈钢垫圈和孔径为0.03 μm的滤膜组成的扩散盒表面的扩散盒 (b)置于海洋沉积物 图1[31] 原位培养扩散生长盒
2.6 细胞微囊包埋技术
Zengler等[44]利用细胞微囊法, 在将凝胶微滴中的细胞封装在低营养流量条件下进行大规模平行培养, 然后利用流式细胞仪检测含有菌落的微滴, 流程如图2所示。 该方法广泛应用于分离海水、土壤等环境样品中的微生物[45]。 Bendov等[46]研究出一种双层包埋技术,依次用琼脂、聚砜聚合物膜将微生物包被,置于自然环境中培养, 分离到多种新的微生物菌种,其16S rDNA序列分析显示,相似性仅为
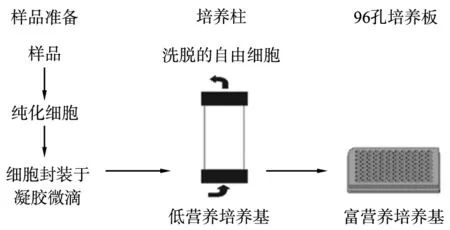
图2[44] 细胞微囊包埋法流程图
85% ~96%。Jiang等[47]在微囊包埋技术的基础上开发了一种高通量微生物细胞分离培养的微流控条纹板法,用于研究北京郊区一个废弃焦化厂土壤微生物的多样性, 并从该多环芳烃富集的土壤中分离出4种分支杆菌和1种降解荧蒽的未知芽球菌属。随着信息技术的发展,由数百个微型扩散室构成的高通量的微生物分离芯片应运而生。利用该芯片分离到大量微生物,约1/2为微生物新种[48]。Jung等[49]在研究俄罗斯贝加尔湖淡水海绵微生物的多样性时开发了I - tip技术,将微生物分离芯片与原位培养完美地结合,培养出更具多样性的微生物。
3 分子生物学方法在发掘特殊生境微生物中的应用
随着环境微生物基因组提取方法的不断改良, 分子生物学飞速发展, 并广泛应用于特殊生境微生物研究。 例如, 基于微生物基因组中特定基因、 序列引导分离技术通过设计引物或杂交探针, 以培养物中靶向序列的变化为标准, 优化微生物培养条件, 培养出新的微生物。 Liebner等[50]通过荧光原位杂交发现永久冻土中的优势菌群为拟杆菌和放线菌。 近几年发展起来的宏基因组学直接从自然环境中的样品提取全部微生物的基因组, 进而分析微生物的多样性、 进化关系等。 Albertsen等[51]利用宏基因组学技术, 分析活性污泥生物反应器中的样品, 组装出包括稀有物种的31株细菌的基因组, 其中12株细菌已拼出全基因组, 4株属于候选细菌门TM7, 代表迄今为止这个门最完整的基因组(相对丰度为0.06%~1.58%)。 此外, 单细胞基因组测序技术应运而生, 该新技术在单细胞水平对全基因组进行扩增与测序, 在获得特殊生境中难以培养微生物的遗传信息方面发挥了巨大作用, 应用前景广阔[52]。
4 结论与展望
近年来,新颖的培养方法与技术相继问世,广泛应用于微生物新菌种的发现。利用三维(3D)打印技术加工的微流控芯片与细胞尺寸相匹配,具有分析速度快,分离效率高,试剂样品消耗量小,可操作性强等优点,被广泛应用于微生物单细胞分离分析,如用微流控芯片技术鉴定多重细菌[53],检测出霍乱弧菌、沙门菌、志贺氏菌等食源性致病菌[54]。微生物研究者通过不懈努力,采用多种多样的微生物分离方法(见表1),从特殊生境中发现了许多新菌种,如崔庆锋等[55]从酸性土壤中筛选嗜酸放线菌,得到20株稀有放线菌代表菌株,其中2株属于至今尚未命名的新科Ellin5034 group。

表1 特殊生境微生物培养方法
微生物分离培养是特殊生境微生物资源开发的前提,快速、有效分离微生物的方法体系是不可或缺的。由于理化因素直接影响微生物的生长繁殖,QS能控制微生物的群体行为,因此,特殊生境微生物的分离要充分考虑这些生物因素与非生物因素的影响,尽量模拟微生物自然生存环境,并采用多种行之有效的技术方法,与其他学科技术相结合,取长补短,才能从特殊生境中分离更多的微生物,为新颖结构生物活性物质的发现、促进微生物生化药学的发展奠定坚实的基础。
