防逆流纳米Ag-CHA-SiO2抗菌型导尿管体外生物安全性研究
2019-03-21裴泽军
孙 欣,赵 吟,裴泽军
(无锡市第二人民医院,江苏无锡 214002)
0 引言
导尿管是目前临床使用非常广泛的一种医用人体植入物,其在住院患者中的使用率约25%。而导尿管相关性尿路感染(catheter-associated urinary tract infections,CAUTI)随之成为临床治疗过程中常见的一个棘手问题。根据Johnson等[1]的统计,美国CAUTI患者占医院获得性感染的40%,位居医院获得性感染的第二位,仅次于呼吸系统感染;美国每年CAUTI患者超过100万例,占医院获得性尿路感染的80%。在我国,CAUTI患者占医院获得性感染的37.3%~56.0%,其中2%~4%的患者诱发为菌血症和(或)败血症,其病死率高达13%~30%[2]。因此,CAUTI不仅给患者带来巨大的痛苦,还给患者的生命与健康带来潜在的威胁,此外,也无形中对卫生资源产生很大的消耗。为此,课题组创新性设计研发了防逆流纳米Ag-CHA-SiO2(银离子-醋酸氯己定-二氧化硅)抗菌型导尿管(以下简称“抗菌型导尿管”),以杜绝CAUTI的发生,切实保障患者安全。现对其体外抑菌能力与细胞毒性进行研究,以评价其体外生物安全性,为后期产品的转化与开发做好准备。
1 仪器与材料
1.1 试验材料
1.1.1 材料与试剂
新西兰雄兔[浙江省医学科学院实验动物中心,动物生产许可证号SCXK(浙)2013-0055],大肠杆菌(ATCC11229),金黄色葡萄球菌(ATCC6538),DMEM/F12培养液(Gibco,批号8117196),胎牛血清(fetalbovine serum,FBS;四季青 11011-8611),普通 F8 医用导尿管(以下简称“普通导尿管”,广州维力医疗器械股份有限公司,5.3mm(16FR)15ml,批号 20160601),醋酸氯己定(Aladdin,批号F1606020),硝酸银(国药集团化学试剂有限公司,批号20160704),纳米二氧化硅(先丰纳米,XF105,批号100365),四甲基偶氮唑盐(MTT)试剂盒(KeyGE-NBio-TECH Cat.NO:KGA312,批号 20170303)。
1.1.2 试验仪器
酶标仪:厂商Molecular Devices,型号SpectraMax M4;恒温CO2培养箱:厂商Thermo,型号HEPA CLASS100;显微镜:厂商 OLYMPUS,型号 CKX41。
1.2 兔尿道上皮细胞的制备
新西兰雄兔行全麻术,以膀胱组织活检钳夹取尿道球部腹侧壁黏膜组织剪取0.4 cm×0.3 cm,迅速置入预先装有青霉素+链霉素的D-hank's液,黏膜组织漂洗 2~3 遍,浸入 DispaseⅡ液(2.4 U/ml),静置 30 min予以消化。分离提取上皮层并充分剪碎,以胰酶消化,振荡15~20 min,加适量的D-hank's液,离心5 min(1 000 r/min),移除离心液,加D-hank's液吹打使其为单细胞悬液,用200目筛网一次性过滤,接种入T25培养瓶,加入DMEM/F12培养液,排除混杂细胞(采用差速贴壁法)。然后置于5%CO2培养箱37℃恒温培养,2 d换液1次,当细胞增殖至70%~80%融合时以1∶3传代培养。
1.3 样品浸提液的制备
将普通导尿管、抗菌型导尿管分别进行紫外线照射灭菌,分别随机截取2 cm,以6 cm2/ml的比例加入浸提液,于5%CO2培养箱37℃条件下浸提24 h,浸提介质为含10%FBS的DMEM/F12培养液,浸提后原液经一次性过滤器过滤除菌后,用于细胞毒性实验。
2 实验方法
2.1MTT法
依据GB/T 16886.5—2017《医疗器械生物学评价第5部分:体外细胞毒性试验》进行细胞形态观察与MTT 试验[3]。
2.1.1 细胞形态观察
取处于对数生长期的兔子尿道上皮细胞,用胰蛋白酶进行消化,制成105个/ml的细胞悬液,用96孔型培养板接种,细胞贴壁后换液,用含10%FBS的DMEM/F12培养液(阴性对照组)及抗菌型导尿管浸提液(样品组)、普通导尿管浸提液培养细胞(样品组),于72 h后显微镜倒置观察,拍取照片。根据细胞形态进行毒性评判[4-5]:
(1)无毒:细胞形态正常,贴壁生长好,细胞呈铺路石状。
(2)轻度毒性:细胞贴壁生长好,但可见少数细胞圆缩,偶见悬浮细胞。
(3)中度毒性:细胞贴壁生长不佳,细胞圆缩较多,达1/3以上,见悬浮死细胞。
(4)重度毒性:细胞基本不贴壁,90%以上为悬浮死细胞。
2.1.2 MTT试验
MTT试验[3]分组:以10%FBS的 DMEM/F12培养液为阴性对照组,以抗菌型导尿管浸提液、普通导尿管浸提液作为样品组,每组各平行测试3份。根据其试剂盒操作步骤加入MTT,4 h后加入二甲基亚砜(DMSO),取酶标仪测定OD值(490 nm处)并计算细胞相对增殖率(relative growth rate,RGR)(RGR=样品组OD值/阴性对照组OD值×100%)。根据RGB对细胞毒性进行分级[4-5]:99%≤RGR≤100%,细胞毒性为0级;75%≤RGR<99%,细胞毒性为1级;50%≤RGR<75%,细胞毒性为2级;25%≤RGR<50%,细胞毒性为3级;1%≤RGR<25%,细胞毒性为4级;0≤RGR<1%,细胞毒性为5级。0级和1级为无毒性,2级为轻度毒性或结合细胞形态综合评价,3级和4级为中度毒性,5级为重度毒性;3~5级为不合格材料。
2.2 抑菌环试验
根据WS/T 367—2012《医疗机构消毒技术规范》中的抑菌环操作规范[6],以10%FBS的DMEM/F12培养液为阴性对照,对抗菌型导尿管、普通导尿管进行抑菌环试验,每组均平行试验3份。
2.2.1 菌种的活化
将金黄色葡萄球菌、大肠杆菌菌种(4℃保存)接种至新鲜营养琼脂的斜面,置5%CO2培养箱18~24 h,使菌种活化[7]。
2.2.2 菌悬液制备
取典型的单菌落接种于盛有LB培养基的三角瓶中,200 r/min过夜培养;1∶100稀释至新的LB培养基中,200 r/min培养3~4 h使细菌达到对数生长期。调整细菌浓度至 OD600=0.2±0.02(约 108 cfu/min),完成菌悬液制备[8]。
2.2.3 抑菌板制备
加热融化培养基并分装试管,每根试管20 ml。用橡皮塞封口,进行121℃高压蒸汽灭菌20 min,稍冷却,置于恒温水浴锅50℃保温。在超净工作台上制备抑菌板[7],每个培养皿倒入20 ml培养基,将培养皿底部全部覆盖,吹干冷凝水。凝固后,用灭菌打孔器在制备好的平板上垂直打出3个孔,每孔直径约6 mm,3个孔分布均匀,各孔间隔25 mm,孔洞与培养皿壁之间间隔15 mm,并用灭菌牙签将琼脂块挑出。
2.2.4 菌液涂布
使用经灭菌处理的药棉取100 μl制备好的细菌菌液均匀涂布在LB琼脂培养基上[7],在超净台中自然条件下干燥。
2.2.5 材料选取及测量
随机截取长1 cm的抗菌型导尿管、普通导尿管插入培养基中,各样品均平行测试3份。将培养皿放入37℃恒温培养箱中培养24 h,卡尺量取各样品的抑菌圈直径。
2.2.6 抗菌性能评判
(1)阴性对照应无抑菌环;(2)抑菌环直径≥7 mm时(即最外端向外延伸1 mm以上)即判定具有抑菌、抗菌作用;(3)对大肠杆菌和金黄色葡萄球菌均具有抗菌、抑菌作用,即认定该材料具有抗菌、抑菌性能[7]。
3 结果
3.1 细胞形态观察
倒置显微镜滤光片显色观察发现,样品组及阴性对照组72 h时后细胞均明显增多,细胞呈正常的多变长卵形铺路石状,排列规则密集,未见悬浮死细胞。普通导尿管浸提液及阴性对照组未见圆缩细胞,抗菌型导尿管浸提液偶见圆形细胞,如图1~3所示。

图1 抗菌型导尿管浸提液细胞形态图(100×)

图2 普通导尿管浸提液细胞形态图(100×)

图3 阴性对照组细胞形态图(100×)
3.2 MTT检测结果
根据实验检测的OD值计算抗菌型导尿管浸提液、普通导尿管浸提液RGR分别为92.0%、99.5%。结合细胞形态观察结果,抗菌型导尿管浸提液、普通导尿管浸提液MTT试验分级分别为1级、0级,具体见表1。
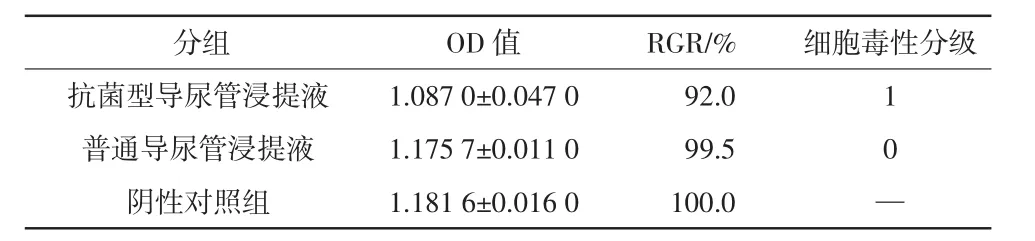
表1 MTT法检测兔尿道上皮细胞OD值、RGR和细胞毒性分级(n=3)
3.3 抑菌环试验结果
抗菌型导尿管对大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别为(11.24±0.54)、(7.63±0.34)mm,均>7 mm,有抑菌、抗菌作用;普通导尿管对大肠杆菌和金黄色葡萄球菌的抑菌圈直径均为(6.00±0.00)mm,均<7 mm,无抑菌作用。2种导尿管对大肠杆菌和金黄色葡萄球菌的抑菌效果对比如图4、5所示。

图4 2种导尿管对大肠杆菌的抑菌效果对比图

图5 2种导尿管对金黄色葡萄球菌的抑菌效果对比图
4 讨论
细胞毒性试验是目前一致认可的有效评价材料生物相容性的方法[9]。其中MTT法因其灵敏、客观、重现性好而成为金标准[10]。根据实验结果观察比较图1~3细胞生长形态可知,样品组与阴性对照组比较,细胞形态均生长正常,仅抗菌型导尿管浸提液细胞紧密度略低,并偶见圆形细胞。细胞生长形态与MTT检测结果表明,抗菌型导尿管浸提液为1级、普通导尿管浸提液为0级,均判定为无毒性材料。
抑菌环试验结果显示,普通导尿管对大肠杆菌与金黄色葡萄球菌的抑菌圈直径均为(6.00±0.00)mm,<7 mm,无抑菌作用。抗菌型导尿管对大肠杆菌的抑菌圈直径达(11.24±0.54)mm,对金黄色葡萄球菌的抑菌圈直径为(7.63±0.34)mm,均>7 mm,具有抑菌作用。由试验结果可知,抗菌型导尿管对大肠杆菌的抑菌效果显著,但对金黄色葡萄球菌的抑菌效果不够理想。鉴于CAUTI通常以革兰氏阴性菌感染为主[11],因此当前抗菌型导尿管能对大部分的CAUTI起到良好的预防作用,但其仍存在不足,后期应该在如何提高对金黄色葡萄球菌的抑菌效果上加以改进。考虑到Ag-CHA-SiO2中CHA具有良好的广谱抗菌作用,后期将着重于研究CHA的含量调整与释放度,以使抗菌型导尿管能对包括金黄色葡萄球菌在内的各种微生物起到良好的抑菌作用,达到广谱抗菌效果。
此外,抗菌型导尿管创新性地从引起CAUTI的内、外2种途径进行了全面防范[12],对内部利用单向阀杜绝导尿管内部逆流污染引起的感染,对外部则通过纳米Ag-CHA的复合体进行联合抗菌,有效地提高了抗菌效果。同时纳米Ag-CHA具有抗菌谱广、不易产生细菌耐药性等特点,适于长期使用,安全可靠。
综上所述,抗菌型导尿管无细胞毒性,属无毒范畴,为合格生物材料。其生物安全性能符合要求,抑菌性能良好,作用全面,值得进行转化推广,尤其对部队野外操作更有优势[13]。后续应进一步深入开展体内有效性的研究,同时进一步进行有效作用时间延长的研究,使其临床应用效果更好,真正造福患者。
