代谢组学及其分析技术在医学研究中的应用进展
2019-03-19王霄霄王海霞左徳筠黄国庆
王霄霄 王海霞 左徳筠 黄国庆


[摘要] 代谢组学是一种通过定量描述代谢物的动态变化来解读被研究对象病理生理状态的新兴学科,主要分析方法为质谱技术(MS)和核磁共振技术(NMR)。本文通过文献检索,对代谢组学研究及其常用技术的优势及局限性以及其在医学研究中的实验设计、技术操作、统计方法等进行综述,对代谢组学在医学研究中的应用所遇到的挑战和未来的探索方向进行讨论。
[关键词] 代谢组学;医学;质谱;核磁共振;进展
[中图分类号] R441 [文献标识码] A [文章编号] 1673-9701(2019)01-0165-04
Progress in the application of metabolomics and its analytical techniques in medical research
WANG Xiaoxiao WANG Haixia ZUO Dejun HUANG Guoqing
Department of Cardiology, Zhongshan Hospital Affiliated to Dalian University, Dalian 116001, China
[Abstract] Metabolomics is an emerging discipline for interpreting the pathophysiological state of the subjects by quantitatively describing the dynamic changes of metabolites. The main analytical methods are mass spectrometry(MS) and nuclear magnetic resonance(NMR). This paper reviews the advantages and limitations of metabolomics research and its commonly used techniques, as well as its experimental design, technical operation, and statistical methods in medical research through literature search. The challenges and future directions of exploration in the application of metabolomics were discussed.
[Key words] Metabolomics; Medicine; Mass spectrometry; Nuclear magnetic resonance; Progress
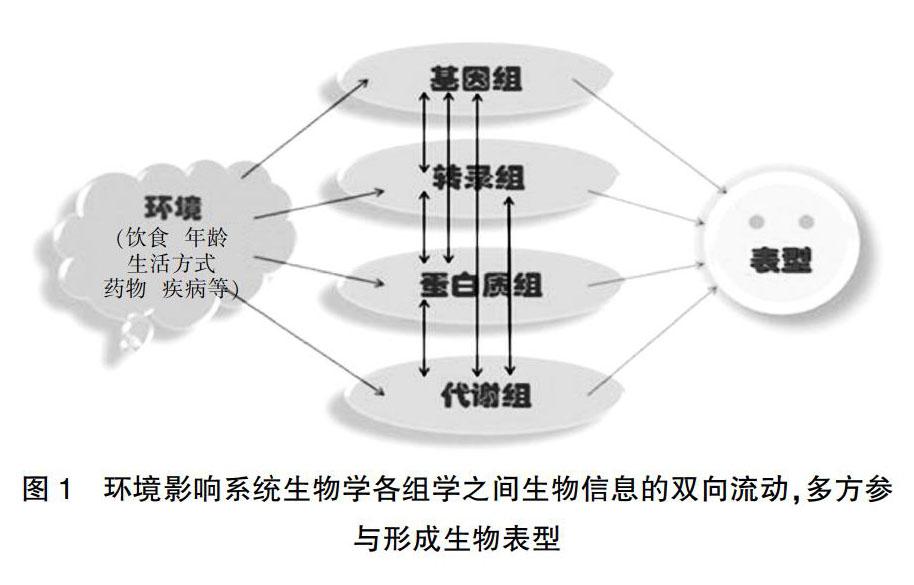
代谢组学(metabolomics)研究起始于20世纪70年代至90年代,Oliver和Ferenci的研究小组分别于1997年和1998年对其进行了首次定义[1]。在早期发展中出现了两种英文形式:metabolomics和metabonomics,如今认为两者是同义词并可互换使用[2,3]。现在认为,代谢组学是一种通过定量描述生物体内多种代谢物的动态变化来解读被研究对象病理生理状态的新兴学科。其出现于基因组学、转录组学和蛋白质组学之后,是系统生物学的重要构成部分[1,4]。在系统生物学中,基于蛋白质组学和转录组学进行的基因组研究更突出调控层面,在探索受环境动态变化影响的疾病代谢表型和表型紊乱方面,代谢组学为首选研究方法(图1)[5,6]。近十几年来代谢组学发展迅速(封三图5),在医学科学研究中逐渐显现出它的优势。人们希望通过分析找出与疾病密切相关的异常代谢途径和特征生物标志物,为进一步阐明疾病的发病机制提供依据。
1 代谢组学研究方法
从研究设计的原理上来说,代谢组学是一种相对简单的研究方法:根据已确定的代谢组学研究方法收集样本,使用技术手段获取代谢物,确定组间代谢物有无统计学差异并进行进一步分析[7](图2)。代谢组学研究方法有非靶向(Untargeted)代谢组学和靶向(Targeted)代谢组学两种。非靶向代谢组学分析全部代谢物情况,不对特定代谢物做预先假设,重复性和针对性较差,通常被称为假设生成或发现阶段实验。其特点是产生大量复杂多效的数据,因此需要高性能生物分析工具,通常用于发现以前未知的生理模式,为发现新的代谢产物和代谢途径提供方向,是相对开放的分析[8-10]。靶向代谢组学研究是以高精确度来验证先前的科学假设或可能的生物标志物并进行更有针对性的研究,重复性和选择性好,也被称为假设驱动实验。其用于确定新的生物标志物,研究代谢物的功能和途径,进一步揭示代谢物和疾病之间的关联,是相对封闭的分析。靶向代谢组学在应用上有两点局限:一是可能有代谢物未被检测到,从而减少了发现机会;二是使用该方法前,需要进行大量的非靶向研究资料收集[1,8-10]。
2 代谢组学主要技术
人類代谢组学包括成千上万已知和未知小分子代谢物,这些代谢物的极性、大小和浓度不同,范围从低分子量的亲水极性代谢物(如氨基酸)到高分子量的疏水非极性代谢物(如脂质)。这种多样性意味着代谢物的检测、识别和量化在技术上极具挑战性[11]。目前还没有一种分析方法能够检测或量化人体样本中所有的代谢物,人们尝试采用多种分析技术来进行代谢物的互补覆盖分析,其中核磁共振技术(Nuclear magnetic resonance,NMR)和质谱技术(Mass spectrometry,MS)是应用最广泛的方法[9, 12]。
2.1核磁共振(NMR)技术
NMR技术是一种利用不同原子核吸收辐射产生不同共振频率,将这些共振频率转化为分子化学和结构信息的光谱技术[13]。施加入磁场的靶向原子核不同,产生的代谢组学数据也不同。氢是最常见的靶向原子核(1H-NMR),其他原子如碳(13C-NMR)和磷(31P-NMR)等也可通过NMR技术得到特定代谢物类型的信息[14]。目前以1H-NMR光谱、2H-NMR光谱、高分辨率魔角旋转(HRMAS-NMR)光谱等常见。多年实践证明1H-NMR光谱分析结果中复杂的代谢谱导致信号重叠,使得低丰度代谢物被具有相似或相同化学位移的高丰度代谢物掩盖。这个问题可以通过应用2H-NMR或3H-NMR光谱加以改善和克服[9,15]。此外,高分辨率魔角旋转(HRMAS-NMR)光谱可用于完整组织的代谢谱分析,无需对样品进行任何预处理,已用于研究包括脑、肾、肝脏等组织在内的小型完整组织样品的代谢组学分析[12,16]。NMR光谱不需要色谱处理,样品制作简单并可重复多次使用,是一种快速、高效的非靶向分析技术方法,适合代谢物的定性和定量研究[7,9,15]。目前已被广泛应用于生物结构、生物学、生物化学等众多领域,是代谢组学主要的分析方法之一。但低灵敏度一直是NMR光谱分析的固有缺点,也是其在生物医学研究应用中的挑战。近年来,高磁场磁体、脉冲序列和冷冻探针技术[12]的技术进步使得NMR实验的灵敏度和分辨率得到了明显提高。
2.2质谱(MS)
MS分析是利用电场和磁场将运动的离子按质荷比(m/z)分离并进行检测的方法[10]。在科研实验中,未结合色谱的MS方法有直接输注质谱法(DI-MS)和流动注射质谱法(FI-MS)两种。DI-MS分析将样品直接引入质谱仪进行连续电离。FI-MS分析是把样品注入连续的有机相流中,以100~1000 mL/min的速率流入电喷雾界面,允许每小时注射50~100个样品[1,5]。此处需明确两个概念:一是基质效应:在MS方法中,样品中的其他化合物或外部来源的容器(如塑料、缓冲液、固定相等)的存在是一种“基质”,其降低了特定化合物被电离的能力[17]。二是离子抑制效应:由于存在另一种共洗脱离子而导致特定离子MS信号的改变[18]。在DI-MS和FI-MS的实际应用中,代谢物样本和基质的共洗脱增加了样品复杂性,使得分析的分辨率和灵敏度下降。为了解决这个问题,基于MS的代谢组学通常联合色谱进行色谱分离,减少基质效应和离子抑制效应[5,18]。目前MS联用色谱可分为液相色谱-质谱联用技术(liquid chromatography-MS,LC-MS)、气相色谱-质谱联用技术(gas chromatography-mass spectrometry,GC-MS)以及毛细管电泳-质谱联用技术(capillary electrophoresis-MS,CE-MS)三类。不同色谱分离方法的选择取决于分析物的性质(如分子量和亲水性/疏水性):LC-MS主要用于在溶液中不挥发的化合物,GC-MS主要用于挥发性及低沸点化合物。分离后的分析物在进入MS仪器前必须被电离,电离方法和MS检测器类型相关[10]。
LC-MS包含两种功能强大的分析工具:高效液相色谱(HPLC)和MS。LC-MS具有高灵敏度、高分辨率优势,能够检测到更多(200~500)的代谢物,可能是目前使用最广泛的质谱技术。在LC-MS中,几种类型的常压电离方法用于不同类别的代谢物的电离:最常用的电喷雾电离用于未知代谢物的初步筛选,大气压化学电离和大气压光电离适用于非极性代谢物的检测,并已被广泛应用于脂质组学研究[9,19]。GC-MS的优势包括高分离效率和良好的灵敏度。在使用GC-MS时应注意,数据采集之前需要进行样品衍生化来降低代谢物的极性,增加热稳定性和挥发性[1]。但GC-MS只能检测挥发性的或可被衍生化的挥发性化合物,有些不能被电离的代谢物无法检测到。现代MS仪器有离子阱、飞行时间、轨道阱和四极杆及傅里叶变换等类型。同NMR光谱相比,MS法的高灵敏度和高分辨率使检测大动态范围内数千种代谢物成为现实,让MS成为需要低丰度代谢物数据或同时分离大量代谢物的研究人员的首选方法[1,5,9]。
NMR和MS均具有明显的优势和劣势(表1),具有很强的互补性,这两种技术结合可以提高研究的总体质量。近几年来,研究者们开始联合应用NMR和MS进行样本代谢谱分析、药物功效及毒理、疾病病理生理学各方面的研究[20-22],并对NMR和MS分析平台的兼容性展开了探索[7]。
3 样本的采集和预处理
可用于代谢组学分析的样本有血液、尿液、脑脊液、唾液、活检组织提取物或细胞提取物(原代培养物)等。样本来源的选择取决于研究目标、样本可用性以及使用的分析平台。血液以及尿液是人类代谢组学研究中最常用的样本。在样品采集过程中,血液样本需要合适的含抗凝剂(锂肝素、EDTA和柠檬酸钾)的收集管,在分析前需要在4℃环境下分离血清或血浆、去除蛋白质等,这可能是血液代谢组学研究中预分析误差的主要来源之一[15]。目前普遍认为血液样品采集到细胞分离的最长间隔时间不超过35 min,因为延长等待时间可能会使血细胞中葡萄糖代谢持续,增加乳酸水平;此外,在实验中还应避免反复的冻融步骤[23]。与血液样本相比,尿液样本的生物组成相对简单,蛋白质含量较低,通常不需要额外的代谢物提取步骤(尿蛋白异常的病患标本除外),但尿液样本中的高尿素水平可能损伤分析仪器。传统的组织分析也需要大量的代谢物提取(如细胞壁的均质化和溶解以釋放代谢物),但受益于NMR技术的发展,现在人们可以利用HRMAS-NMR直接对组织样本进行分析而不需要预处理。
4 数据预处理与统计分析
在获取代谢组学数据进行统计分析之前,通常必须对数据进行预处理,主要包括信号校正和标准化两个方面[1,15]。信号校正用来减少数据集已知或未知偏倚的影响,如正交信号校正(OSC)。数据标准化包括数据缩放或转换、计算缺少值、检测并删除异常值等[1]。许多技术问题可能会引起代谢组学研究的系统性误差,这些主要涉及MS,而核磁共振的一个很大优势就是分析的相对稳健性和重复性。
在醫学代谢组学研究中,实验数据通常与年龄、性别、饮食、运动等多个变量相关,变量统计方法能够处理这些参数数据。根据变量可分为单变量分析和多变量分析。单变量分析方法包括t检验、Wilcoxon秩和检验以及方差分析(ANOVA)等方法。多变量分析方法分为无监督法和有监督法[7,24,25]两大类,无监督法通常用于识别整体趋势,不考虑研究样本的类型,包括广泛使用的主成分分析(PCA)、方差分析同步成分分析(ASCA)、层次聚类分析(HCA)等;有监督方法根据分析前表型对研究样本进行分类,人为加入分组变量,正确反映因变量与自变量之间的相关性,更适合构建风险预测模型[8],包括偏最小二乘法判别分析(PLS-DA)、偏最小二乘法(PLS)回归、正交偏最小二乘法(OPLS)、软独立建模分类法(SIMCA)等。目前医学代谢组学研究中的数据统计分析方法以主成分分析(PCA)和偏最小二乘判别分析(PLS-DA)使用最为广泛。
5总结
代谢组学作为系统生物学的重要部分已渗透到众多领域,广泛应用于包括药物研发、疾病诊断、营养学、个性化医疗和环境研究等与人类疾病密切相关的领域[1,7,9,26]。目前代谢组学在发展中显露出几个需要克服的方面:一是代谢产物化学鉴定:目前我们进行代谢物均是通过与真实的化学标准进行比较来鉴定的,但目前所有可能的代谢物都不能在市场上买到,或者购买成本很高;二是标准化:全世界估计有超过200个实验室[1]进行代谢组学研究,每个实验室对最佳的实验设计、分析实验和数据分析工具均有不同的观点。在可预见的未来,坚持标准化方法和工具的能力在代谢组学中被接受的可能性不大;三是集成数据集:系统生物学的成功将取决于来自不同来源的数据的整合和分析,包括高通量的组学数据和临床数据。分享和传播方法和结果的能力是至关重要的,适当的报告标准对于成功传播数据也是非常必要的,我们还需要重大的推动力来展开知识的传递与交流,加快合作。
[参考文献]
[1] Dunn WB,Broadhurst DI,Atherton HJ,et al. Systems level studies of mammalian metabolomes:the roles of mass spectrometry and nuclear magnetic resonance spectroscopy[J]. Chem Soc Rev,2011,40(1):387-426.
[2] Nicholson JK,Lindon JC. Systems biology:Metabonomics[J].Nature,2008,455(7216): 1054-1056.
[3] Dudley E,Yousef M,Wang Y,et al. Targeted metabolomics and mass spectrometry[J]. Adv Protein Chem Struct Biol,2010,80:45-83.
[4] 刘佳梅,刘佳,蔡军,等. 原发性高血压相关代谢组学的初步研究[J]. 中华高血压杂志,2016,24(4):340-347.
[5] Fuhrer T,Zamboni N. High-throughput discovery meta-bolomics[J]. Curr Opin Biotechnol, 2015,31:73-78.
[6] Jacob M,Lopata AL,Dasouki M,et al. Metabolomics toward personalized medicine[J]. Mass Spectrom Rev,2017.
[7] Marshall DD,Powers R. Beyond the paradigm:Combining mass spectrometry and nuclear magnetic resonance for metabolomics[J]. Prog Nucl Magn Reson Spectrosc,2017,100:1-16.
[8] Alonso A,Marsal S,Julia A. Analytical methods in untargeted metabolomics:state of the art in 2015[J]. Front Bioeng Biotechnol,2015,3(23):1-20.
[9] Au A,Cheng KK,Wei LK. Metabolomics,Lipidomics and Pharmacometabolomics of Human Hypertension[J]. Advances in Experimental Medicine and Biology,2017,2:599-613.
[10] Sofia Tsiropoulou MM,Sandosh Padmanabhan.Urine Meta-bolomics in Hypertension Research[J]. Methods in Mo-lecular Biology,2017,1527:61-68.
[11] Wishart DS,Feunang YD,Marcu A,et al. HMDB 4.0:the human metabolome database for 2018[J]. Nucleic Acids Research,2018,4(46):608-617.
[12] Emwas AH. The strengths and weaknesses of NMR spectroscopy and mass spectrometry with particular focus on metabolomics research[J]. Methods Mol Biol,2015,1277:161-193.
[13] John HF,Bothwell,Griffin JL. An introduction to biological nuclear magnetic resonance spectroscopy[J]. Biological Reviews,2011,86(2):493-510.
[14] NV R. NMR-based metabolomics[J]. Drug and Chemical Toxicology,2002,25(4):375-382.
[15] Nikolic SB,Sharman JE,Adams MJ,et al. Metabolomics in hypertension[J]. J Hypertens,2014,32(6):1159-1169.
[16] Beckonert O,Coen M,Keun HC,et al. High-resolution magic-angle-spinning NMR spectroscopy for metabolic profiling of intact tissues[J]. Nature Protocols,2010,5(6): 1019-1032.
[17] Antignac JP,De Wasch K,Monteau F,et al. The ion suppression phenomenon in liquid chromatography-mass spectrometry and its consequences in the field of residue analysis[J]. Analytica Chimica Acta,2005,529(1-2):129-136.
[18] Patti GJ. Separation strategies for untargeted metabolo-mics[J]. J Sep Sci,2011,34(24):3460-3469.
[19] Xiao JF,Zhou B,Ressom HW. Metabolite identification and quantitation in LC-MS/MS-based metabolomics[J]. Trends in analytical chemistry:TRAC,2012,1(32):1-14.
[20] Wu C,Chen CH,Chen HC,et al. Nuclear magnetic resonance-and mass spectrometry-based metabolomics to study maleic acid toxicity from repeated dose exposure in rats[J]. Journal of Applied Toxicology:JAT,2017,37(12):1493-1506.
[21] Gil AM,Duarte D. Biofluid Metabolomics in Preterm Birth Research[J]. Reproductive sciences(Thousand Oaks,Calif),2018,25(7):967-977.
[22] Cala MP,Aldana J,Medina J,et al. Multiplatform plasma metabolic and lipid fingerprinting of breast cancer:A pilot control-case study in Colombian Hispanic women[J]. PLoS One, 2018,13(2):1-23.
[23] Yin P,Lehmann R,Xu G. Effects of pre-analytical processes on blood samples used in metabolomics studies[J]. Analytical and Bioanalytical Chemistry,2015,407(17):4879-4892.
[24] Bartel J,Krumsiek J,Theis FJ. Statistical methods for the analysis of high-throughput metabolomics data[J]. Comput Struct Biotechnol J,2013,4(5):1-9.
[25] 周寧,颜贤忠. 代谢性疾病的代谢组学研究进展[J]. 国际药学研究杂志,2015,42(5): 561-573.
[26] Astarita G,Langridge J. An emerging role for metabolomics in nutrition science[J]. Journal of Nutrigenetics and Nutrigenomics,2013,6(4-5):181-200.
