食源性致病菌近红外光谱分类鉴别的影响因素
2019-03-19马凯旋刘建学韩四海李璇李佩艳徐宝成罗登林
马凯旋,刘建学,2,*,韩四海,2,李璇,2,李佩艳,2,徐宝成,2,罗登林,2
(1.河南科技大学食品与生物工程学院,河南洛阳471023;2.河南省食品原料工程技术研究中心,河南洛阳471023)
近年,食品安全问题恶性事件在全球范围频频爆发,无论是发达国家还是发展中国家,都面临着食品安全问题。由食源性致病菌引起食品中毒事件的发生率在全球范围内占很大比重,对人类健康造成极大的危害,是隐藏在我们生活中的重大隐患[1-3]。然而随着经济的发展和新技术、化学品的广泛应用,新的食源性疾病不断出现,食品安全的形势变得更加严峻,如何快速高效地检测食源性致病菌已成为近年来的研究热点。
近红外光谱分析技术具有高灵敏性、指纹特征、分析速度快,在对食源性致病菌进行鉴别时,样品的前处理至关重要,因此有必要对近红外光谱技术用于致病细菌分类鉴别的影响因素进行探究[4-6]。在细菌的培养过程中,不同的培养条件可能会影响代谢产物发生变化,直接引起样品近红外谱图的变化。由吴海[7]研究发现,金黄色葡萄球菌在不同的pH值培养以及黑曲霉菌在不同培养基培养下,对所采集的红外光谱图进行分析、比较,发现不同培养环境下的微生物谱图虽然有重现性,但也存在可以用肉眼直接观察到的谱带差异,这种谱带差异是否可以通过化学计量学分析方法进行区分作者并未进行研究。
细菌在不同的生长期阶段对培养液的利用情况存在差异性,且代谢特征也不同,从而其所产生的代谢产物也必然不同[8]。陈丽萍等[9]利用PEN3电子鼻化学传感器对食源性致病菌进行检测,研究了细菌在培养 2、4、6、8、10 h 后所产生的气体成分具有差异性,这种差异主要是细菌在相同的培养基中培养不同时间,对培养基的营养物质利用情况不同,所产生的气味在电子鼻传感器上呈现不同的响应信号。近红外光谱技术能否对这些差异识别出来,尚缺乏相关研究。目前研究都是直接对食源性致病菌进行分类鉴别,对细菌在不同培养条件下的光谱进行比较,没有对培养条件的不同是否会影响近红外光谱技术对细菌的检测结果进行研究。虽然光谱的预处理可以减少噪声和样品量不同所产生的差异,但近红外光谱技术能否完全消除浓度间的差异尚缺乏试验验证,这对样品制备及结果分析至关重要。因此,本文针对此问题探究不同浓度、不同培养阶段等对近红外光谱技术用于细菌分类鉴别的影响。这将会为近红外光谱技术广泛用于细菌分类、鉴定及检测提供重要的方法依据。
1 材料与方法
1.1 材料与试剂
大肠埃希氏菌O157∶H7、金黄色葡萄球菌:中国科学院微生物研究所;单增李斯特菌:河南省洛阳市疾病预防与控制中心;营养肉汤培养基、营养琼脂培养基:北京奥博星公司;0.9%生理盐水、氯化钠:天津科密欧化学试剂有限公司。
1.2 仪器与设备
VECTOR-33型傅里叶变换近红外光谱仪:德国Bruker公司;UV-2600紫外可见分光光度计:日本Shimadzu公司;TGL-20M型高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;YXQ-LS-50S型自动高压灭菌锅:上海博讯实业有限公司医疗设备厂;DHP-9272型电热恒温培养箱、DHP-9420A型电热恒温鼓风干燥箱:上海一恒科学仪器有限公司;HYL-A全温摇瓶柜:太仓市强乐实验设备有限公司;SW-CJ型超净工作台:苏州安净净化科技有限公司;SZ93-1型自动双重纯水蒸馏器:上海亚荣生化仪器厂。
1.3 方法
1.3.1 不同浓度样品制备
取-80℃保藏的菌种放置室温,无菌操作吸取大肠埃希氏菌O157∶H7、金黄色葡萄球菌、单增李斯特菌各1 mL于营养肉汤培养基,37℃,180 r/min振荡培养12 h,蘸取菌液接种于营养琼脂培养基,37℃条件下培养使其复苏,挑取纯化培养后的单菌落接种于营养肉汤培养基,37℃,180 r/min振荡培养,用紫外可见分光光度计测其OD600,用于估计菌液浓度。
将培养至对数期的菌悬液在4℃,5 000 r/min,10 min的高速冷冻离心机分离菌体,用0.9%生理盐水洗涤两次,再用蒸馏水洗涤一次,离心后舍弃上清液,用10 mL 0.9%生理盐水洗涤沉淀部分,充分振荡使菌体均匀分布,将菌液进行梯度稀释103、105、107倍,对应菌落数分别为 105、103、10 CFU/mL。每个样品做4个平行,每个平行做3次重复。
1.3.2 不同培养阶段样品制备
于37℃下接种营养肉汤培养基,180 r/min振荡培养至各细菌的延滞期、对数期、稳定期和衰退期,用紫外可见分光光度计测其OD600,用于估计菌液浓度。将各时期培养后的菌悬液在4℃,5 000 r/min,10 min的高速冷冻离心机分离菌体,用0.9%生理盐水洗涤两次,再用蒸馏水洗涤一次,离心后舍弃上清液,用10 mL 0.9%生理盐水洗涤沉淀部分,充分振荡使菌体均匀分布。每个样品做4个平行,每个平行做3次重复。
1.3.3 检测样品近红外光谱的采集
在温度25℃、湿度60%左右条件下,利用VECTOR-33型傅里叶变换近红外光谱仪采集样品的透射光谱图。以空白比色皿作为光谱的背景采集,扫描范围12 000 cm-1~4 000 cm-1,分辨率 8 cm-1,扫描次数 32 次。
1.3.4 光谱数据的预处理及数据分析
利用The Unscrambler X10.4分析软件对不同浓度、不同培养阶段的3种致病菌所采集的近红外谱图,进行Savitzky-Golay卷积平滑、矢量归一化等预处理。其目的主要是:近红外原始光谱波段中存在大量与样本自身性质无关的冗余和噪声信息,会影响后续数据的分析,所以需要对光谱数据进行预处理,以消除在试验或者检测过程中易受到样品采集量、采集光谱的环境所造成光谱漂移、倾斜现象等因素对试验结果的干扰[10-11]。
主成分分析[12-13](principal component analysis,PCA)是一种较为成熟的多元统计分析方法,是数据压缩和特征信息提取技术。运用PCA方法可以减少数据维数,转换原变量,并且不会降低光谱间的差异信息,这类分析方法可在事先未知类别的情况下对光谱数据进行分析。
将预处理后的不同浓度、不同培养阶段致病菌12 000 cm-1~4000 cm-1波数范围的光谱数据分别导入MATLAB R2014a软件,进行主成分分析分别得到不同浓度、不同培养阶段近红外光谱的主成分聚类分布图。
2 结果与分析
2.1 致病菌的浓度对近红外分类鉴别的影响
将培养至对数期的大肠埃希氏菌O157∶H7、单增李斯特菌和金黄色葡萄球菌分别稀释103、105、107倍,不同稀释度的3种致病菌近红外透射平均光谱图见图1所示。
利用The Unscrambler X10.4软件分别对其进行Savitzky-Golay卷积平滑、矢量归一化等预处理,能在一定程度上消除因噪声和样品量不同产生的光谱差异。由图1可以看出,这3种致病菌的不同稀释度近红外图谱的差异性初步体现出来,但仍无法将不同稀释度的3种致病菌很好的区分。因此需要先进行数学预处理,提取特征光谱信息,采用主成分分析法作进一步的数据处理。经预处理后,将3种致病菌不同稀释度的数据进行PCA分析,汇于表1,得到3种致病菌PC1、PC2的累积贡献率,通常主成分的累积贡献率超过85%以上即可使用[14]。


图1 3种致病菌不同稀释度的近红外透射平均光谱图Fig.1 Near infrared transmission average spectrum of three kinds of pathogenic bacteria with different dilutions

表1 3种致病菌的PCA累积贡献率Table 1 PCA cumulative contribution rate of three pathogenic bacteria
由表1可知,3种致病菌不同浓度的累积贡献率均在90%以上,解释了原始变量的大部分信息,所以采用具有代表性的前2个主成分建立聚类分布模型。以主成分 1(PC1)和主成分 2(PC2)作为聚类依据,主成分聚类分布结果见图2、图3、图4所示。

图2 大肠埃希氏菌O157∶H7不同浓度的PCA聚类分布图Fig.2 PCA cluster distribution drawing of E.coli O157:H7 at different concentrations

图3 单增李斯特菌不同浓度的PCA聚类分布图Fig.3 PCA cluster distribution drawing of Listeria monocytogenes at different concentrations

图4 金黄色葡萄球菌不同浓度的PCA聚类分布图Fig.4 PCA cluster distribution drawing of Staphylococcus aureus at different concentrations
通过PCA分析3种致病菌不同浓度的菌液,可观察到各自分析数据点分布较为集中,没有重叠。试验结果表明近红外光谱对致病菌的响应较为灵敏,主成分分析的区分度较强,在稀释107倍较低浓度下仍能对其进行识别。由此可知,近红外光谱技术对致病菌的浓度比较敏感,尽管对光谱进行预处理,能在一定程度上消除光谱的差异,但这并非绝对。较大的浓度差异将会影响近红外光谱技术对致病菌的检测结果。因此在对细菌进行检测时,样品浓度这一指标不可忽视,应统一样品的浓度,减少后期数据分析的难度。
2.2 致病菌的不同培养阶段对近红外分类鉴别的影响
3种致病菌培养至各细菌的延滞期、对数期、稳定期和衰退期的近红外透射平均光谱图见图5。

图5 3种致病菌不同培养阶段的近红外透射平均光谱图Fig.5 Near infrared transmission average spectrum of three kinds of pathogenic bacteria with different culture phases
由图5可以看出,这3种致病菌的不同培养阶段间近红外谱图的整体趋势非常接近,说明所含物质的基团是相似的,对光谱的吸收峰位差异极小,无法用肉眼直接区分。经预处理后,将3种致病菌不同培养阶段的光谱数据进行PCA分析,汇于表2,得到3种致病菌PC1、PC2的累积贡献率。
由表2可知,不同培养阶段3种致病菌的累积贡献率均在95%以上,解释了原始变量的大部分信息,所以采用前2个主成分建立聚类分布模型具有代表性。将不同培养阶段的3种致病菌进行PCA分析,聚类分布结果如图6、7、8所示。
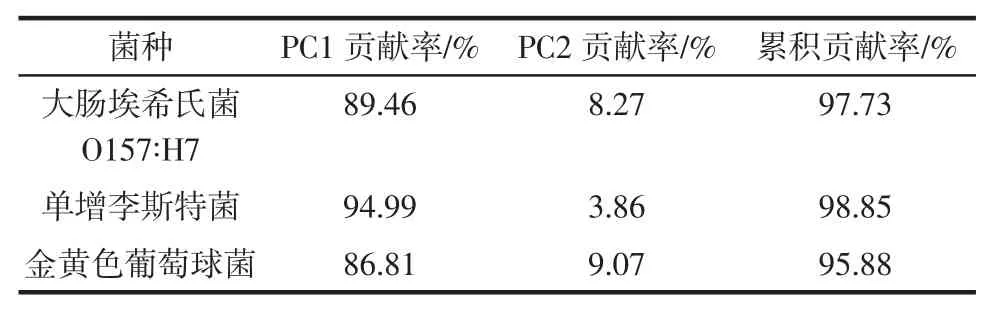
表2 3种致病菌的PCA累积贡献率Table 2 PCA cumulative contribution rate of three pathogenic bacteria

图6 大肠埃希氏菌O157∶H7不同培养阶段的PCA聚类分布图Fig.6 PCA cluster distribution drawing of E.coli O157:H7 at different culture phases
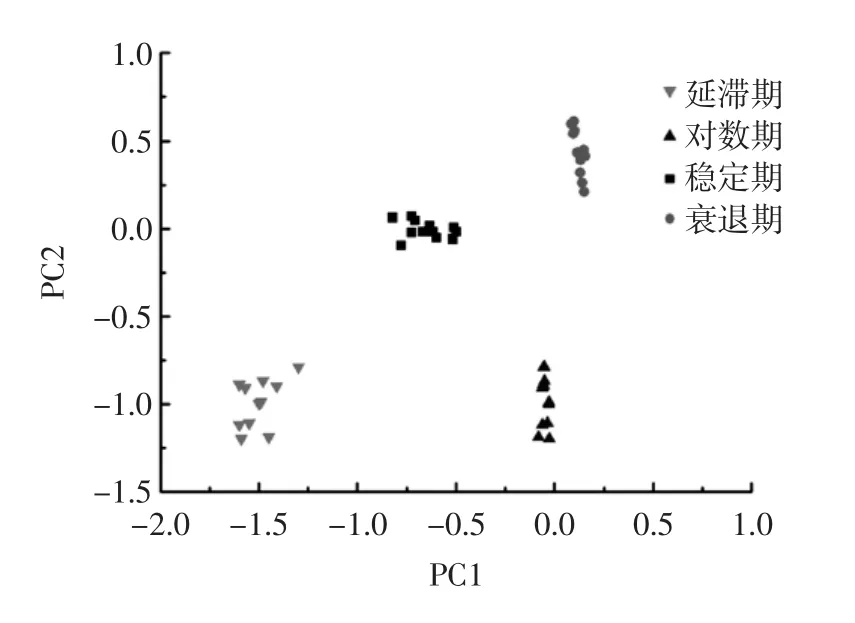
图7 单增李斯特菌不同培养阶段的PCA聚类分布图Fig.7 PCA cluster distribution drawing of Listeria monocytogenes at different culture phases
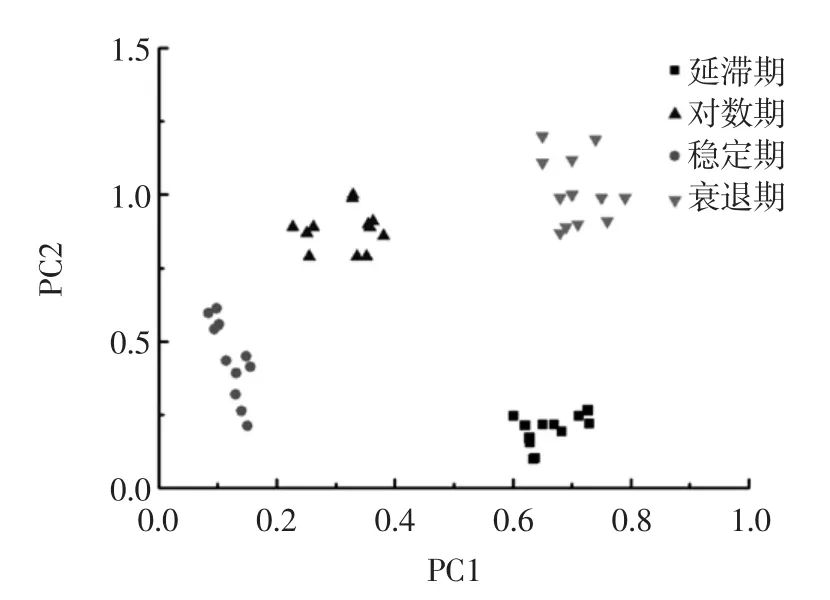
图8 金黄色葡萄球菌不同培养阶段的PCA聚类分布图Fig.8 PCA cluster distribution drawing of Staphylococcus aureus at different culture phases
3种致病菌不同培养阶段的分析数据点各自位于一定的区域范围,分布较为集中,无重叠部分并且PCA累积贡献率较高,说明近红外光谱技术对致病菌的检测受不同培养阶段的影响。由于不同属的细菌菌体所具有的酶系统不同,从而分解能力差别较大,在同样的培养基中培养不同时间,对培养基中的营养物质利用情况和所产生的产物就会不同,挥发物的浓度亦有差异,其所对应的光谱特征也不尽相同。检测结果表明近红外光谱技术可以将同一细菌的不同培养阶段进行区分。可能的原因是:近红外光谱反映的是整个细胞组分的化学键振动情况,由于不同培养阶段的细菌体内产生的代谢成分不同,通过对近红外的特异吸收将其有效的区分。
3 结论
近红外光谱技术具有高灵敏性,在致病菌检测中对样品的前处理至关重要,不同培养条件会使细菌的代谢特征发生变化,从而影响近红外光谱的变化并造成检测结果的误差。在样品的制备过程,光谱采集及数据的处理须严谨、规范。通过对不同培养条件的光谱分析进行验证,由PCA分析结果可知:细菌浓度、培养时间均会干扰致病菌的近红外谱图并影响检测结果。因此,在应用近红外光谱技术对致病菌进行检测时,应对样品的浓度、培养时间进行统一,减少后续数据分析的难度,提高鉴别的准确度。
