猕猴桃果酒发酵过程中色泽变化因素的相关性研究
2019-03-19张鑫郭雨婷孙时光何颂捷秦世蓉左勇
张鑫,郭雨婷,孙时光,何颂捷,秦世蓉,左勇
(四川理工学院生物工程学院,四川自贡643000)
猕猴桃(Actinidia chinensis Planch)属猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia),又名奇异果、中国醋梨、羊桃等,为浆果类落叶藤本植物,在世界上多个国家均有种植[1]。猕猴桃果实富含多种氨基酸、矿物质、有机酸和VC等,具有较高的营养价值和药用价值,有着“VC之王”的美称[2-3]。目前,猕猴桃在我国的种植面积较大,产量较高且产地过于集中,容易出现鲜果销售不及时而腐烂浪费的现象[4]。因此,对猕猴桃的精深加工成为了目前急需解决的课题。猕猴桃果酒是以猕猴桃果实为原料,通过发酵酿制而成的一种低度果酒,因其口感独特、香气怡人、营养丰富而受到广大消费者的青睐。
果酒的色泽是产品重要的感官指标之一,会影响消费者对产品的接受程度。猕猴桃是少数几种成熟后依然呈鲜绿色的水果之一,这种鲜绿色主要来源其果实中富含的叶绿素。但是在猕猴桃果酒发酵过程中,猕猴桃固有的鲜绿色在遭到了破坏的同时,生成许多褐色或黑色物质,使猕猴桃果酒呈现黄褐色,严重影响果酒品质。目前国内外对于猕猴桃酒的研究主要集中在酿造工艺的优化和香气成分的分析,对于猕猴桃果酒发酵过程中色泽变化的研究尚不多见[5-8]。试验通过监测猕猴桃果酒发酵过程中色泽、多酚氧化酶、过氧化物酶、叶绿素、总酚、黄酮、VC等物质的变化情况,结合统计分析,探究其影响色泽的主要因素,为进一步控制猕猴桃果酒的色泽变化提供理论基础。
1 材料与方法
1.1 材料与试剂
绿心猕猴桃、白砂糖:市售;活性干酵母:湖北安琪酵母公司;果胶酶(5万U/g):宁夏和氏璧生物技术有限公司;邻苯二酚(分析纯):上海阿拉丁试剂有限公司;芦丁标准品(99%):上海国药集团;葡萄糖、乙酸锌、亚铁氰化钾、重铬酸钾、福林酚、焦性没食子酸、无水碳酸钠、愈创木酚、抗坏血酸、硫酸、硫酸铜(均为分析纯):成都科龙化工试剂厂。
1.2 仪器与设备
GZ-250-HS恒温恒湿培养箱:韶关广智科技设备公司;TG-16医用离心机:上海安信有限公司;T6新世纪紫外可见分光光度计:上海普析通用仪器有限公司;UltraScan VIS台式色差仪:美国HunterLab有限公司;JYZ-E3榨汁机:山东九阳小家电公司。
1.3 方法
1.3.1 猕猴桃果酒酿造
猕猴桃鲜果→挑选→清洗→打浆(加入SO2)→酶解→接种酵母→前发酵→倒罐→后发酵→陈酿→降酸→过滤→调配→密封装瓶→果酒成品
1.3.2 主要操作要点
1)猕猴桃的前处理、打浆、酶解:选择八成熟无病虫且饱满完整的猕猴桃果,用清水冲洗后加入SO2打浆,向果浆中加入果胶酶,酶解期间每隔2 h搅拌一次。
2)前发酵:用蔗糖将果汁总糖调节至200 g/L后接种酵母,酵母接种比例为0.2 g/L,接种前活化;发酵温度在(20±2)℃内。
3)后发酵:前发酵结束后倒罐,将果酒倒出,封罐后进行发酵,发酵温度控制在(16±1)℃,直至总糖含量低于4 g/L,过滤后在20℃环境下陈酿[4]。
在发酵过程中前发酵期间(0~10 d)每隔24 h取样,后发酵期间(10 d~20 d)每隔48 h取样分析。
1.3.3 色度测定
以透射模式 10°观察模式测定样品 L*、a*、b*值;其中L*表示亮度值(0为黑色,100为白色),a*值表示绿红值(a*>0为红色,a*<0 为绿色),b*表示蓝黄值(b*>0为黄色,b*<0为蓝色);用 dE(色差值)描述样品的颜色变化,计算公式如下[9]:
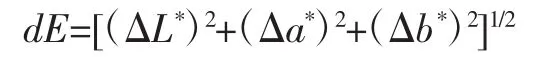
1.3.4 叶绿素含量的测定
叶绿素a、叶绿素b、总叶绿素的含量:紫外分光光度法[10]。
1.3.5 多酚氧化酶(polyphenol oxidase,PPO)活性的测定
3 mL反应体系中,包括0.1 mol/L的邻苯二酚1 mL,pH6.5的磷酸缓冲液1.9 mL和0.1 mL猕猴桃酒样。将其置于410 nm波长下,从猕猴桃果酒加入开始计时,每30 s记录一次OD410值以最初直线段的斜率计算酶活力,表示为A410。
1.3.6 过氧化物酶(peroxidase,POD)活性的测定
1)反应液制备:在 100 mL,pH6.0、0.1 mol/L 磷酸缓冲溶液中,加入0.5 mL愈创木酚和1 mL体积分数为 30%的 H2O2。
2)测定:试管中加入3 mL反应液和0.1 mL猕猴桃酒样,立即摇匀并迅速倒入比色皿中,于470 nm波长下记录吸光度的变化值,每30 s记录一次,共记录3 min,即A470。以不添加任何酶液的反应体系为对照。以A470值表示过氧化物POD的酶活性。
1.3.7 总酚含量的测定
Folin-酚法,标准曲线回归方程:y=1.327 1x+0.014 5,相关系数 R2=0.999 3。
1.3.8 黄酮含量的测定[11]
1)标准曲线的制作:将芦丁标准品(纯度高于99%)在110℃温度下干燥至恒重,准确称取50.00 mg,用体积分数为80%的乙醇溶液溶解,转移至100 mL容量瓶中并用体积分数为80%的乙醇溶液定容至刻度,即500 mg/L芦丁标准溶液。取5支50 mL容量瓶分别加入1、2、3、5、10 mL芦丁标准溶液,然后分别加入质量分数为5%的NaNO2溶液1mL,混匀后静置6 min;然后分别加入质量分数为10%的Al(NO3)3溶液1 mL,混匀后静置6 min;随后分别加入质量分数为4%的NaOH溶液10 mL;最后用体积分数为80%的乙醇溶液定容至50 mL,混匀后静置12 min后在510 nm波长下测定OD值,以芦丁含量(x)为横坐标,吸光度(y)为纵坐标,绘制芦丁的标准曲线;标准曲线回归方程为:y=0.082 1x-0.003 9,相关系数 R2=0.999 2。
2)样品测定:用移液管准确移取3份过滤好的猕猴桃酒样5 mL,于50 mL容量瓶中,分别加入5 mL蒸馏水以稀释酒样。第一份直接用体积分数为80%的乙醇溶液定容至50 mL,以作对照。其他两份然后分别加入质量分数为5%NaNO2的溶液1 mL,混匀后静置6 min;然后分别加入质量分数为10%Al(NO3)3的溶液1 mL,混匀后静置6 min;随后分别加入质量分数为4%的NaOH溶液10 mL;最后用体积分数为80%的乙醇溶液定容至50 mL,混匀后静置12 min后在510 nm波长下测定OD值,并根据上述的标准曲线回归方程,计算出猕猴桃酒样中的总黄酮含量。
1.3.9 VC测定
参照王海佳的方法[12]。
1.3.10 5-羟甲基糠醛 (5-hydroxymethylfurfural,5-HMF)含量的测定
5-HMF含量的测定参考薛楚然的方法[13],标准曲线回归方程为:y=0.106 8x+0.038,相关系数R2=0.997。
1.4 试验数据与结果处理
每组试验做3次平行,试验结果均以x±sd表示。采用Origin 2018软件绘制图表,SPSS 20软件进行相关性分析。
2 结果与分析
2.1 猕猴桃果酒发酵过程中色度变化情况
对于猕猴桃果酒,其色泽是衡量产品质量的重要指标,将直接影响消费者的接受度。猕猴桃果酒发酵过程中色度变化见图1。

图1 猕猴桃果酒发酵过程中色度的变化Fig.1 Changes in chroma during the fermentation of kiwi wine
如图1所示,猕猴桃果酒的色泽变化主要发生在主发酵阶段(0~10 d):色差值dE从0上升到了47.05;其中a*值代表了猕猴桃果酒的红绿色调(a*>0红色色调、a*<0 代表绿色),a*值从-7.3 上升到了-1.55,这说明猕猴桃果汁固有的鲜绿色遭到了极大的破坏;b*值代表了黄蓝色调(b*>0黄色色调、b*<0蓝色色调),呈现先上升后下降的趋势,在第4天达到了最高值,从45.58下降到了21.09,说明在发酵过程中也引起了果肉黄色的显著损失。在后发酵阶段(10 d~20 d),猕猴桃果酒的色泽进一步发生变化:dE从47.05上升到了57.68;a*从-1.55上升到了-0.03,果酒绿色色调基本消失;b*从21.09下降到了13.67,果酒酒体由淡黄色呈现为黄褐色。
2.2 猕猴桃果酒发酵过程中叶绿素含量变化情况
叶绿素是猕猴桃及其制品的主要呈色物质,绿色值(-a*)是评价果浆绿色的感官指标,在猕猴桃果浆加工中要综合考虑叶绿素含量和绿色的保留[14-16],猕猴桃果酒发酵过程中叶绿素含量变化见图2。

图2 猕猴桃果酒发酵过程中叶绿素含量的变化Fig.2 Changes of chlorophyll content during the fermentation of kiwi wine
由图2可以看出,在猕猴桃果酒发酵过程中,叶绿素一直处于下降的趋势,其中在主发酵阶段叶绿素的含量迅速下降,与猕猴桃果酒的色泽中a*值的变化呈负相关。其原因在于,叶绿素的性质极不稳定,容易受到外界条件如光、温度和酸性物质等的干扰而发生降解;另外由于猕猴桃本身属于酸性物质,在果浆破碎后大量的空气进入浆果中也引起了叶绿素氧化而被降解,导致果酒原本的鲜绿色消失。因此,在猕猴桃果酒的发酵过程中,应在保证产品品质的基础上,控制合适的发酵条件(如温度、光照、pH值等),尽量减少其色素的降解。
2.3 猕猴桃果酒发酵过程中多酚氧化酶活性变化情况
由于多酚氧化酶能够在氧参与的情况下把多酚类物质氧化成对应的醌类物质,醌类物质会进一步聚合形成黑色素,影响果酒色泽和品质,猕猴桃果酒发酵过程中多酚氧化酶活性变化见图3。

图3 猕猴桃果酒发酵过程中多酚氧化酶活性的变化Fig.3 Changes in polyphenol oxidase activity during the fermentation of kiwi wine
从图3可以看出,多酚氧化酶的活性呈现先上升后下降的趋势。在猕猴桃果酒发酵的前两天,由于猕猴桃果汁破碎处理后,细胞遭到破坏,细胞内的多酚氧化酶释放并与底物和氧气充分接触,使其活性升高。随着酒精发酵过程的开始,氧气被进一步消耗,与此同时生成的CO2将果酒中的氧气排出,使得多酚氧化酶的活性被逐渐抑制。倒罐后,由于再次添加了亚硫酸钾,游离出的SO2进一步抑制了多酚氧化酶的活性,因此在后发酵后期,多酚氧化酶的活性会逐步趋于稳定[9]。
2.4 猕猴桃果酒发酵过程中过氧化物酶活性变化情况
过氧化物酶能够与多酚氧化酶一起催化多酚类物质,导致其生成醌类物质进一步聚合形成黑色素。此外,过氧化物酶也可以参与VC的氧化反应,进一步促进褐变。猕猴桃果酒发酵过程中过氧化物酶活性含量变化见图4。
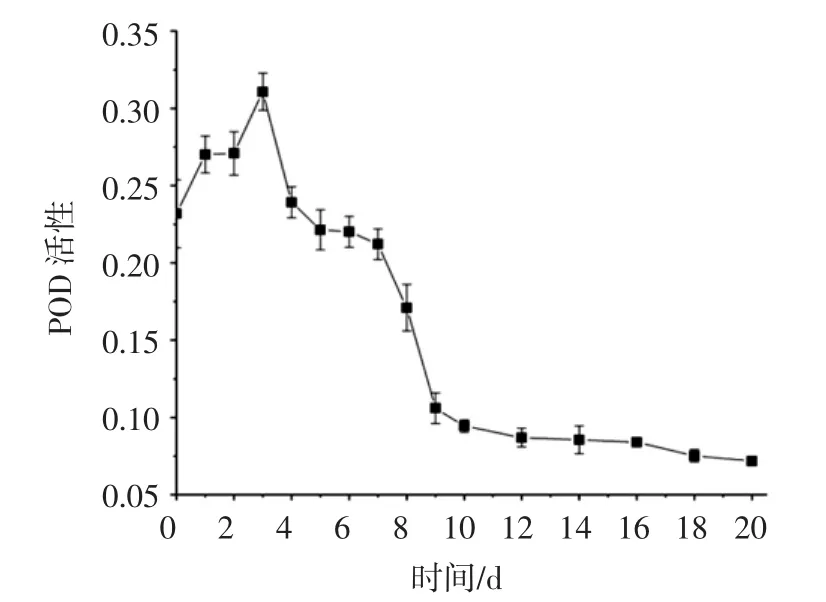
图4 猕猴桃果酒发酵过程中过氧化物酶活性的变化Fig.4 Changes in peroxidase activity during the fermentation of kiwi wine
如图4所示,过氧化物酶活性的变化与多酚氧化酶活性变化基本相似,总体处于先升高后降低的趋势。过氧化物酶的活性在第3天达到最高值,此后其活性迅速下降;进入后发酵阶段,过氧化物酶的活性逐渐趋于稳定。倒罐后添加的SO2同样会限制过氧化物酶的活性,使其在后发酵阶段逐渐趋于稳定。
2.5 猕猴桃果酒发酵过程中总酚和黄酮含量变化情况
在猕猴桃果酒的发酵过程中,猕猴桃皮渣在猕猴桃汁中不断浸渍,逐渐释放单宁等多酚类物质及黄酮。猕猴桃果酒发酵过程中总酚和黄酮含量变化见图5。
如图5所示,总酚和黄酮含量在猕猴桃果酒发酵过程中呈现先上升后逐渐下降的趋势。在发酵的前6 d,总酚和黄酮含量快速上升,增幅分别达到40%和248%,此后,直到发酵结束,总酚含量逐渐降低,较发酵开始时下降了约10%,黄酮含量较发酵开始时上升了8%。原因在于,在发酵前期,猕猴桃皮渣中的多酚和黄酮类物质迅速浸出并溶入发酵醪中,使发酵液中的总酚和黄酮含量升高;随着发酵时间的延长,发酵液中酚类与黄酮类物质逐渐趋于平衡,含量呈现缓慢下降的趋势;伴随着发酵醪中的皮渣分离后,酚类与黄酮类物质被氧化分解,使总酚和黄酮含量进一步下降,这与王行等的研究结果一致[17]。

图5 猕猴桃果酒发酵过程中总酚和黄酮含量的变化Fig.5 Changes in total phenolic and flavonoid content during the fermentation of kiwi wine
2.6 猕猴桃果酒发酵过程中VC含量变化情况
猕猴桃果实中富含丰富的VC,是其鲜果营养价值高的重要原因之一,此外VC也常常作为添加剂与柠檬酸配合用来抑制酶促褐变,但添加使用不当,抗坏血酸的氧化褐变反过来又会影响产品的色泽。猕猴桃果酒发酵过程中VC含量变化见图6。

图6 猕猴桃果酒发酵过程中抗坏血酸含量的变化Fig.6 Change of ascorbic acid content during the fermentation of kiwi wine
从图6可以看出,发酵阶段开始后VC含量一直处于下降的趋势,由发酵开始时的444 mg/L下降到了368 mg/L。在猕猴桃果酒发酵过程中,VC的降解途径主要分为有氧降解和无氧降解:有氧降解过程中,VC被氧化成为脱氢抗坏血酸,与氧气进一步结合后被氧化成二酮基古洛糖酸,二酮基古洛糖酸脱羟基后成为羟基糠醛;无氧降解过程中,脱氢抗坏血酸在CO2的作用下形成糠醛物质[18-19],羟基糠醛可聚合成为褐色物质影响果酒色泽。
2.7 猕猴桃果酒发酵过程中5-羟甲基糠醛(5-HMF)含量变化情况
美拉德反应、抗坏血酸氧化分解、焦糖化反应和多元酚氧化缩合反应4种反应都会形成一种共同的中间产物—羟甲基糠醛(HMF),因此,通常将5-HMF作为评价产品非酶褐变及程度的指标。猕猴桃果酒发酵过程中5-羟甲基糠醛(5-HMF)含量变化见图7。

图7 猕猴桃果酒发酵过程中5-HMF含量的变化Fig.7 Changes of 5-HMF content during the fermentation of kiwi wine
如图7所示,在主发酵阶段,5-HMF含量的变化十分显著,在发酵前两天,5-HMF含量从最初的0.6 μg/mL迅速上升达到1.91 μg/mL,然后其含量迅速下降,在第7天含量为0.65 μg/mL,与发酵开始时含量相差不大。进入后发酵阶段,5-HMF的含量呈现缓慢下降的趋势,至发酵结束其含量为0.34 μg/mL。分析其原因认为是,发酵前期由于美拉德反应后阶段的缩合反应速率较慢,生成的5-HMF主要用于积累,故表现为增加趋势;到了发酵后期,果糖与葡萄糖参与美拉德反应速率变慢,使5-HMF生成量减少,5-HMF的消耗速率大于积累速率,含量因此不断减少。
2.8 猕猴桃果酒发酵过程中褐变因素与色度(dE*)相关性分析
利用SPSS 20软件,将研究中测定的各项指标与色度进行皮尔逊相关性分析,结果见表1。

表1 猕猴桃果酒发酵过程中褐变因素与色度(dE)相关性分析Table 1 Correlation analysis of browning and browning degree(dE)in kiwi wine fermentation
由表1可以看出,在猕猴桃果酒发酵过程中,与色度(dE)呈极显著相关的因素分别是叶绿素、多酚氧化酶(PPO)、抗坏血酸、过氧化物酶(POD)和总酚。相关性分析的结果表明,多酚氧化酶(PPO)和叶绿素对猕猴桃果酒发酵过程中色泽变化影响最大,其次是抗坏血酸、POD、总酚,5-HMF和黄酮对猕猴桃果酒的色泽变化影响较小。
3 结论
猕猴桃果酒在发酵过程中,其色泽由最初的鲜绿色变为黄绿色再转变为黄褐色,其色泽变化情况十分严重;色差值与叶绿素和PPO呈极显著相关(p<0.01),其相关系数分别达到-0.941和-0.902,这说明引起猕猴桃果酒色泽变化的主要因素是色素的降解和酶促褐变。色差值与抗坏血酸、POD和总酚含量也呈负相关关系,相关性极显著(p<0.01),相关系数分别为-0.856、-0.809和-0.749,说明引起猕猴桃果酒色泽变化的次要因素是抗坏血酸反应与非酶促褐变。
对于猕猴桃果酒的护色应该主要围绕其叶绿素的特性来优化发酵工艺,以及添加适当的离子抑制剂使叶绿素形成稳定的螯合物。此外,针对猕猴桃果酒容易发生的酶促褐变可以采用添加酶活性抑制剂来实现酶促褐变的控制。
