橘叶黄酮的纯化及其体外抗氧化能力研究
2019-03-19张秋霞陈康汪金玉黄蕊何慧
张秋霞,陈康,汪金玉,黄蕊,何慧
(广州中医药大学中药学院,广东广州 510006)
橘叶为芸香科植物橘(Citrus reticulata Blanco)及其栽培变种的叶。橘在我国广东、广西、湖南等地区均有栽培。关于橘叶的应用,历史悠久,在《本草纲目》、《本草汇言》、《本草从新》等医书中都有橘叶作为药用的记载,曰其具有疏肝、行气、化痰、消肿之功效[1]。现代“乳块消片”等成药中也应用了橘叶[2]。橘叶在食品中亦有应用,如橘叶茶、橘叶饮料等。
已有的研究资料表明,黄酮类化合物作为橘叶的主要化学成分,约占其化合物总类的64.5%[3-4],其中黄酮类化合物在免疫调节、抗氧化等方面均表现了较优异的应用价值[5-8]。前期研究人员已从提取、分离、鉴别、含测、高效液相色谱(high performance liquid chromatography,HPLC)指纹图谱等多方面对橘叶及其所富含的黄酮类成分进行了研究[9-13],然未见关于橘叶黄酮纯化工艺研究的相关报道,大孔树脂作为一种具有多孔性、比表面积大的高分子吸附剂已广泛应用于中药黄酮类化合物的纯化[14-16]。本试验将对橘叶总黄酮的纯化工艺及其纯化前后抗氧化能力进行研究,以期为橘叶的综合开发利用提供科学参考。
1 材料与试剂
1.1 材料与试剂
橘叶于2017年8月,分别采自广东广宁、广东德庆、广东四会、广东怀集以及广西都安五地。经广州中医药大学中药学院陈康教授鉴定,其基原植物为橘(Citrus reticulata Blanco),以上凭证标本存于广州中医药大学中药学院中药炮制实验室。
AB-8大孔树脂(粒径:0.3 mm~1.25mm;比表面积:480 m2/g~520m2/g):南开大学;D-101大孔树脂(粒径:0.3 nm ~1.25 nm;比表面积:600 m2/g~700 m2/g):南开大学;橙皮苷(纯度>98%;批号:150912):四川省维克奇生物科技有限公司;1,1-二硝基-2-三硝基苯肼(DPPH):美国Sigma公司;氢氧化钠:福晨化学试剂有限公司;硝酸铝:广州化学试剂厂;水杨酸:天津市大茂化学试剂厂;双氧水:成都艾科达化学试剂有限公司;无水乙醇:天津大茂化学试剂厂;以上均为分析纯。
1.2 仪器与设备
UV-5500PC型紫外可见分光光度计:上海元析仪器有限公司;BT125D分析天平(d=0.01 mg):赛多利斯科学仪器北京有限公司;DZWK-S-5恒温水浴锅:北京市永光明医疗仪器厂;PHS-3C pH计:上海盛磁仪器仪器有限公司;MULTISKAN GO酶标仪:Thermo Fisher Scientific OY;层析柱(直径2 cm,长30 cm,1 BV=94 mL):广州市海珠区江南宝龙玻璃仪器厂;THZ-D恒温振荡器:苏州市培英实验设备有限公司。
2 方法与结果
2.1 总黄酮的纯化
2.1.1 对照品溶液的制备
精密称取干燥至恒重的橙皮苷对照品5.82 mg,置50 mL容量瓶中,用50%乙醇加至刻度,摇匀,得对照品溶液(0.114 6 mg/mL)。
2.1.2 供试品溶液的制备
取采自德庆的橘叶50 g,切宽丝,置于圆底烧瓶中,以1∶10(g/mL)料液比加入50%乙醇回流提取2次,每次1 h,合并两次滤液,将滤液放在水浴锅上挥至无醇味,加蒸馏水定容至500 mL,待测。
2.1.3 总黄酮含量测定
文中所涉及的所有总黄酮含量测定均采用文献[9]建立的方法,即:取待测溶液适量,置25 mL量瓶中,加入5%NaNO2溶液1 mL,摇匀,放置6 min,加入10%Al(NO3)3溶液1 mL,摇匀,放置6 min,再加10%NaOH溶液10 mL,加50%乙醇至刻度,放置15 min,即得,同时,以相应的溶剂制作空白样品用于基线校正。
结果,以浓度C为横坐标,吸光度A为纵坐标,绘制标准曲线,得回归方程为A=32.474C-0.043 6,r=0.999 2。以此回归方程测算,2.1.2项下橘叶提取液中总黄酮含量为4.8 mg/mL。
2.1.4 大孔树脂的预处理
将大孔树脂用95%乙醇浸泡过夜,使其充分溶胀,倾去乙醇漂浮物后湿法装柱,加95%乙醇洗脱至流出液放置于蒸发皿内水浴蒸干无固体残渣为止,用蒸馏水洗脱至无醇味,备用。
2.1.5 静态吸附与解吸
分别称取处理后的AB-8、D-101大孔树脂3g(湿重),置250 mL具塞锥形瓶中,加入50 mL黄酮含量为4.8 mg/mL的橘叶提取液(上样液),于25℃转速140 r/min的恒温振荡器上振荡吸附12 h,取出,抽滤,抽滤液保存待测总黄酮含量(吸附液)。树脂用蒸馏水清洗后倒回锥形瓶中,加入50mL75%乙醇液,于25℃转速140 r/min的恒温振荡器上振荡解吸24 h,取出,抽滤液保存待测总黄酮含量(解吸液)。按如下公式,分别计算两种树脂的吸附量Q(mg/g)和解吸率J(%)。

式中:V为溶液体积,mL;C0为上样液液浓度,mg/mL;C1为吸附液浓度,mg/mL;C2为解吸液浓度,mg/mL;M为树脂质量,g。
结果,D-101型大孔树脂与AB-8型大孔树脂吸附量分别为36.12 mg/g和39.43 mg/g,解吸率分别为98.05%和95.88%,差异均较小,最终选择解吸率较高的D-101型大孔树脂进行动态吸附。
2.1.6 动态吸附试验
2.1.6.1 上样液泄露曲线测试
称取经预处理的D-101大孔树脂5.00 g进行动态吸附,以黄酮含量为4.8 mg/mL的橘叶提取液上样,分段收集流出液,每份2 mL,收集80份,以上样体积为横坐标,以流出液黄酮浓度为纵坐标,绘制泄露曲线见图1。当流出液中黄酮浓度达到上样液浓度的10%时为泄露点,当流出液中黄酮浓度为上样液浓度的100%时为饱和点。
结果如图1,上样液体积至第4个流份时,流出液中总黄酮质量浓度为0.55 mg/mL,略超过茶枝柑供试品总黄酮质量浓度的10%;综合考虑,本试验上样液总黄酮量与树脂质量之比为7.7∶1(mg/g)。

图1 泄露曲线Fig.1 Leakage curve
2.1.6.2 上样液质量浓度的选择
称取处理过的D-101大孔树脂5.0 g(湿重),湿法上柱。将浓度分别为 1、2、3、4、4.8 mg/mL,pH 值为 5 的提取液各8 mL上柱,收集流出液,测定黄酮浓度,按式计算树脂的吸附率Q1(%)

式中:C3为上样液浓度,mg/mL;V3为上样液体积,mL;C4为流出液浓度,mg/mL;V4为流出液体积,mL。
结果如图2所示,在一定范围内吸附率随着质量浓度增加而增加;超过一定范围时,吸附率随着质量浓度增加而下降。根据该结果选择1、2、3 mg/mL作为因素上样液浓度的3个水平值,开展进一步工艺优化。
2.1.6.3 上样液pH值的选择
称取处理过的D-101大孔树脂5.0 g,湿法上柱。取2 mg/mL的样品液,NaOH或HCl调pH值为2、3、4、5、6、7后上柱,收集流出液。测定黄酮质量浓度,按式计算吸附率Q1(%)。上样液pH值对吸附性能的影响见图3。

图2 质量浓度对吸附性能的影响Fig.2 Effect of mass concentration on the adsorption properties
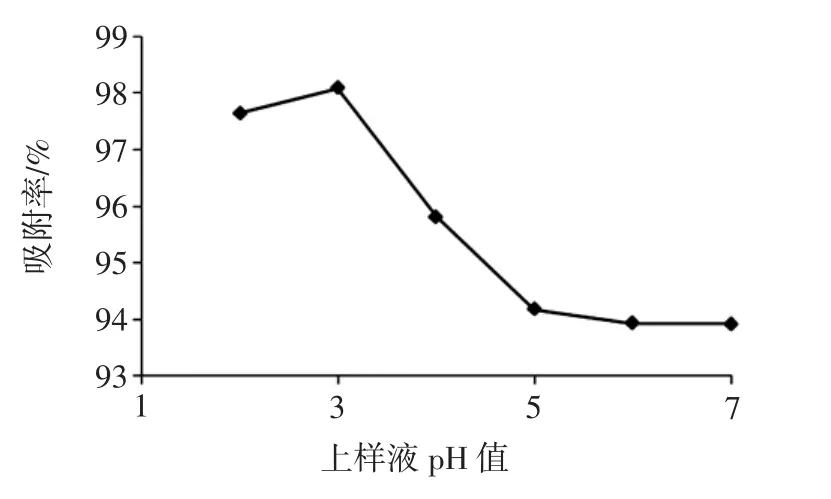
图3 上样液pH值对吸附性能的影响Fig.3 Effect of sample solution pH on adsorption performance
结果如图3,pH值为3时吸附率最高,随着pH值的进一步增大,吸附率呈下降趋势,根据该结果选择2、3、4作为因素pH值的3个水平值,开展进一步工艺优化。
2.1.6.4 上样液流速的选择
精确称取处理过的D-101大孔树脂5.0 g,湿法上柱。取2 mg/mL的样品液,调至pH值为3,分别以0.5、1、1.5、2、2.5 BV/h的流速流过树脂柱,收集流出液。蒸馏水定容到适当体积,测定黄酮质量浓度,按式计算吸附率Q1(%)。样液流速对吸附性能的影响见图4。

图4 上样液流速对吸附性能的影响Fig.4 Effect of sample flow rate on polyamide adsorption performance
结果如图4,在不同的上样流速下,吸附率均较高,差异较小,综合考虑选择0.5、1.0、1.5 BV/h作为因素上样流速的3个水平值,开展进一步工艺优化。
2.1.7 响应面法优化吸附工艺
根据Box-Benhnken试验设计原理,综合动态吸附单因素试验结果,对上样液质量浓度、上样液pH值、上样流速3个因素进行试验设计,因素与水平设计如表1所示。

表1 因素与水平设计表Table 1 Factors and levels of response methodology
响应面试验设计及结果见表2,利用Design-Expert软件对表2的试验结果进行多元回归拟合,得到二次多项式回归模型:Y=98.23962+0.72285A-0.4149B-0.508 48C+0.050 05AB+0.330 8AC-0.084BC-0.322 06A2-0.229 66B2-0.068 21C2。方差分析结果见表3。

表2 响应面设计结果Table 2 Response surface design results
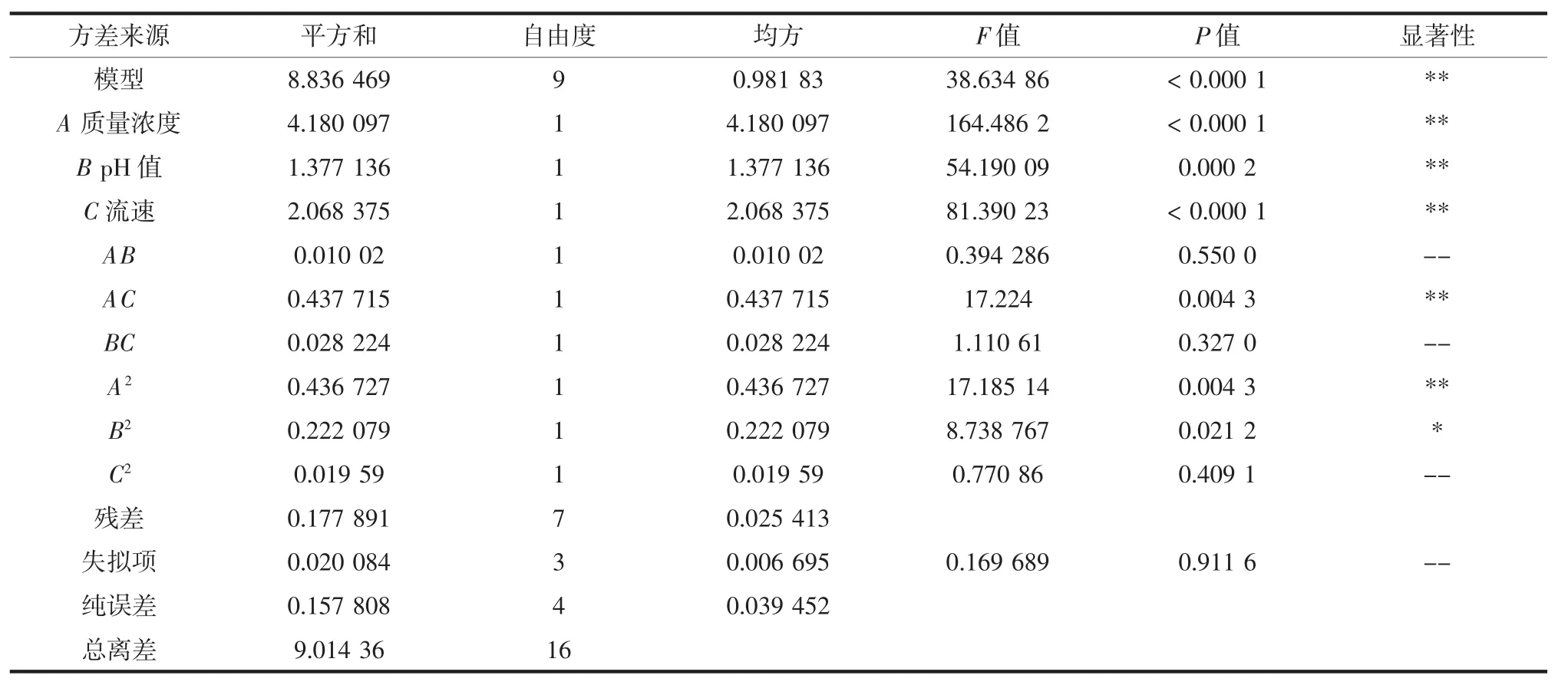
表3 回归模型的方差分析Table 3 ANOVA for response surface quadratic model
由表3可知所得回归模型的P<0.05,失拟项P>0.05,说明试验所选用的二次多项模型具有极显著性且失拟项不显著,模型具有较好的拟合性,可用于分析和预测。
从回归方程模型因变量方差分析可知:模型的一次项A、B、C差异极显著,交叉项AB、BC差异不显著,二次项A2差异极显著、B2差异显著,说明所选因素与响应值之间不是简单的线性关系。同时,由一次项F值的大小可以推断,各因素在试验范围内对吸附率的影响排序为:A(质量浓度)>C(上样液流速)>B(pH值)。流速、pH值、质量浓度对总黄酮吸附率交互影响响应面图见图5。

图5 流速、pH值、质量浓度对总黄酮吸附率交互影响响应面图Fig.5 Response surface plot showing the effect of adsorption rate of total flavonoids with flow rate,pH and mass concentration
图5分析可以得出:3种因素交互作用较显著,表现为曲线坡度较陡,对比A(质量浓度)与B(pH值)、A(质量浓度)与C(上样液流速)、B(pH值)与C(上样液流速)交互作用等高线图密集度,与表3响顺序相吻合,即A(质量浓度)>C(上样液流速)>B(pH值)。
2.1.8 动态解吸试验
2.1.8.1 洗脱剂浓度考察结果
称取D-101大孔树脂5.0 g,湿法上柱,量取8 mL,pH值为3,质量浓度为2 mg/mL的上样液上样,以1 BV/h的流速流过树脂柱。吸附30 min后。用蒸馏水洗去水溶性杂质。分别用相同体积25%、50%、75%、95%乙醇溶液洗脱,收集洗脱液,定容,测定吸光度,按2.1.3项下方法测定各洗脱液的吸光度,计算黄酮浓度。以不同浓度醇液为横坐标,流出液中黄酮质量浓度为纵坐标,绘制曲线见图6。

图6 洗脱液浓度对解析率影响Fig.6 Influence of eluent concentration on resolution rate
结果如图6,随乙醇浓度的增加,洗脱液对橘叶的解析率逐渐增大。当乙醇浓度大于50%时,虽解析率稍有增加,但洗脱效果变化不大,考虑到试验成本,决定用50%的乙醇进行洗脱。
2.1.8.2 洗脱剂用量考察
称取D-101大孔树脂5.0 g,量取8 mL,pH值为3,质量浓度为2 mg/mL的上样液上样,以1 BV/h的流速流过树脂柱。吸附30 min后,用蒸馏水除去水溶性杂质。用50%乙醇洗脱,分段收集流出液,每份4 mL,收集9份,按2.1.3方法测定每份洗脱液的吸光度,计算黄酮质量浓度。以洗脱体积为横坐标,以黄酮质量浓度为纵坐标,绘制曲线见图7。

图7 洗脱剂用量对解析率影响Fig.7 Influence of eluent dosage on resolution rate
结果如图7,当洗脱剂用量为28 mL时,流出液的总黄酮浓度基本不再发生变化,从成本方面考虑,确定洗脱剂用量与树脂质量之比为5.6∶1(mL/g)。
2.1.9 最佳工艺条件求取与工艺验证
通过Design-Expert软件对模型极值求解结合分析等高线得到最佳工艺:上样液质量浓度为2.37mg/mL,上样液流速0.52 BV/h,上样液pH值为2.34,预测最大吸附率为98.88%。综合考虑单因素结果和实际操作的便利,将最佳工艺条件修正为上样液浓度2 mg/mL,上样液流速1 BV/h,上样液pH值为2.5;其他条件为上样液总黄酮量:树脂体积为 7.7∶1(mg/mL),洗脱剂用量与树脂质量之比为5.6∶(mL/mg)。
以修正后最佳工艺重复纯化操作3次,以验证工艺稳定性。结果显示经纯化后总黄酮含量从4.8%提升至72.8%。
2.2 体外抗氧化能力检测
2.2.1 羟基自由基清除试验
5批橘叶,按2.1.2项下制备纯化前溶液,按2.1.9项下修正后最佳工艺条件纯化制得纯化后溶液。按照参考文献[17]中的方法,所得的纯化前和纯化后溶液分别稀释 1、1.25、2.5、5、10 倍,依法进行测定。
以总黄酮浓度统一将柱前柱后浓度换算至同一水平,计算清除率。结果如图8所示,不同批次药材纯化后自由基清除率均高于纯化前,说明经纯化富集得到的黄酮成分是总黄酮中发挥羟基自由基清除作用的主要贡献成分。
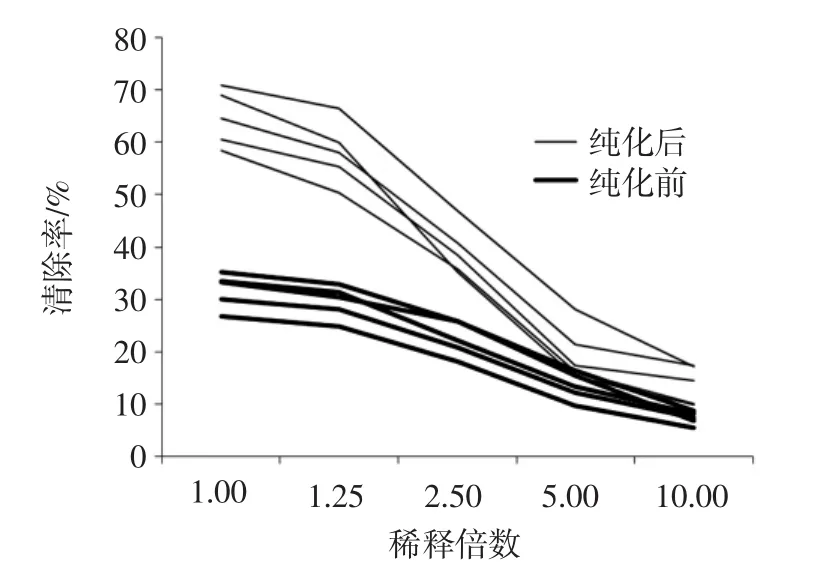
图8 纯化前后羟自由基清除率Fig.8 Hydroxyl radical scavenging rate before and after purification
2.2.2 DPPH自由基清除试验
取约25 mg DPPH,精密称定,甲醇定容至50 mL,避光保存。将2.2.1项下提取液分别稀释1、5、10、20、40、80、160倍。DPPH溶液与样品溶液按照体积比1∶1加入96孔板。样品组(Ai):100 μL DPPH溶液+100 μL样品溶液;对照组(Aj):100 μL甲醇+100 μL样品溶液;空白组(A0):100 μL DPPH 溶液 +100 μL 蒸馏水。完成加入后避光显色30 min,将96孔板放入酶标仪,于517 nm处测量吸光度。DPPH自由基清除率公式为:清除率/%=[1-(Ai-Aj)/A0]×100。
以总黄酮浓度统一将柱前柱后浓度换算至同一水平,计算清除率。结果如图9所示,不同批次药材纯化后自由基清除率均高于纯化前。说明经纯化富集得到的黄酮成分是总黄酮中发挥DPPH清除作用的主要贡献成分。

图9 纯化前后DPPH自由基清除率Fig.9 DPPH radical clearance rate before and after purification
3 讨论与结论
大孔树脂作为中药提取物总黄酮分离纯化方面常用的树脂,具有价廉易得,重复使用等优点,该试验在此基础上考察大孔树脂分离纯化橘叶总黄酮的工艺条件及其纯化前后的抗氧化活性。通过考察上样液质量浓度、上样液pH值、上样液流速的单因素并应用响应面法考察两因素间交互作用,研究吸附因素对D101树脂纯化橘叶总黄酮的影响,进而考察洗脱剂及其用量。最终筛选出较优的总黄酮纯化条件,该纯化工艺操作简便,参数稳定。
为验证纯化分离效果,以羟自由基的清除活性、DPPH自由基的清除活性考察橘叶总黄酮纯化前后的抗氧化活性。试验结果表明,橘叶本身有一定的抗氧化活性,经纯化后,其抗氧化活性显著增强,并呈现浓度依赖性,且不同产区样品均呈现稳定趋势,该结果为纯化工艺的可操作性提供了试验依据。同时为橘叶总黄酮的进一步开发为化妆品、保健品及药品等抗氧化剂提供理论基础,促进橘叶资源的开发利用。
