花椒HPLC指纹图谱建立及指标性成分的测定
2019-03-18张萌萌李朝敏吴博卢烽吴纯洁
张萌萌,李朝敏,吴博,卢烽,吴纯洁
(成都中医药大学 药学院,成都 611137)
花椒为芸香科花椒属植物花椒(Zanthoxylum bungeanum.Maxim)的干燥成熟果皮,主要分布于四川、甘肃、陕西、河北、河南等地[1,2]。花椒果皮是常用的食品和中药配料,因其独特的“麻、香”味而深受人们喜爱,被誉为“八大调味品”之一[3,4]。由于市场上不同品种花椒混种、混收、以次充好,导致市面上的花椒食品质量良莠不齐。GB/T 30391-2013以挥发油含量为依据,将干花椒分为一级(≥3.0mL/100g)、二级(≥2.5mL/100g)2个等级;SB/T 10040-1992以花椒挥发油含量>2.5%作为花椒的质量控制指标。由此可知,花椒食品的质量控制主要集中于挥发油含量测定方面,缺乏整体评价方法,难以全面反映其内在品质。
指纹图谱是随着现代新技术发展而诞生的一种从整体上研究复杂物质体系的技术,已经在中药质量控制、食品评价、环境保护等领域得到了广泛应用[5,6]。指纹图谱技术在食品中的应用,可以对食品品质及其特色成分鉴别提供参考数据。本文采用HPLC技术建立花椒指纹图谱,采用相似度分析和聚类分析对花椒指纹图谱进行分析,并进一步对其主要化学成分进行鉴定及含量测定,从而为花椒食品的质量控制提供科学依据。
1 仪器与材料
1.1 仪器与设备
Shimadzu LC-10A高效液相色谱仪 日本岛津公司;Sartorius BP 211D电子天平(十万分之一) 德国赛多利斯公司;HH-4恒温水浴锅 北京中兴伟业仪器有限公司;UPT-11-10T优普系列超纯水器 四川优普超纯科技有限公司;HX-200型高速中药粉碎机 浙江省永康市溪岸五金药具厂。
1.2 材料与试剂
16批花椒样品信息详情见表1。
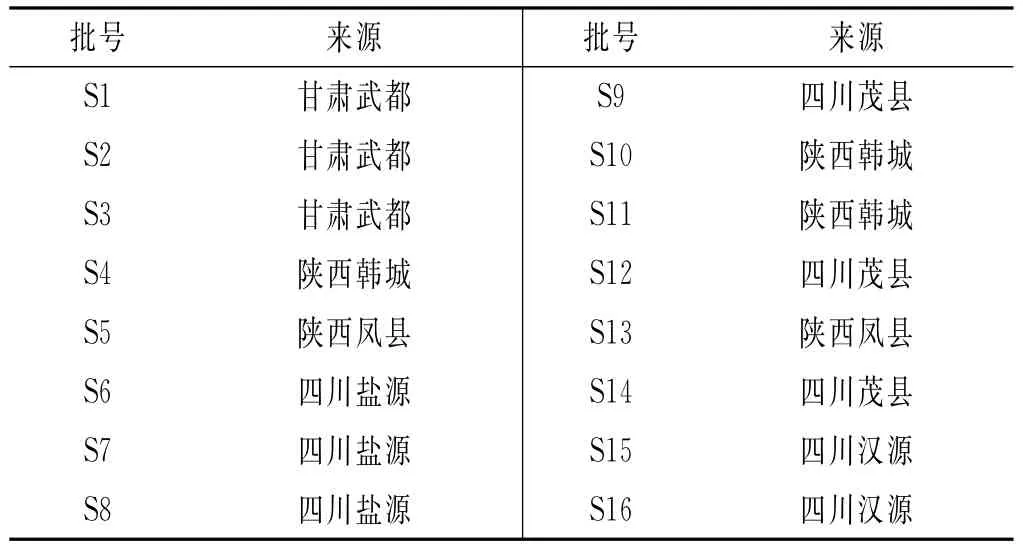
表1 16批不同产地花椒样品Table1 Information of 16samples of Z.bungeanum from different areas
羟基-α,β-山椒素对照品(纯度>98%):实验室自制;甲醇(色谱纯)、乙腈(色谱纯):购自Sigma公司;乙醇、甲醇(分析纯):购自成都市科龙化工试剂厂。
2 实验方法与结果
2.1 指纹图谱研究
2.1.1 色谱条件
Wondasil C18色谱柱(250mm×4.6mm,5μm);流动相:乙腈(A)-水(B)梯度洗脱;流速0.8mL/min;柱温30℃;检测波长268nm;进样量10μL。洗脱程序见表2。

表2 流动相梯度洗脱程序Table2 Gradient elution program of moving phase

续 表
2.1.2 供试品溶液的制备
称取花椒粉末(过3号筛)约0.5g,精密称定,置于50mL锥形瓶中,加30倍量50%的乙醇,回流提取30min,取出,放至室温,过滤;滤渣继续加20倍量50%的乙醇,回流提取30min,取出,放冷,过滤,合并2次滤液,定容至50mL容量瓶中,经0.22μm的微孔滤膜过滤,即得。
2.1.3 精密度考察
称取花椒粉末(S1)约0.5g,精密称定,按2.1.2项下方法制备供试品溶液,按2.1.1项下色谱条件连续进样6次,以4号峰为参照峰,计算各共有峰的相对保留时间和相对峰面积,结果12个共有峰的相对保留时间和相对峰面积的RSD值均小于3%,表明仪器精密度良好。
2.1.4 重复性考察
称取花椒粉末(S1)6份,每份约0.5g,精密称定,按2.1.2项下方法制备供试品溶液,按2.1.1项下色谱条件进行测定分析,以4号峰为参照峰,计算各共有峰的相对保留时间和相对峰面积,结果12个共有峰的相对保留时间和相对峰面积的RSD值均小于3%,表明此方法重复性好,适合花椒指纹图谱的研究。
2.1.5 稳定性考察
称取花椒粉末(S1)约0.5g,精密称定,按2.1.2项下方法制备供试品溶液,按2.1.1项下色谱条件分别于0,0.5,1.0,2.0,4.0,8.0h测定峰面积,以4号峰为参照峰,计算各共有峰的相对保留时间和相对峰面积,结果12个共有峰的相对保留时间和相对峰面积的RSD值均小于3%,表明花椒供试品溶液在8h稳定。
2.1.6 指纹图谱的建立[7]
称取16批花椒粉末各约0.5g,精密称定,按2.1.2项下方法制备供试品溶液,按2.1.1项下色谱条件进样,记录各样品色谱图,得到16批花椒样品的指纹图谱,见图1。将其导入“中药色谱指纹图谱相似度评价系统”(2004A版),以表3中S3为参照图谱,时间宽度设定为0.10,多点校正后,进行分析,生成花椒共有模式对照指纹图谱,标定12个峰,见图2。各批次样品色谱图与对照指纹图谱相似度结果见表3。
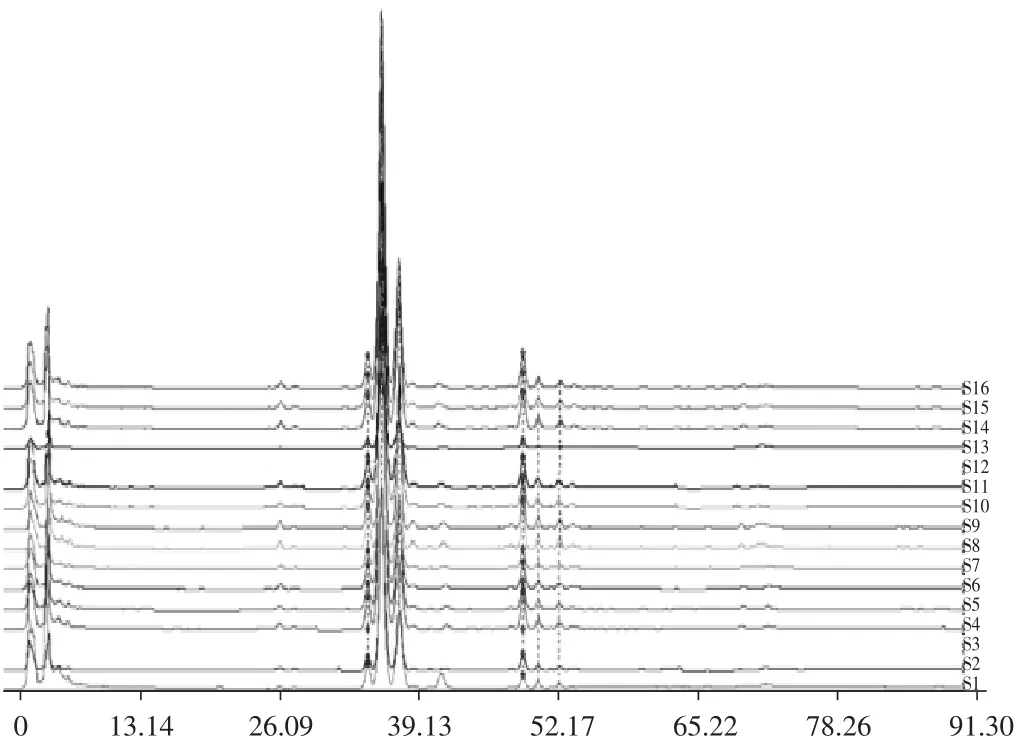
图1 16批花椒样品指纹图谱叠加图Fig.1 Overlay chart of HPLC fingerprint of 16batches of Z.bungeanum
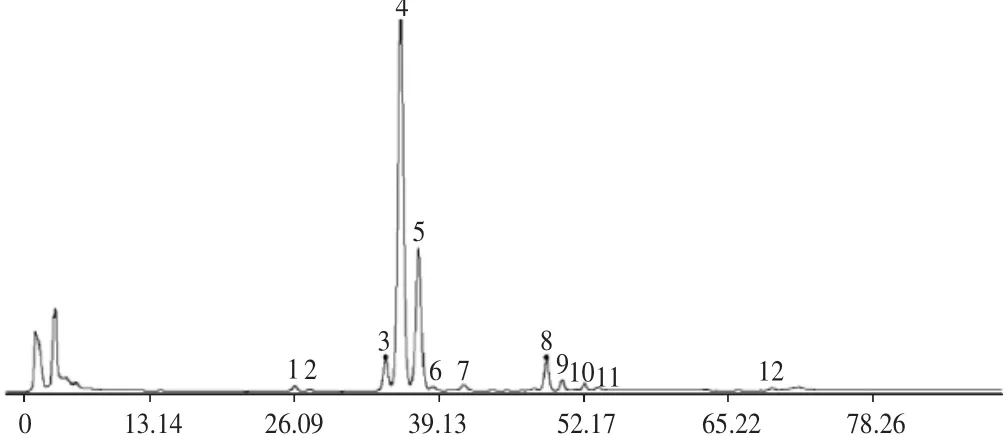
图2 花椒对照指纹图谱Fig.2 Reference fingerprint of Z.bungeanum

表3 16批花椒对照指纹图谱相似度Table3 Similarity of HPLC fingerprint of 16batches of Z.bungeanum
由表3可知,16批花椒样品的相似度较好,均大于0.90,表明各产地的花椒质量具有较高的一致性。
2.1.7 聚类分析[8]
聚类分析是一种无指导、探索性的模式识别方法,以所得样品的色谱指纹图谱为特征,对样品进行分类。本研究应用SPSS软件,将各色谱峰占总色谱峰的峰面积进行量化,利用 Word法,以平方Euclidean Distance为测量度对花椒样品进行聚类分析,见图3。
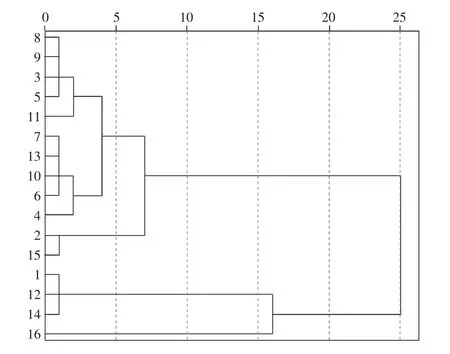
图3 16批花椒样品聚类分析树状图Fig.3 Dendrogram for 16batches of Z.bungeanum
由图3可知,当类间距离为20时,16批花椒样品被分为2大类:S1,S12,S14,S16聚集为一类;S2~S11,S13,S15聚集为一类。当类间距离为10时,16批花椒样品被分为3大类:S2~S11,S13,S15聚为一类;S1,S12,S14聚为一类;S16单独为一类。同一产地的花椒样品相似度较好,但是亦被聚类分析划分为不同的类别,说明同一产地花椒既具有一致性也存在一定的差异。
2.2 样品成分含量的测定
2.2.1 色谱条件
Wondasil C18色谱柱(250mm×4.6mm,5μm);流动相:乙腈(A)-水(B)为40∶60;流速1.0mL/min;柱温30℃;检测波长270nm;进样量10μL。
2.2.2 对照品溶液的制备
分别精密称取羟基-α,β-山椒素对照品适量,加甲醇制成浓度分别为120,160μg/mL的混合对照品储备液,4℃保存,备用。
2.2.3 供试品溶液的制备
精密称取花椒粉末(过3号筛)约0.5g,置于50mL的具塞试管中,加30倍量甲醇,连续超声提取2次,每次60min,过滤,合并2次滤液,定容至50mL容量瓶中,经0.22μm的微孔滤膜过滤,即得。
2.2.4 线性关系考察
分别精密吸取混合对照品储备液0.25,0.625,1.25,2.0,2.5mL于5mL量瓶中,加甲醇定容至刻度,摇匀,即得系列混合对照品溶液。精密吸取系列对照品溶液10μL,注入液相色谱仪,并记录峰面积。分别以浓度(X)为横坐标,峰面积(Y)为纵坐标,得羟基-α-山 椒 素、羟 基-β-山 椒 素 的 回 归 方 程 分 别 为Y=79234X+12078(R2=0.9994)、Y=71625X-12760(R2=0.9993),线性范围分别在6~60μg/mL,8~80μg/mL。
2.2.5 精密度试验
精密吸取羟基-α,β-山椒素混合对照品溶液10μL,连续进样6次,测定峰面积。羟基-α,β-山椒素峰面积的RSD值分别为1.26%,1.12%,表明该仪器精密度良好。
2.2.6 重复性试验
称取花椒粉末6份,每份0.5g,精密称定,按2.2.3项下方法制备供试品溶液,按2.2.1项下色谱条件进行测定分析。供试品溶液中羟基-α,β-山椒素峰面积的RSD值分别为1.98%,1.76%,表明该方法重复性良好。
2.2.7 稳定性试验
称取花椒粉末约0.5g,精密称定,按2.2.3项下方法制备供试品溶液,按2.2.1项下色谱条件分别于0,0.5,1.0,2.0,4.0,8.0h测定峰面积。供试品溶液中羟基-α,β-山椒素峰面积的 RSD值分别为2.15%,1.58%,表明供试品溶液在8h内稳定性良好。
2.2.8 加样回收试验
精密称取已知含量的花椒粉末0.5g,共6份,精密加入质量浓度分别为48,64μg/mL的羟基-α,β-山椒素混合对照品溶液30mL,按2.2.3项下方法制备供试品溶液,按2.2.1项下色谱条件进行测定。羟基-α,β-山椒素的平均回收率分别为95.02%,97.43%;RSD值分别为2.65%,2.54%,表明该方法准确度较好。
2.2.9 含量的测定
称取花椒粉末约0.5g,精密称定,按照2.2.3项下方法制备供试品溶液,按2.2.1项下色谱条件进行测定,计算花椒中主要成分羟基-α-山椒素、羟基-β-山椒素的含量,色谱图见图4,结果见表4。
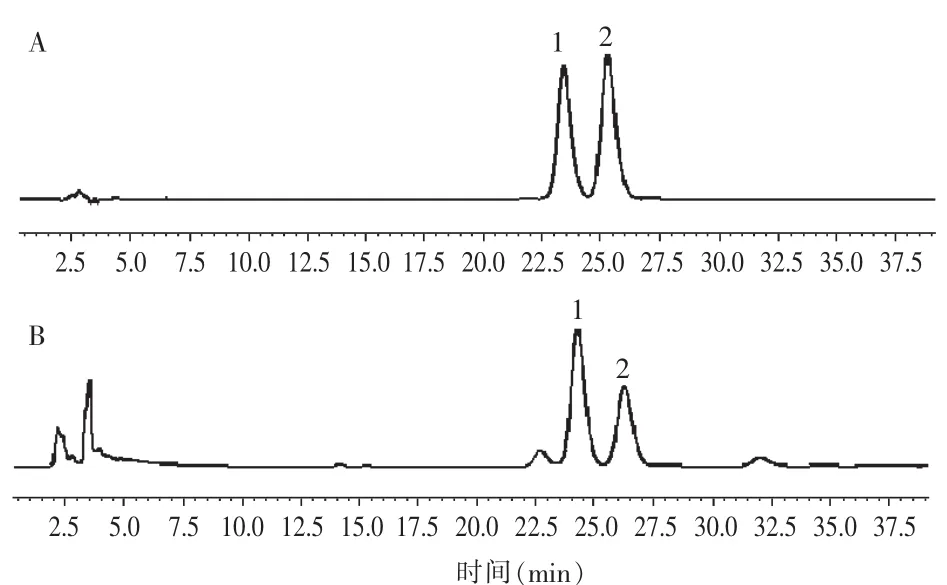
图4 混合对照品(A)和花椒(B)HPLC图Fig.4 HPLC of reference substances(A)and Z.bungeanum(B)
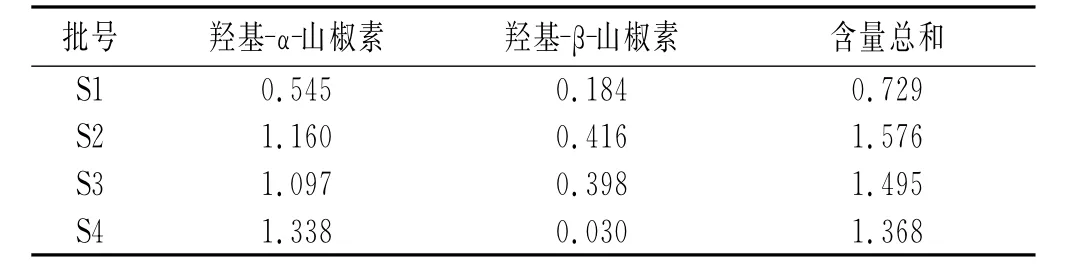
表4 花椒各主要成分含量测定结果Table4 Determination of content of main components in Z.bungeanum%
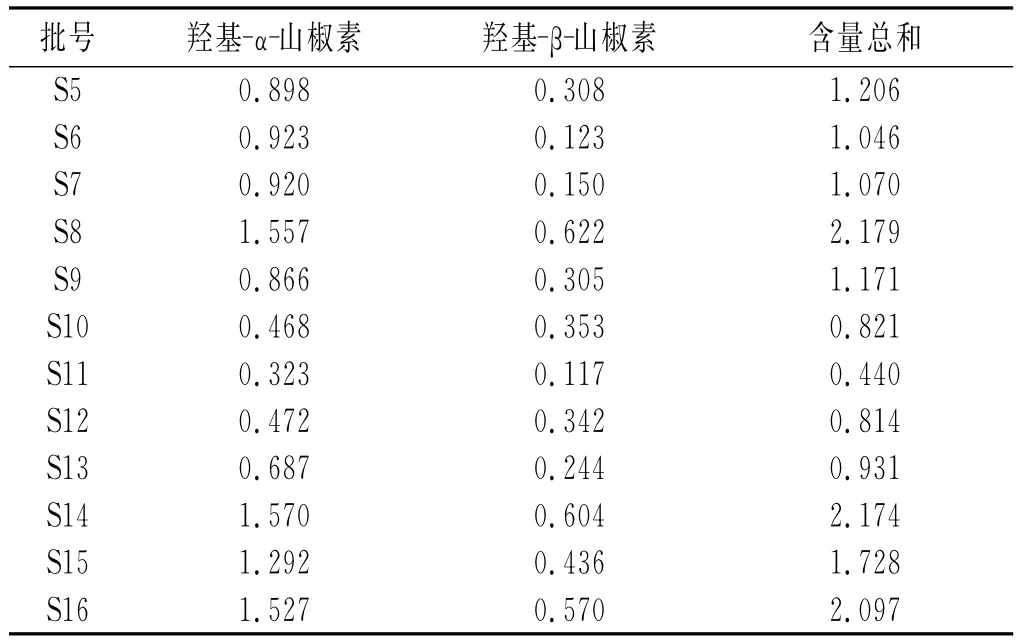
续 表
不同产地16批次花椒样品的2个主要成分羟基-α-山椒素的含量在0.323%~1.570%,羟基-β-山椒素的含量在0.03%~0.622%,含量总和在0.440%~2.179%,其中以四川盐源、汉源含量最高,陕西韩城含量最低,说明不同产地花椒的主要成分羟基-α-山椒素、羟基-β-山椒素质量分数差异较大。
3 讨论
本研究考察了提取方法(超声、回流、冷浸)、提取溶剂(水、50%乙醇、乙醇)、提取时间(15,30,60min)、流动相(甲醇-水、乙腈-水、乙腈-0.1%三乙胺)、波长(220,254,268nm)、柱温(25,30,35 ℃)、流速(0.8,1.0,1.2mL/min),结果表明:采用50%乙醇回流提取30min时,提取较完全,杂质少,分离效果较好;流动相为乙腈-水,梯度洗脱,检测波长268nm,柱温30℃,流量0.8mL/min时,所得图谱的分离效果、基线、峰形等均较好,色谱信息丰富。
本研究建立了16批不同产地花椒HPLC指纹图谱,共标定12个共有峰,并利用相似度评价和聚类分析对花椒HPLC指纹图谱进行研究。16批花椒样品的相似度均大于0.9,表明不同产地的花椒样品质量较好;当类间距离为10时,16批花椒样品被分为3大类:S2,S3,S4~S11,S13,S15聚为一类;S1,S12,S14聚为一类;S16单独为一类。花椒中主要成分羟基-α-山椒素、羟基-β-山椒素的含量总和在0.440%~2.179%。通过分析,发现同一产地花椒指纹图谱的相似度及分类亦有一定的差异,如陕西韩城花椒相似度在0.904~0.935,其主要成分的含量在0.440%~0.821%,两者跨度均较大,可能是由于采收季节的不同或栽培管理方式的不一致造成的,同时进一步说明本研究建立的花椒指纹图谱用于花椒食品质量控制具有积极的意义。
食品质量控制是保证食品安全、营养的关键环节,但是目前食品质量控制大多是通过感官评价或单一成分的含量测定来分析食品的风味及质量[9],该评价方法单一且不能全面反映其内在品质。本研究建立了多个指标成分结合指纹图谱来控制花椒食品质量的方法,弥补了单一挥发油指标控制花椒食品质量的缺陷,同时对花椒食品质量安全标准的建立具有重要意义。
