雪茄烟品种Beinhart1000-1赤星病抗性基因的QTL定位
2019-03-18童治军张谊寒陈学军曾建敏方敦煌肖炳光
童治军 张谊寒 陈学军 曾建敏 方敦煌 肖炳光
雪茄烟品种Beinhart1000-1赤星病抗性基因的QTL定位
童治军 张谊寒 陈学军 曾建敏 方敦煌*肖炳光*
云南省烟草农业科学研究院 / 烟草行业烟草生物技术育种重点实验室 / 国家烟草基因工程研究中心, 云南昆明 650021
由链格孢菌()引起的赤星病是最具破坏性的烟草叶斑病害之一, 在中国严重地影响烟草(L)的产量和质量。选育抗烟草赤星病的优良品种虽是预防该病最经济、有效的途径, 但因其抗性受数量性状基因控制而很难通过常规育种手段实现。为了便于开展烟草抗赤星病分子标记辅助选择育种, 本研究利用抗赤星病雪茄烟品种Beinhart1000-1和感病烤烟品种红花大金元经杂交、自交产生的362个F2单株构建了一张包含670个SSR标记的烟草遗传连锁图谱, 并结合组培快繁形成的F2株系的田间赤星病病情指数(DI), 在全基因组范围内检测获得2个与烟草赤星病抗性相关的QTL, 分别位于第20和23连锁群上的SSR标记TMs05179和TMs04022, 以及TM61049和TM62212之间。这2个QTL等位基因均来自抗病亲本Beinhart1000-1, 它们一起解释了两亲本间81%的病情指数(DI)差异及64%的加性效应。为下一步开展烟草抗赤星病的分子标记辅助育种奠定了基础。
烟草赤星病; 简单重复序列; 遗传连锁图谱; 数量性状基因座
赤星病由链格孢菌((Fries) Keissl)[1-3]引起, 是最具破坏性的烟草(L)叶斑病害之一, 在烟草的整个生育期内均有发生, 尤其在烟叶的成熟期更严重[1-4]。病害通常从烟株下部叶开始发生, 随着叶片的成熟, 病斑自上而下发生[5]。最初在叶片上出现黄褐色圆形小斑点, 而后变成褐色, 并会逐步扩大, 病斑呈圆形或不规则圆形, 有同心轮, 外围有淡黄色晕圈[6-8]。严重时, 病斑相互连接合并, 致使病斑焦枯、破碎。在中国, 赤星病在各个烟区广泛发生, 严重影响烟草的产量和质量。
培育抗烟草赤星病的优良品种虽然是预防该病最经济有效的途径, 但其抗性属于受微效多基因控制且极易受环境影响的数量性状[9-12], 极大地增加了育种的难度。分子标记辅助选择育种(MAS)是利用与目的性状基因连锁的分子标记快捷、有效地选择目标性状基因型, 加快作物育种进程[13]。对数量性状(或微效多基因控制的复杂性状)进行MAS的先决条件是利用分子标记对目的性状扫描定位全基因组的QTL。迄今, QTL定位研究在烟草上虽有较多的报道[14-16], 但在烟草赤星病抗性基因QTL定位分析方面的报道较少[17-20]。究其原因是烟草栽培品种间的多态性水平极其低下[21-29], 高质量的烟草遗传连锁图谱构建工作十分困难[30-33], 因而已报道的基于不完整(低质量)的烟草遗传图谱进行的赤星病抗性基因QTL定位分析的结果, 不能满足烟草抗赤星病的分子标记辅助育种需求。
本研究旨在利用抗、感烟草赤星病品种Beinhart1000-1和红花大金元经杂交、自交产生的F2作图群体构建一张高质量烟草遗传连锁图谱, 并结合组培快繁形成的F2株系的田间赤星病病情指数进行全基因组QTL定位分析, 检测获得与烟草赤星病抗性相关的QTL, 为下一步开展烟草抗赤星病的分子标记辅助育种工作奠定基础。
1 材料与方法
1.1 植物材料
用于遗传图谱构建的群体是由红花大金元和Beinhart1000-1经杂交、自交产生的362个F2单株构成。其中, 红花大金元是具有优良品质但极易感烟草赤星病的烤烟品种, 而Beinhart1000-1则是由美国引进的具有烟草赤星病抗性的优良雪茄烟品种。2015年种植亲本红花大金元和Beinhart1000-1, 杂交后获得其后代F1; 2016年种植F1和亲本, 自交并收获F2种子; 2017年种植包含亲本、F1、F2各世代材料及抗、感对照品种。其中, 抗感对照品种(净叶黄和Speight G-140)、两亲本和F1各种植3个重复, 每个重复15株, 共计45株; 此外, 用于田间烟草赤星病抗性鉴定的362个F2株系(组培快繁获得), 每个株系含有45个具有相同基因型的组培单株, 即每个株系种植3个重复, 每个重复15个单株。于云南省玉溪市研和实验基地种植以上试验材料, 株行距为0.50 m×1.00 m, 按当地优质烟生产技术措施进行栽培管理。
1.2 组培快繁
通过外植体的处理、培养基的配置、组培室培养和再生植株诱导及移栽将362个F2单株进一步扩繁为362个F2株系。
1.3 接菌与抗性调查
将赤星病强致病力菌株0-268 (由云南省烟草农业科学研究院提供)接种于PDA培养基上, 在28℃条件下培养15 d, 待菌丝布满培养基表面时, 保存在4℃的冰箱中备用[6]。在田间叶片接近成熟期时, 用1%灭菌葡萄糖溶液洗下菌苔, 过滤获得分生孢子液, 再用1%葡萄糖、1%甘油、0.25%吐温-80组成的水溶液配制10,000个mL–1的分生孢子悬浮液。利用新配置的烟草赤星病菌分生孢子悬浮液对两亲本、362个F2株系和抗、感病对照品种(净叶黄和Speight G-140)进行接病菌试验[34], 并在对照品种病情指数(DI)达到75%时, 按国家标准GB/T 23222-2008烟草病虫害分级及调查方法进行调查。将3个重复共计45株接种烟株的所有叶片进行分级调查, 并计算出平均病情指数来替代原始F2单株的病情指数。
1.4 SSR标记分析
按照Tong等[32]方法提取和纯化亲本和362份F2单株的基因组DNA。参照Bindler等[30-31]和Tong等[33]进行SSR-PCR扩增体系配置和程序设置。参照Xu等[35]的方法进行PCR扩增产物的6%非变性聚丙烯酰胺凝胶(non- denaturing PAGE)电泳检测。
1.5 遗传图谱构建
首先, 利用两亲本和F1三份材料对参试的SSR标记进行多态标记筛选, 选取呈共显性多态的SSR标记进行F2群体基因型分析。其次, 将获得的F2群体基因型数据经过偏分离分析(卡方检测), 并将分离比符合1∶2∶1的标记用于遗传连锁图谱的构建。最后, 利用作图软件JoinMapv 4.0[36]分析符合1∶2∶1分离比例的标记间的遗传连锁关系, 并利用软件MapChart v2.22[37]绘制遗传图谱。参照Tong等[32-33]设置以上软件相关参数。
1.6 QTL定位分析
基于构建获得的遗传图谱并结合田间赤星病病情指数(DI), 利用MapQTL v 6软件[38]提供的Restricted Multiple-QTL model Mapping (rMQM)方法进行全基因组QTL扫描定位, 相关参数设置为: Algorithm=Regression, Test statistic=LOD, Fit dominance for F2=Yes, Mapping step size=1.0, Maximum number of neighboring markers=30, Maximum number of iterations=10,000, Number of permutations=10,000。按照McCouch等[39]的方法命名QTL, 即前缀q+性状名称缩写+ LG数目。
2 结果与分析
2.1 赤星病抗性鉴定
由田间鉴定结果可知, 两亲本间的赤星病抗性差异较大, Beinhart1000-1和红花大金元的平均病情指数(DI)分别为7.39 (变异范围为2.03~13.96)和91.28 (变异范围为78.85~98.38)。
赤星病的病情指数在由组培快繁获得的F2群体中呈连续性分布(变异范围为2.30~98.13), 即呈典型的正态分布且所有的数据均落在两亲本内(图1)。这一结果与已报道的研究结果相符, 即烟草赤星病的抗性是典型的数量性状[9-12,20,40]。同时也表明, 在F2群体中不存在赤星病抗性的超亲分离现象, 这意味着感病(高值病情指数)和抗病(低值病情指数)的等位基因在两亲本间是完全连锁在一起的, 即所有高值病情指数的亲本具有易感病的等位基因, 而所有低值病情指数的亲本具有抗病等位基因。
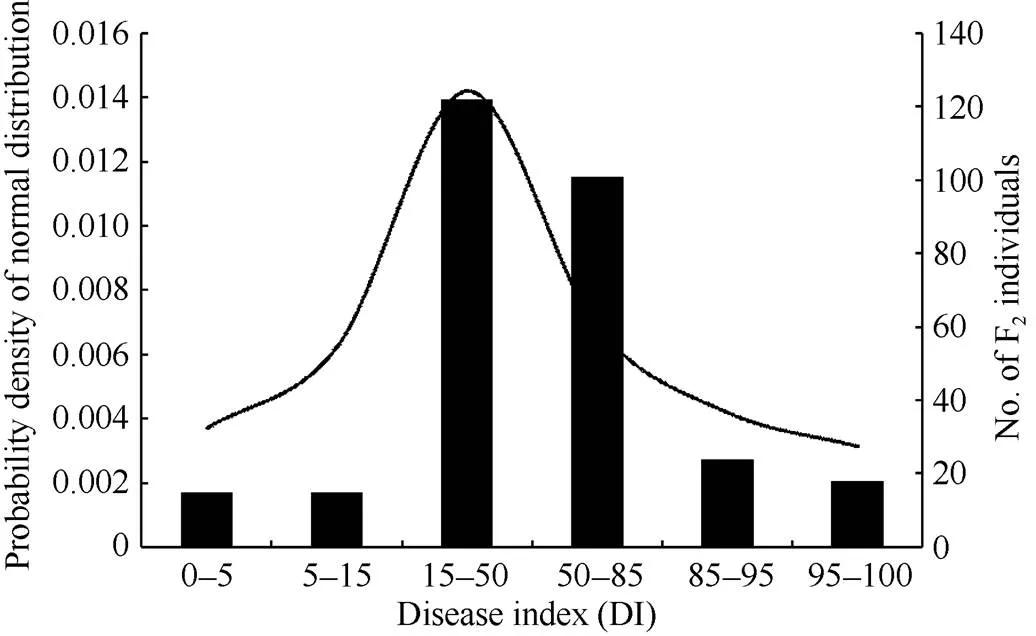
图1 烟草赤星病病情指数在F2群体中的分布频率
2.2 遗传连锁图谱构建
利用双亲(红花大金元和Beinhart1000-1)及其F1三份材料, 对共计38,437对SSR引物(TM、TMt、TMs和PT系列引物分别为11,302、12,016、10,000和5119对)进行多态性分析, 其中, 仅筛选出677对(TM、TMt、TMs和PT系列多态性引物分别为138、187、172和180对)在两亲本间有多态且在F1上呈共显性的SSR引物, 多态率低至1.76% (677/38,437)。利用筛选出的稳定且呈共显性多态的SSR引物在362个F2单株中所获得的基因型数据进行连锁分析, 最终获得一张含有670个SSR标记、较均匀分布于24个连锁群、覆盖烟草基因组总长度为2878.732 cM、相邻标记间的平均距离为4.297 cM的高质量烟草遗传连锁图谱。每条连锁群所包含的SSR 标记数目在13(LG05)~43(LG02)之间, 各染色体的长度范围是43.122 cM (LG19)~186.598 cM (LG22), 各染色体相邻标记间平均间隔的变化在2.398~6.794 cM之间。此外, 受益于共有的180个PT系列标记, 我们参照Bindler等[30-31]公布的图谱将本研究构建获得的连锁群编号, 使二者的连锁群顺序和编号保持一致。
2.3 QTL定位分析
最终有2个与烟草赤星病抗性基因相关的QTL被检测到, 分别位于第20(LG20)和第23(LG23)连锁群上 (表1)。其中,是2个QTL中具有最大效应值的一个, 可解释18.31%的表型变异。2个QTL均具有显著的加性效应, 但仅有表现出显著的显性效应, 这表明, 感病基因(具有较高的DI值)相对于抗病基因(具有较低的DI值)呈现出完全显性。此外, 2个抗病的等位基因全部源自抗病亲本Beinhart1000-1。

图2 基于362个F2单株(红花大金元×Beinhart1000-1)的烟草赤星病抗性QTL定位结果
图中每条连锁群的左右两侧分别为遗传距离(厘摩尔)和标记名称, 其中, 红色标记表示位于Bindler等[30-31]公布的连锁群上。
In each linkage group, the positions (cM) and names of markers were shown on the left and right side, respectively. The red markers were mapped in the genetic map constructed by Bindler et al.[30-31]

表1 烟草赤星病抗性QTL定位结果
a负的加性效应值表示源自抗病亲本Beinhart1000-1的等位基因(位点)降低了烟草赤星病的病情指数。b表示QTL解释的表型变异比率。
aNegative additive effect indicates that the allele from resistant parent Beinhart1000-1 decreases the value of the trait (disease index).bPercentage of phenotypic variation explained by the QTL.
3 讨论
由于用于构建作图群体的双亲间亲缘关系较近, 因此, 本研究中用于构建遗传连锁图谱的标记较少, 且标记的多态性水平较低(1.76%; 677/38,437), 远低于Bindler等[31]所用标记的多态率(46.16%; 2363/5119)。本研究利用670个多态SSR标记构建的图谱中虽然也包含24个连锁群(与普通栽培烟草中所拥有的24对染色体一致), 但仍然存在标记数目较少的连锁群, 尤其是LG05连锁群其上仅有13个标记。相较于Bindler等[31]公布的含有2363个SSR标记分布在24个连锁群上且覆盖全基因组3270 cM的高密度烟草遗传连锁图谱, 我们构建的图谱有待进一步完善。其差距在于: 1) 作图的亲本材料不同。本研究所用的材料均属于栽培烟草且红花大金元与Beinhart1000-1间具有很近的(或相似的)亲缘关系; 而Bindler等[30-31]使用的2个亲本材料间的亲缘关系较远(双亲间的遗传相似性系数GS≈0.385), 接近于栽培烟草与野生烟草间的亲缘关系。2) 基因型分析所使用的试验检测系统不同。本研究使用的实验检测系统(6%的非变性聚丙烯酰胺凝胶和银染显色)的分辨率及灵敏度均较低; 而Bindler等[30-31]的检测系统(Applied Biosystems 3100 Genetic Analyzers)很灵敏, 因此, 那些具有较小片段长度差异的标记很可能在我们的试验系统中无法检测出来。
本研究所使用的2个亲本材料的赤星病抗性表现刚好呈现出2个极端且没有超亲遗传现象在F2群体中表现出来(即, F2群体中的赤星病病情指数变异范围完全包含在抗、感两亲本的赤星病DI值内)。这表明, 所有的抗、感病等位基因分别来自抗、感病亲本。此外, 在不计上位性效应的前提下, 两亲本间不同的DI值(91.28-7.39= 83.89)应该是由加性效应的累积产生的。QTL定位的结果也与赤星病田间表型数据在两亲本和F2群体中的分布相符合, 即所检测到的2个低DI值QTL的等位基因均来自抗病亲本Beinhart1000-1。根据加性效应值且不计上位性效应的前提下, 检测到的2个QTL共同解释了两亲本间53.58 [2´(15.87+10.92)]或约64% (53.58/83.89)的加性效应值。这就意味着, 通过利用在抗病亲本Beinhart1000-1中的2个QTL对应的等位基因与感病亲本红花大金元替换后, 红花大金元的DI值如预期一样地由89.25降低至39.73。因此, 本研究筛选获得的2个QTL可应用于烟草抗赤星病的分子标记辅助育种。
前人关于烟草赤星病抗病基因QTL定位分析的研究主要集中在抗病烤烟品种净叶黄上[17-19], 通过对比发现(二者用于QTL定位的标记和连锁群顺序是相同的, 均按照Bindler等[31]公布的连锁群排序), Tong等[17]获得的3个源自净叶黄的赤星病抗性QTL与本研究获得的2个QTL不同, 前者分别位于第3 (LG03)、第4 (LG04)和第17 (LG17) 3个连锁群上, 而后者分别位于第20 (LG20)和第23 (LG23) 2个连锁群上。因此, 源自净叶黄与源自Beinhart1000-1的赤星病抗性基因(QTL)是不同的。目前仅有1篇基于Beinhart1000-1的赤星病抗性QTL定位分析研究[20], 虽也检测获得2个QTL(分别位于第7和第15连锁群上的RBS-1和RBS-2), 但二者因使用的标记和连锁图谱不同而无法进一步将同是源自Beinhart1000-1赤星病抗性的4个QTL间的关系进行比较。
本研究通过对2个QTL两侧的标记进行检测, 在362个F2单株中分别有5株和3株与红花大金元和Beinhart1000-1一致的基因型单株, 其平均DI值分别为85.93 (变异范围为78.38~91.57)和17.96 (变异范围为9.49~26.17)。所以, 这两组的DI值差异为85.93–17.96= 67.97 (占两亲本间DI值差异的81%), 解释了23%的加性效应值(2个QTL共同解释了64%)。这说明, 在2个QTL的加性效应中存在着两两间的互作效应(上位性效应), 这也正解释了两亲本间剩余19% (100%~81%)的DI值。与预期一致, 上位性效应与加性效应均在同一方向上提高两亲本间DI值的差异。因此, 在2个QTLs中与Beinhart1000-1基因型相同的单株可能是赤星病抗性最优的。
[1] Lucas G B. Tobacco Disease, 2nd edn. New York: The Scarecrow Press, 1965. pp 103–110.
[2] Main C E. The tobacco brown spot lesion, a model to study halo formation., 1969, 59: 1040–1045.
[3] Deborah R, Harvey W. Biocontrol of tobacco brown-spot disease by bacillus cereus in a controlled environment., 1991, 61: 930–932.
[4] Ramm C V, Lucus G B. Epiphytology of tobacco brown spot caused by., 1963, 53: 450–455.
[5] Stavely J R, Slana L J. Relation of leaf age to the reaction of tobacco to., 1970, 61: 73–78.
[6] Slavov S, Mayama S, Atamassov A. Toxin production oftobacco pathotype., 2004, 18: 90–95.
[7] Jenning D B, Daub M E, Pharr D M, Williamson J D. Constitutive expression of a celery mannitol dehydrogenase in tobacco enhances resistance to the mannitol-secreting fungal pathogen., 2002, 32: 41–49.
[8] Yakinova E T, Yordanova Z P, Slavov S, Toteva V M K, Woltering E J.AT toxin induces programmed cell death in tobacco., 2009, 157: 592–601.
[9] Stavely J R. Inheritance of brown spot resistance in., 1975, 2: 228–230.
[10] Dobhal V K, Monga D. Genetic analysis of field resistance to brown spot caused by(Fries) Keisaler inL., 1991, 17: 11–15.
[11] 郭永峰, 朱贤朝, 石金开, 孔凡玉, 王年, 王从丽. 烟草对赤星病田间抗性的遗传研究. 中国烟草科学, 1998, 17(3): 11–16. Guo Y F, Zhu X C, Shi J K, Kong F Y, Wang N, Wang C L. Genetic studies on resistance to brown spot disease in tobacco., 17(3): 11–16 (in Chinese with English abstract).
[12] 郭永峰, 石金开, 孔凡玉, 王年, 王从丽, 何京美, 朱贤朝. 烟草赤星病抗性因素遗传的双列分析. 中国烟草科学, 2000, 21(4): 17–20. Guo Y F, Shi J K, Kong F Y, Wang N, He J M, Zhu X C. Diallel cross analysis on inheritance of resistance components to tobacco brown spot disease., 2000, 21(4): 17–20 (in Chinese with English abstract).
[13] Stuber C W, Edwards M D, Wendel J F. Molecular marker- facilitated investigations of quantitative trait loci in maize: II. Factors influencing yield and its component traits., 1987, 27: 639–648.
[14] Nishi T, Tajima T, Noguchi S, Ajisaka H, Negishi H. Identification of DNA markers of tobacco linked to bacterial wilt resistance., 2003, 106: 765–770.
[15] Julio E, Denoyes R B, Verrier J L, de Borne F D. Detection of QTLs linked to leaf and smoke properties inbased on a study of 114 recombinant inbred lines., 2006, 22: 144–166.
[16] Vontimitta V, Lewis R S. Mapping of quantitative trait loci affecting resistance toin tobacco (L.) line Beihart-1000., 2010, 58: 294–300.
[17] Tong Z J, Jiao T L, Wang F Q, Li M Y, Leng X D, Gao Y L, Li Y P, Xiao B G, Wu W R. Mapping of quantitative trait loci conferring resistance to brown spot in flue-cured tobacco (L.)., 2012, 131: 335–339.
[18] 蒋彩虹, 罗成刚, 任民, 杨爱国, 冯全福, 王元英. 一个与净叶黄抗赤星病基因紧密连锁的SSR标记. 中国烟草科学, 2012, 33(1): 9–22. Jiang C H, Luo C G, Ren M, Yang A G, Feng Q F, Wang Y Y. A SSR marker tightly linked to the resistant gene of Jingyehuang on tobacco brown spot., 2012, 33(1): 19–22 (in Chinese with English abstract).
[19] 蒋彩虹, 王元英, 任民, 张兴伟, 杨爱国, 程立锐, 冯全福, 罗成刚. 一个抗赤星病基因的SSR标记连锁群. 分子植物育种, 2013, 11: 566–569. Jiang C H, Wang Y Y, Ren M, Zhang X W, Yang A G, Cheng L R, Feng Q F, Luo C G. A linkage group of SSR markers linked to the resistant gene on tobacco brown spot., 2013, 11: 566–569 (in Chinese with English abstract).
[20] 高亭亭, 蒋彩虹, 罗成刚, 杨爱国, 程立锐, 代帅帅. Beinhart1000-1抗赤星病基因的QTL定位. 中国烟草学报, 2014, 20(2): 104–107. Gao T T, Jiang C H, Luo C G, Yang A G, Cheng L R, Dai S S. Mapping of quantitative trait loci affecting resistance to brown spot in tobacco line Beinhart1000-1., 2014, 20(2): 104–107 (in Chinese with English abstract).
[21] Del Piano L, Abet M, Sorrentino C, Acanfora F, Cozzolino E, DiMuro A. Genetic variability inandspecies as revealed by RAPD procedure., 2000, 19: 1–15.
[22] Ren N, Timko M P. ALFP analysis of genetic polymorphism and evolutionary relationships among cultivated and wildspecies., 2001, 44: 559–571.
[23] Rossi L, Bindler G, Pijnenburg H, Isaac P G, Henri I G, Mahe M, Orvain C, Gadani F. Potential of molecular marker analysis for variety identification in processed tobacco., 2001, 14: 89–101.
[24] Arslan B, Okunus A. Genetic and geographic polymorphism of cultivated tobaccos () in Turkey., 2006, 42: 667–671.
[25] Julio E, Verrier J L, de Borne F D. Development of SCAR markers linked to three disease resistances based on AFLP withinL., 2006, 112: 335–346.
[26] Moon H S, Nicholson J S, Lewis R S. Use of transferableL. microsatellite markers for investigating genetic diversity in the genus., 2008, 51: 547–559.
[27] Raju K S, Madhav M S, Sharma R K, Murthy T G K, Mohapatra T. Genetic polymorphism of Indian tobacco types as revealed by amplified fragment length polymorphism., 2008, 94: 633–638.
[28] Moon H S, Nicholson J S, Heineman A, Lion K, der Hoeven R V, Hayes A J, Lewis R S. Changes in genetic diversity of U.S. flue-cured tobacco germplasm over seven decades of cultivar development., 2009, 49: 498–506.
[29] Moon H S, Nifong J M, Nicholson J S, Heineman A, Lion K, der Hoeven R V, Hayes A J, Lewis R S. Microsatellite-based analysis of tobacco (L.) genetic resources., 2009, 49: 2149–2157.
[30] Bindler G, der Hoeven V R, Gunduz I, Plieske J, Ganal M, Rossi L, Gadani F, Donini P. A microsatellite marker based linkage map of tobacco., 2007, 114: 341–349.
[31] Bindler G, Plieske J, Bakaher N, Gunduz I, Ivanov N, der Hoeven R V, Ganal M, Donini P. A high density genetic map of tobacco (L) obtained from large scale microsatellite marker development., 2011, 123: 219–230.
[32] Tong Z J, Yang Z M, Chen X J, Jiao F C, Li X Y, Wu X F, Gao Y L, Xiao B G, Wu W R. Large-scale development of microsatellite markers inand construction of a genetic map of flue-cured tobacco., 2012, 131: 674–680.
[33] Tong Z J, Xiao B G, Jiao F C, Fang D H, Zeng J M, Wu X F, Chen X J, Yang J K, Li Y P. Large-scale development of SSR markers in tobacco and construction of a linkage map in flue-cured tobacco., 2016, 66: 381–390.
[34] 郭永峰, 朱贤朝, 孔凡玉, 石金开, 王年. 赤星病抗源的抗性比较. 中国烟草科学, 1997, 11(4): 1–6. Guo Y F, Zhu X C, Kong F Y, Shi J K, Wang N. Comparing two origins of resistance to brown spot disease in tobacco., 1997, 11(4): 1–6 (in Chinese with English abstract).
[35] 许绍斌, 陶玉芬, 杨昭庆, 褚嘉. 简单快速的DNA银染和胶保存方法. 遗传, 2002, 24: 335–336. Xu S B, Tao Y F, Yang Z Q, Chu J. A simple and rapid methods used for silver staining and gel preservation., 2002, 24: 335–336 (in Chinese with English abstract).
[36] Van Ooijen J W. JoinMap® 4.0, Software for the calculation of genetic linkage maps in experimental populations. Wageningen: Kyazma B.V Press, 2006. pp 1–63.
[37] Voorrips R E. MapChart: Software for the graphical presentation of linkage maps and QTLs., 2002, 93: 77–78.
[38] Van Ooijen J W. MapQTL® 6.0, Software for the mapping of quantitative trait loci in experimental populations of diploid species. Wageningen: Kyazma B V Press, 2009. pp 1–64.
[39] McCouch S R, Cho Y G, Yano M, Paul E, Blinstrub M, Morishima H, Kinoshita T. Report on QTL nomenclature., 1997, 14: 11–13.
[40] 冯莹, 蒋彩虹, 程立锐, 杨爱国, 郑吉云, 赵清海, 杨修峰, 尹华玲, 冯全福. 两个烟草赤星病抗源的遗传分析. 中国烟草科学, 2015, 36(5): 1–7. Feng Y, Jiang C H, Cheng L R, Yang A G, Zheng J Y, Zhao Q H, Yang X F, Yin H L, Feng Q F. Genetic analysis of resistance to brown spot disease in tobacco cultivars Jingyehuang and Beinhart1000-1., 2015, 36(5): 1–7 (in Chinese with English abstract).
Mapping of quantitative trait loci conferring resistance to brown spot in cigar tobacco cultivar Beinhart1000-1
TONG Zhi-Jun, ZHANG Yi-Han, CHEN Xue-Jun, ZENG Jian-Min, FANG Dun-Huang*, and XIAO Bing-Guang*
Yunnan Academy of Tobacco Agricultural Sciences / Key Laboratory of Tobacco Biotechnological Breeding / National Tobacco Genetic Engineering Research Center, Kunming 650021, Yunnan, China
Tobacco brown spot (TBS) caused byis one of the most destructive foliar diseases affecting tobacco (L) production and quality in China. Breeding TBS-resistant cultivars is difficult by traditional method because the resistance has proved to be quantitatively inherited. To facilitate marker-assisted selection, we carried out a study of mapping quantitative trait loci (QTLs) for TBS resistance. We developed an F2population consisting of 362 individuals from a cross between a TBS-susceptive flue-cured tobacco Honghua Dajinyuan (HD) and a TBS-resistant cigar tobacco cultivar Beinhart1000-1, and constructed a genetic map consisting of 670 SSR markers based on this population. Using disease index (DI) as the indicator of TBS resistance, we detected two QTLs located between SSR markers TMs05179 and TMs04022, and TM61049 and TM62212 on linkage group (LG) 20 and LG23, respectively. The resistant alleles of the two QTLs were all from the resistant parent Beinhart1000-1. The two QTLs together could explain 81% of the DI difference between the two parents in total, and 64% of their additive effects. Therefore, the two QTLs will be useful for TBS resistance breeding.
tobacco brown spot (TBS); simple sequence repeats (SSR); genetic linkage map; quantitative trait locus (QTL)
2018-03-05;
2018-12-24;
2019-01-05.
10.3724/SP.J.1006.2019.84035
方敦煌, E-mail: fdhkm@sina.com; 肖炳光, E-mail: xiaobg@263.net
E-mail: tzj861@163.com
本研究由云南省基础研究计划项目(2018FB064), 中国烟草总公司项目(110201601027(JY-01), 110201603008)和中国烟草总公司云南省公司项目(2017YN01, 2016YN23)资助。
This study was supported by the Fundamental Research Program of Yunnan Province (2018FB064), China National Tobacco Company (110201601027 (JY-01), 110201603008), and Yunnan Tobacco Company (2017YN01, 2016YN23).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20190103.0910.004.html
