耐碳青霉烯类肠杆菌科细菌对喹诺酮类耐药机制的研究
2019-03-14苏珊珊张吉生王宇超李慧玲张晓丽
苏珊珊,张吉生,王 英,王 勇,王宇超,李慧玲,张晓丽
(佳木斯大学附属第一医院检验科,黑龙江 佳木斯 154007)
大肠埃希菌、肺炎克雷伯菌和阴沟肠杆菌是耐碳青霉烯类肠杆菌(carbapenem-resistant Enterobacteriaceae, CRE)的主要分离菌株,引起较高的病死率并在全世界范围内流行,常对喹诺酮类药物表现出高度耐药性,已引起人们的关注[1]。喹诺酮类药物自20世纪60年代进入临床后,常被用来治疗由肠道细菌引起的严重感染,广泛和不恰当的使用导致耐药株的产生[2]。近年来,有关泛耐药肠杆菌对喹诺酮药物的耐药机制如降低药物对DNA回旋酶及拓扑异构酶Ⅳ的作用、外排泵上调和产生灭活酶等方面均有研究,而有关CRE对喹诺酮类药物耐药机制的研究还很少。故本研究探讨某院CRE对喹诺酮耐药基因的携带情况及耐药机制,为临床合理用药提供依据。
1 材料与方法
1.1 菌株来源 收集2015年3月—2018年3月住院患者分离出的非重复CRE,筛选标准为对亚胺培南、美罗培南或厄他培南中至少一种药物耐药者或携带有碳青霉烯酶的菌株。质控菌株为大肠埃希菌ATCC 25922。接合菌株为大肠埃希菌J53AZR(叠氮钠耐药)。
1.2 药物敏感试验 采用VITEK 2 Compact全自动微生物分析仪进行药敏试验,E-test试纸条复核左氧氟沙星,亚胺培南的药敏结果(E-test试纸条购自郑州安图生物公司),并用纸片扩散法复核厄他培南、美罗培南和环丙沙星的药敏结果(药敏纸片购自OXOID公司)。根据2016年美国临床实验室标准化协会(CLSI)标准进行药敏折点的判定。
1.3 喹诺酮耐药基因检测 采取煮沸法提取菌株模板DNA,PCR法扩增PMQR基因qnrA、qnrB、qnrS、qepA、acc(6’)Ib-cr,引物参照文献[3]设计,由上海生工生物有限公司合成。总反应体系25 μL:Go Taq Master Mix 12.5μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 1 μL,ddH2O 9.5 μL。扩增条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸60 s,共循环35次;72℃延伸10 min。扩增产物经1.5% 琼脂糖凝胶电泳后,用紫外凝胶成像与分析系统观察结果,目的产物送上海生工生物有限公司测序,结果在NCBI网站上运用BLAST比对基因型。
1.4 其他耐药基因检测 碳青霉烯酶耐药基因:KPC、NDM、IMP;β-内酰胺酶耐药基因:SHV、CTX-M-15,检测方法参照文献[4]。
1.5 质粒接合试验 选取大肠埃希菌J53AZR为受体菌,分别挑取单个菌落配制成0.5麦氏单位的菌悬液,取500 μL菌悬液加至4 mL LB肉汤培养基中混匀,放置摇床35℃ 180 r/min,振摇16 h。取40 μL J53AZR和160 μL供体菌于EP管中,高速离心4 000 rpm 5min,去上清再加入200 μL LB肉汤培养18 h,接种在含有亚胺培南(1 mg/L)和叠氮钠(100 mg/L)的麦康凯培养中培养18 h,选取生长的菌落进行鉴定,通过药敏试验、PCR检测耐药基因及测序确定接合菌耐药情况。
2 结果
2.1 菌株情况 2015年3月—2018年3月住院患者共分离出非重复的CRE 57株,其中肺炎克雷伯菌45株,大肠埃希菌5株,阴沟肠杆菌7株。

57株CRE中94.74%的菌株含有碳青霉烯酶KPC、NDM、IMP中的一种或多种,β-内酰胺酶基因SHV、CTX-M-15检出率为85.96%和80.70%。

表1 57株CRE对常见抗菌药物的耐药率(%)Table 1 Resistance rates of 57 CRE strains to common antimicrobial agents(%)
2.3 耐药基因检测结果 57株CRE中91.23%的菌株含有喹诺酮耐药基因,测序结果经Blast比对,其中acc(6’)Ib-cr分离率最高,为87.72%,其次为qnrB,分离率为77.19%,qnrS分离率为17.54%,共检出2株菌携带qnrA,分离率为3.51%,未分离出qepA基因。共检出84.21%的菌株同时含有2种或3种喹诺酮基因。基因检出情况见表2。CRKP、CRECO和CRECL中耐药株及敏感株携带PMQR基因情况比较,差异无统计学意义,见表3。阳性基因电泳图及测序结果见图1~2。
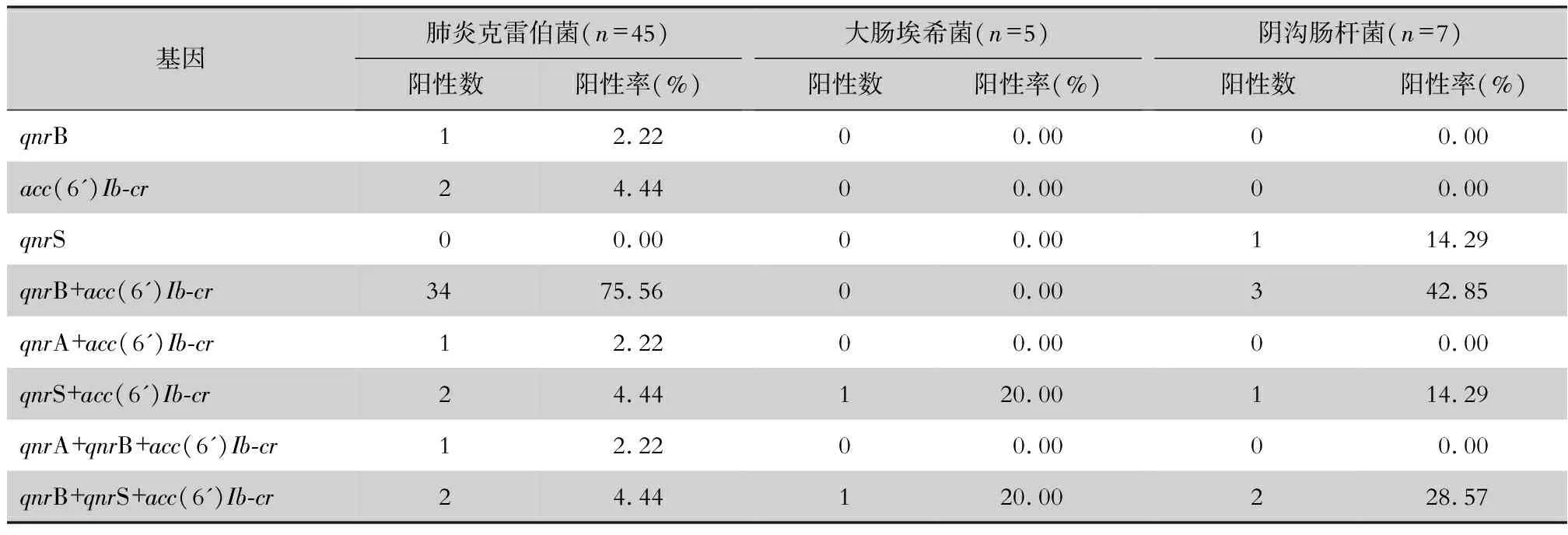
表2 57株CRE的PMQR基因检出情况(%)Table 2 Detection of PMQR genes in 57 CRE strains(%)

表3 57株CRE中耐药株与敏感株PMQR基因检出情况Table 3 Detection of PMQR genes in 57 CRE-resistant and susceptible strains
图1 PMQR阳性基因电泳图Figure 1 Electrophoresis map of PMQR positive genes
2.4 接合试验结果 57株CRE中有9株接合成功,其中肺炎克雷伯菌6株,大肠埃希菌2株,阴沟肠杆菌1株。除1株大肠埃希菌qnrB基因未转入,其余PMQR基因均成功转入8株接合子中,虽有1株接合子的左氧氟沙星MIC值发生改变,但9株接合子均对左氧氟沙星仍敏感。接合子MIC值见表4。
图2 PMQR阳性基因测序图Figure 2 Sequencing map of PMQR positive genes

表4 接合子耐药基因检出情况及抗菌药物MIC值(mg/L)Table 4 Detection of resistance genes of transconjugants and MIC values of antimicrobial agents(mg/L)
3 讨论
喹诺酮类药物为人工合成的抗菌药物,因其抗菌谱广、体内分布广、不良反应少被临床广泛应用于抗感染,其作用靶点为革兰阴性菌DNA回旋酶及拓扑异构酶Ⅳ,结合后形成“喹诺酮-酶-DNA”三元复合物,破坏细菌DNA结构抑制其复制[5]。随着临床越来越多的应用该类药物,2016年CHINT耐药监测数据显示,我国大肠埃希菌对喹诺酮类药物的耐药率为52.9%,黑龙江省更高达60.1%,故引起我们对喹诺酮耐药机制的研究[6]。
1998年美国在1例肺炎克雷伯菌中首次发现PMQR基因被命名为qnrA,随后qnrB、qnrC、qnrS接连被报道[7]。qnr基因因其能够编码Qnr蛋白,保护细菌DNA促旋酶及拓扑异构酶介导耐药而引起人们的关注。喹诺酮耐药机制还包括acc(6’)Ib-cr介导的灭活酶产生,qepA介导的细菌外排泵上调以及gyrA和parC引起的外膜通透性的改变,通过使药物敏感性下降和难以进入细菌内部的共同作用导致细菌对喹诺酮类药物耐药[8]。
CRE自发现以来的几十年间迅速在全球多个国家及地区广泛流行,因其仅对替加环素和多粘菌素敏感,临床几乎无药可用。细菌对碳青霉烯类抗生素耐药往往也表现对喹诺酮类药物耐药,有报道[9]产KPC-2型CRKP对喹诺酮药物耐药主要为gyrA和parC基因发生突变。本研究CRE中PMQR的检出率为91.23%,其中acc(6’)Ib-cr基因为肠杆菌中携带率最高的基因,可能是导致对喹诺酮类耐药最主要的原因,与阮荣华等[10]的报道一致,其也可能导致了本研究中收集菌株对庆大霉素、妥布霉素的高水平耐药[7]。有研究[9]发现,CRE对喹诺酮类药物耐药还可能是染色体介导的。其次为qnrB(77.19%)、qnrS(17.54%)和qnrA(3.51%)基因,其检出率分布与台湾报道的阴沟肠杆菌相似,但检出率均高于该报道[11]。本试验未检出qepA基因,说明该院喹诺酮耐药机制与细菌外排泵的上调无直接相关性。共检出84.21%的菌株同时含有2种或3种喹诺酮基因,说明该院CRE携带高水平的PMQR基因。
CRKP中acc(6’)Ib-cr检出率为93.33%,qnrB检出率为84.44%,同时携带这两种基因的菌株为82.22%,并且有3株菌同时携带3种PMQR基因。在CRKP中检出2株qnrA基因,但在大肠埃希菌和阴沟肠杆菌中未检出此基因,验证了qnrA易在肺炎克雷伯菌中携带的结论[12]。该院CRKP对喹诺酮药物的非敏感率为84.43%,对左氧氟沙星的非敏感率为17.78%,此结果可能与PMQR基因仅赋予低水平的喹诺酮类药物耐药性有关[2, 13],由于CRKP还携带了KPC、SHV、CTX-M-15基因,可能使PMQR基因表达水平受影响。
CRECO对喹诺酮药物的耐药性比CRKP及CRECL高,与报道[14]结果相似。本研究发现,CRECO均对喹诺酮药物耐药,但有3株菌并未检出PMQR基因,此现象也可能与其他耐药机制如染色体的突变导致喹诺酮药物高水平耐药相关。提示临床不应选用喹诺酮类药物治疗CRECO引起的感染。
7株CRECL存在6株携带多种PMQR基因的现象,主要为qnrB、qnrS与acc(6’)Ib-cr组合,对喹诺酮类药物的耐药性与Peymani等[2]的报道一致。研究发现许多产ESBLs的分离株对氨基糖苷类和氟喹诺酮类药物具有耐药性[15],该院阴沟肠杆菌携带金属β-内酰胺酶NDM、IMP并伴有SHV、CTX-M-15存在,多种耐药机制导致对喹诺酮类药物耐药。
本次试验共有9株菌接合成功,除1株大肠埃希菌qnrB基因未转入,另一株大肠埃希菌未携带PMQR基因,其余菌株PMQR基因均成功转入到接合子中,但接合子中对左氧氟沙星MIC值只有一株明显的改变,与其他研究结果有一定的差异[7,16]。编码碳青霉烯酶的基因通常位于携带喹诺酮和氨基糖苷类耐药基因的大质粒上,所以在接合子中存在PMQR基因和碳青霉烯酶共同转移的情况,在对碳青霉烯类药物耐药性下降的情况下,可能存在PMQR基因,但是其并未表达,从而导致接合子耐药水平不变。在本研究中接合成功菌株并未表达出对喹诺酮药物的耐药现象,但是否存在应用喹诺酮类抗菌药物后引起喹诺酮类耐药基因高水平的表达从而导致耐药情况,需要进一步研究。另外PMQR基因的水平传播仍需要引起医院的重视,并采取相应控制措施。
综上所述,该院CRE携带高水平PMQR基因导致喹诺酮药物的低水平耐药,证实PMQR基因作用较弱,而其他耐药机制对其耐药的产生起到了关键作用。但PMQR基因的高携带率是个不容忽视的问题,在临床喹诺酮类药物大量使用,抗菌药物选择压力下,PMQR基因表达可能增强,并通过质粒在细菌之间进行传播,导致喹诺酮类抗菌药物高水平耐药。医院应长期对PMQR基因流行情况进行监测,并指导临床医生遵循喹诺酮类抗菌药物使用适应证及专家共识,减少耐药菌的产生。
