miR-219-5p, miR-19b-1和miR-25在骨肉瘤患者血清中的表达以及与肺转移的关系
2019-03-13吉亚红李晓利
牛 敏,吉亚红,李晓利,晁 杲
西安交通大学医学院附属红会医院 消化内科(西安 710054)
骨肉瘤(osteosarcoma, OS)是最常见的原发性恶性骨肿瘤,在所有儿童患者中占骨肿瘤的55%[1-2]。近40年来,由于联合化疗手术的使用,使得OS的存活率提高了65%左右[3-4]。OS最常见的转移为肺转移,其转移的时间对存活率有明显影响。诊断时确定为转移瘤的5年存活率为18%,而术前或术后发现为转移瘤的5年存活率仅有0%和6%[5]。也就是说,及早对转移性OS的确诊可以明显提高其生存率。然而到目前为止,还没有发现敏感和特异性的非侵入性诊断生物标志物来区分转移性OS和非转移性OS之间的差异。
外周血中游离的miRNA作为生物标志物具有很好的应用前景[6]。它们在体液中很容易被分离和检测,其化学结构简单且稳定,并在物种间高度保守,以组织特异性方式表达[7]。越来越多的报道[8]显示,miRNA可作为稳定的外周肿瘤标记物,如在乳腺癌中,具有淋巴结转移的乳腺癌患者血清miR-10b和miR-373水平明显高于未转移的乳腺癌患者,表明它们可用作乳腺癌淋巴转移的生物标志物。在胃癌中,血清中miR-203水平提示其可能是转移、复发和预后的生物标记因子[9]。有研究[10]显示,5种血清miRNA(-16、-25、-92a、-451和-486-5p)可能作为胃癌早期转移阶段的潜在生物标志物。miR-21、-29a、-25、-200a和-486-5p可以作为宫颈癌的生物标志物[11]。这些研究均表明了外周血中游离miRNA具有作为癌症检测和预测的潜力分子。
本研究通过探寻OS患者肺转移前后外周血中miRNA的差异表达,筛选有助于预测和监测肺转移的潜在的miRNA分子。
1 资料与方法
1.1 临床资料
选取2017年4月至2018年4月来自西安交通大学医学院附属红会医院肿瘤外科、西安交通大学第一附属医院肿瘤外科和西安交通大学第二附属医院肿瘤外科诊断入院患者。所有样品的收集和试验均得到西安交通大学医学院伦理审查委员会批准并取得病患知情同意书。所有参与本研究的作者和试验人员均阅读了世界医学协会的道德规范赫尔辛基宣言并严格遵守。按中国临床肿瘤学会(CSCO)经典型OS诊疗指南(2018),纳入病例资料完整的OS患者,选择确诊并尚未经规范化综合治疗(包括术前化疗、术后化疗和手术)的88例患者作为本试验的研究对象。所有患者入院后均行肺部 CT以评估是否发生肺转移。其中,41例OS患者初诊前就发生肺转移侵袭,作为OS肺转组,47例OS患者确诊但未发生肺转移,作为对照组。患者6~64岁,平均23.2岁,男女比例约1.5∶1,对年龄、性别、病程、常规体格检查等一般资料进行比较,经秩和检验分析显示,差异无统计学意义(P>0.05),两组具有可比性。一旦确诊为OS,其血液样本都被收集并储存在-80 ℃直至进一步处理。
1.2 miRNA微矩阵芯片
使用miRNA微矩阵芯片预筛选OS未转移(n=6)和OS肺转移(n=6)的静脉血浆样品之间的miRNA差异。由于miRNA的组织特异性,将符合以下特征的miRNA作为预选制作miRNA微矩阵,为小规模预筛定制芯片:在OS中明显上调的miRNA[12],在外周血中可检测到的miRNA[13],参与OS发生的miRNA[14]。使用0.22 μm滤过器将250 μL静脉血血浆样本进行过滤。使用RNAeasyTM小RNA提取试剂盒(碧云天生物科技公司,上海)提取细胞中总miRNA。总miRNA使用miRCURYTM power labeling kit(Exiqon,丹麦)标记并杂交至miRCURY LNA微RNA阵列上(Exiqon,丹麦)。用Axon GenePix 4000B微阵列扫描仪(Moleculardevices,美国)扫描后使用Agilent Feature Extraction v10.7软件提取数据。使用GeneSpring GX v11.5.1对原始数据进行归一化,用Image GP软件制作散点火山图表现差异表达的miRNA。用MeV4.9软件制作热图来显示差异表达最明显的30个mRNA及miRNA分子。
1.3 实时荧光定量PCR
qPCR检测所有OS病人在RNA微矩阵预筛选的结果中表达最明显的6个miRNA在血浆中的表达水平。使用RNAeasyTM小RNA提取试剂盒提取细胞中总miRNA。通用miRCURYcDNA合成试剂盒(Exiqon.Inc.,丹麦)用于合成第1链cDNA。在PTC-100热循环仪(Bio-Rad,Inc.,美国)上进行逆转录(逆转录条件:42 ℃,60 min;85 ℃,5 min。 所得的单链cDNA 置于-20 ℃保存)。将4 μL cDNA(在无核酸酶的水中以1∶20稀释)模板用于qPCR反应,加入5 μL PCR SYBR绿色荧光探针和1 μL特异性PCR引物(Exiqon)组成10 μL 反应体系。ABI StepOnePlus实时PCR系统(ThermoFisher Scientific,Inc.,美国)用于miRNA的定量检测(反应条件:预变性90 ℃,10 min;变性90 ℃,10 S,退火57 ℃,20 s,延伸72 ℃,10 S,40循环数)。引物序列如下表所示(表1),U6表达作为内参。

表1 stem-loop RT-PCR及qPCR检测miRNA所需引物序列
1.4 统计学方法

2 结果
2.1 与OS肺转移相关的miRNA预筛选
对12例患者(6例OS肺转移)进行miRNA差异表达的预筛选,在检测共计95个miRNA中,相比于未转移组OS,肺转移组OS有24个miRNA明显上调(改变倍数>1.5,P<0.01),23个miRNA明显下调(改变倍数<0.5,P<0.01)(图1A)。将30个上调及下调最明显的miRNA制作热图,相比于未转移OS患者,OS肺转移患者血清中miRNA的表达水平发生明显变化(图1B)。

图1RNA微阵列芯片筛选与OS转移相关的miRNA
注:A:95个预筛选miRNA的火山图(横坐标为肺转移对比未转移的miRNA表达量的相对倍数的Log值,纵坐标为-Log2);B:30个差异表达最明显的miRNA表达值经归一化法处理后制作热图,蓝色表示低表达miRNA,红色表示高表达miRNA
2.2 miRNA在肺转OS肺转移患者血清中的差异表达
qPCR检查所有OS患者血清miRNA水平,和微阵列芯片结果一致,miR-219-5p、miR-19b-1及miR-151-3p在OS肺转移患者的外周血浆中相对于未转移OS对照组明显提高(P<0.05)。而miR-32、 miR-363和miR-25在OS肺转移患者的外周血中相比于未转移OS对照组明显下调(P<0.05)。这些结果提示,miR-219-5p、miR-19b-1、miR-151-3p、 miR-32、miR-363和miR-25可能是调控OS肺转移的关键因子(图2)。

图2qPCR检测与OS转移相关的miRNA
注:A:qPCE检测OS患者及肺转移患者血清中miR-219-5p的相对表达水平;B:OS患者及肺转移患者血清中miR-19p-1的相对表达水平;C:OS患者及肺转移患者血清中miR-151-3p的相对表达水平;D:OS患者及肺转移患者血清中miR-32的相对表达水平;E:OS患者及肺转移患者血清中miR-363的相对表达水平;F:OS患者及肺转移患者血清中miR-25的相对表达水平
2.3 差异血清miRNA与OS肺转移的相关性
分别将血清miR-219-5p、 miR-19b-1、miR-151-3p、 miR-32、 miR-363和miR-25纳入二元Logistic回归分析的因变量中,肺转移作为自变量。单独使用miR-219-5p、miR-19b-1、miR-151-3p、miR-32、miR-363和miR-25对OS肺转移的预测率分别为71%(R=0.223,P=0.017)、63.2%(R=0.071,P=0.015)、 68.4%(R=0.100,P=0.300)、 71.1%(R=0.244,P=0.054)、77.6%(R=0.085,P=0.073)和84.2%(R=0.477,P< 0.001)。这些数据显示,血清miR-219-5p、 miR-19b-1和miR-25作为独立危险因素提示OS的肺转移的发生(图3)。
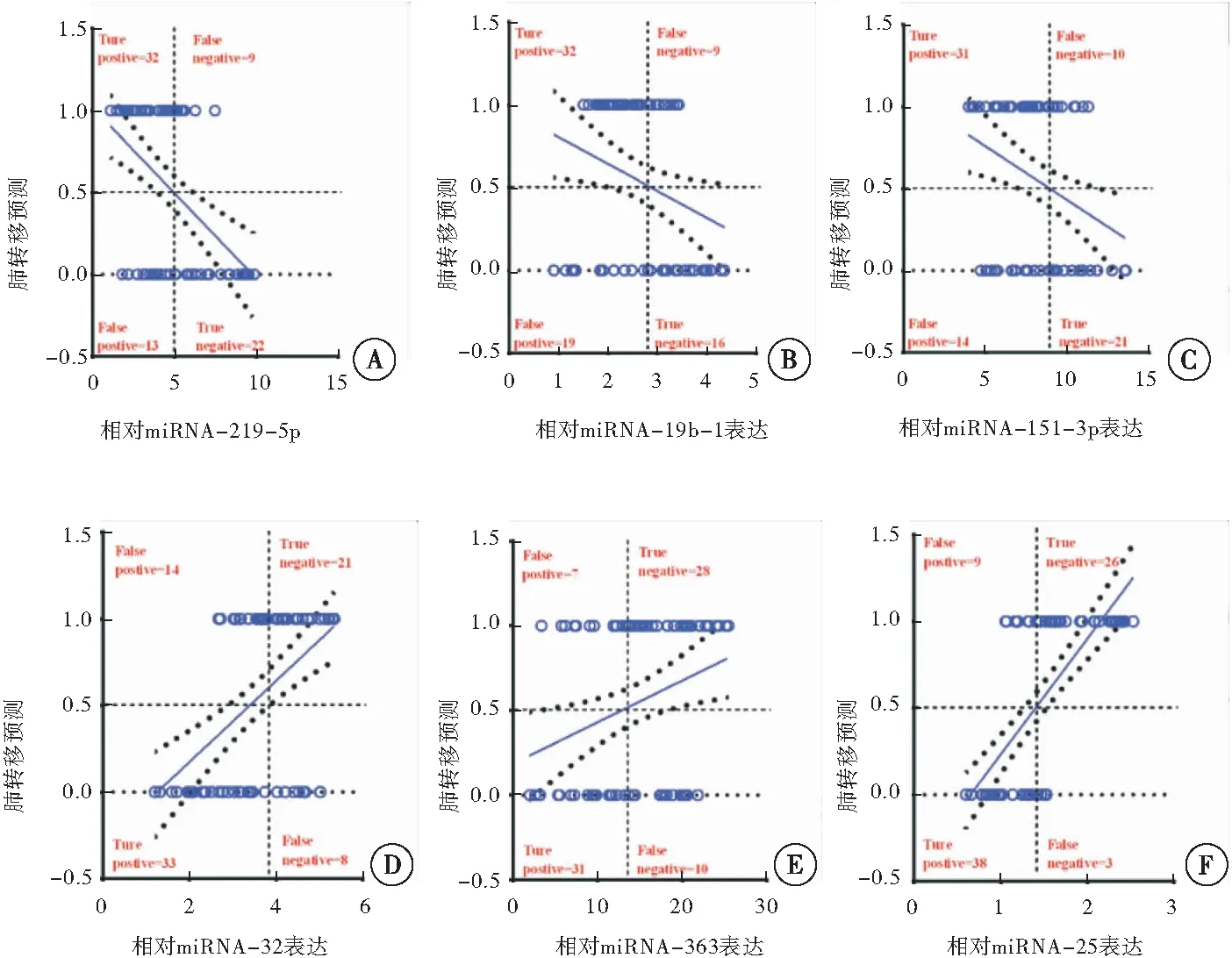
图3 Logistic回归分析预测OS肺转移的发生
注:A:OS患者血清miR-219-5p与OS肺转移的相关性分析;B:OS患者血清miR-19b-1与OS肺转移的相关性分析;C:OS患者血清miR-151-3p与OS肺转移的相关性分析;D:OS患者血清miR-32与OS肺转移的相关性分析;E:OS患者血清miR-363与OS肺转移的相关性分析;F:OS患者血清miR-25与OS肺转移的相关性分析
3 讨论
OS患者死亡的主要原因是骨癌细胞发生肺部转移,因而较为迫切的需要良好的非侵入性生物学指标来实时监测并提示OS转移和复发的风险,从而改善OS患者的临床护理和治疗效能。miRNA可以在患者的各种体液中被检测出来,如外周血、脑脊液和淋巴液。由于循环系统和各器官组织的物质交换,可以间接反映病灶的分子生化改变,且具有侵入性小等优点,使得外周血成为极为优秀的生物检材[15]。外周血中的miRNA可以稳定结合在蛋白或者包被于外囊泡中,可作为潜在的生物标记物来增加各种疾病的诊断性能[16]。
本研究中,报道了6例被确诊了的OS患者和已经发生肺转移的OS患者外周血中miRNA的表达性差异,试图寻找与OS肺转移发生的关键miRNA分子。miRNA微矩阵芯片结果显示,在95个预检测的miRNA中,有47个miRNA发生了明显上调或下调,表明这些miRNA在OS肺转移过程中存在可能的调控作用。已有研究[17]利用预选miRNAs微矩阵序列芯片,将OS外周血miRNA用作OS诊断或预后的生物学指标,如筛选与OS发病相关的miRNA,包括miR-21、 miR-199a-3p、 miR-107、miR-335和miR-374a-5p在OS患者的血清中明显上调,具有潜在的OS诊断潜能。在术后患者的血清miRNA中,有4个miRNAs (miR-195-5p、miR-199a-3p、miR-320a和 miR-374a-5p)明显上调,且与预后成正比,表明这些miRNA可作为OS术后判断预后的指标[18]。然而,还很少有研究观察OS肺转移和未转移OS患者外周血中的miRNA差异表达。
本研究对在miRNA芯片中高度差异的6个miRNA进行qPCR检测,包括明显上调的miR-219-5p、miR-19b-1及miR-151-3p以及明显下调miR-32、 miR-363和miR-25。相对于41例OS未转移的患者,35例发生肺转移的OS患者外周血中miR-219-5p、miR-19b-1及miR-151-3p均明显上调,而miR-32、miR-363和miR-25则明显下调。这些差异性表达的miRNA可能直接参与OS肺转移的病理进程。Logistic模型常被用于生物学指标对疾病诊断性能的预测[19]。虽然这6个miRNA均表现出明显差异,然而只有miR-219-5p、miR-19b-1和miR-25(P<0.05)可以有效区分OS患者和OS肺转移患者,即在OS患者外周中检测到上调的miR-219-5p和miR-19b-1或下调的miR-25具有较差的肺转移预后。这些研究提示在初次诊断OS患者时,要对血清miR-219-5p、miR-19b-1上调或miR-25下调的OS患者格外关注,因其具有极大的肺转移风险(或可能已经发生肺转移)。
综上所述,本研究筛选和验证了OS患者血清miR-219-5p、miR-19b-1和miR-25可以作为潜在的非侵入性生物标志物,以监测OS的发生和肺转移。然而,这些差异miRNA分子在OS肺转移所扮演的角色还需要进一步研究。
