霉酚酸酯对阿霉素肾病大鼠的保护作用及其机制研究*
2019-03-05王兴白明辉季佳邹艳红杨菲邓李玲范琳博刘瑶邱迪刘秋红
王兴 ,白明辉 ,季佳 ,邹艳红 ,杨菲 ,邓李玲 ,范琳博,刘瑶,邱迪,刘秋红
(1.齐齐哈尔医学院附属第三医院 儿科,黑龙江 齐齐哈尔 161000;2.齐齐哈尔医学院附属第三医院 口腔科,黑龙江 齐齐哈尔 161000;3.佳木斯大学附属第一医院 儿科,黑龙江 佳木斯 154002)
霉酚酸酯(mycophenolatemofeitil, MMF)是临床上治疗肾病综合征(nephrotic syndrome, NS)的常用药物[1-3]。大量研究证实,足细胞不可逆损伤是NS患者出现蛋白尿的主要机制之一,因此修复和保护足细胞是阻止肾功能恶化的主要策略[4]。microRNAs(miRNAs)在多种肾疾病发生、发展过程中扮演重要角色[5]。寻找MMF靶向调控的miRNAs分子对明确MMF的作用机制具有重要临床意义。笔者首先采用基因芯片技术,筛选与NS密切相关的miRNAs作为候选标志物,并通过探讨MMF对阿霉素肾病(adriamycin nephropathy, ADN)大鼠模型足细胞的保护作用,以及对肾组织miRNAs的影响,阐明MMF的作用机制。
1 材料与方法
1.1 实验动物
60只6~8周龄成年健康SPF级Sprague-Dawley(SD)大鼠购自广州医药研究总院有限公司,动物许可证号:SYXK(粤)2013-0003。体重180~220 g,平均(192.46±6.13)g。将大鼠分笼饲养,3或4只/笼,喂以标准饲料及消毒的自来水,自由活动与进食、进水,保证动物房内安静、清洁、通风,温度控制在(22±1)℃。
1.2 受试药物与主要试剂
注射用盐酸多柔比星(阿霉素)(浙江海正药业股份有限公司),MMF(上海罗氏制药有限公司),PCR引物由上海生工生物工程有限公司合成并提供,miRelute miRNA 提取分离试剂盒、RT Reagent Kit、cDNA合成试剂盒、SYBR实时荧光定量聚合酶链反 应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒购自日本TaKaRa公司,组织蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、DAB显色试剂盒、TUNEL染色试剂盒购自北京天根科技生化有限公司,Trizol(美国Invitrogen公司),DEPC(美国Sigma公司),兔抗鼠Nephrin单克隆抗体、ZO-1兔抗鼠多克隆抗体、Podoplanin兔抗鼠多克隆抗体购自美国Abcam公司,辣根过氧化物酶标记二抗(北京中杉金桥生物科技有限公司)。
1.3 主要仪器
Eppendorf 5427 R 台式高速冷冻离心机、各种型号的移液器购自德国Eppendorf公司,CFX-96-C1000 qRT-PCR 仪、miRNA PCR Array Data Analysis Software、iMake多功能酶标仪、SDS-PAGE电泳仪及电转膜仪购自美国Bio Rad公司,CX41倒置光学显微镜(日本Olympus公司),AUW120电子分析天平(日本岛津公司),Amersham电泳仪(瑞典Bioscience公司),LAS-4000 min凝胶成像数码分析系统(日本FUJIFILM公司)。
1.4 动物模型的复制与分组
经过为期1周的适应性饲养后,称量并记录大鼠体重,按照随机数字表法,将60只SD大鼠随机分为空白对照组(CTL组)、ADN模型组(ADN组)和MMF干预组(MMF组),每组20只。ADN组和MMF组大鼠都属于ADN模型,笔者按照参考文献[6]的方法,一次性尾静脉注射6.5 mg/kg阿霉素溶液(0.2%)复制ADN模型;而CTL组大鼠以同样的方式注射生理盐水作为对照。1周后收集大鼠24 h尿液,测定24 h 尿蛋白量,尿蛋白 >30 mg/24 h 则表示模型复制成功。最终,ADN组和MMF组分别有18和19只大鼠模型复制成功,用于后续实验。
1.5 药物干预
每日观察受试大鼠进食、排便、活动、精神状况等,称重1次/d。根据动物体重计算当日给药量。CTL组和ADN组:每天灌胃无菌生理盐水,1 ml/100 g,1 次 /d,连续给药 28 d。MMF 组:每天灌胃 1% MMF 溶液,20 mg/kg,1 次 /d,连续给药 28 d。
1.6 标本采集与检测
1.6.1 肾功能 给药第 0、7、14、21 和 28 天时,用代谢笼采集大鼠24 h尿液,检测尿蛋白。实验结束时,经尾静脉采集外周血3 ml,置于枸橼酸钠真空采集管中,检测各组大鼠血尿素氮(blood urea nitrogen,BUN)、血清肌酐(serum creatinine, Scr)水平。
1.6.2 肾组织病理学检查 待实验结束时,将大鼠颈椎脱臼处死,取出肾组织,用10%甲醛固定,包埋成蜡块。脱蜡水化后,用石蜡切片机切片,厚约2μm,置于载玻片上。烘干48 h后,进行HE、PAS或Masson染色,观察肾组织病理学变化。
1.6.3 大鼠肾脏细胞凋亡情况 按照 TUNEL 染色试剂盒说明书进行操作,置于光学倒置显微镜下观察肾组织细胞凋亡情况。
1.6.4 大鼠肾组织 miRNAs芯片分析 取大鼠肾组织提取总RNA:取100 mg组织样本置于EP管中,加入MZ裂解液,按照miRelute miRNA提取分离试剂盒说明书步骤进行操作;采用凝胶电泳检测RNA分子量,分光光度计检测RNA浓度。测定浓度和纯度后进行miRNAs芯片分析,后续操作委托上海康成生物工程有限公司完成。
1.6.5 肾组织 miRNAs ①提取肾组织总 RNA:实验方法同1.6.4。②RNA逆转录:根据逆转录试剂盒说明书操作进行。将cDNA保存至-20℃备用。③qRT-PCR:按照三步法进行PCR扩增。以组织cDNA为模板,以β-actin为内参,将20μl反应体系置于 37℃恒温水浴 60 min,85℃、5 s,加入去离子水至100μl,各反应孔取2μl进行PCR。冰浴中配制 20μl PCR 反应体系,反应条件:95℃预变性 30 s,95℃变性 5 s,60℃退火 30 s,共 45 个循环。根据NCBI数据库获得的资料设计引物,引物由上海生工生物工程有限公司合成并提供。PCR结果判断:根据使用说明调整基线,将阈值设定在荧光值对数图的线性部分,从软件中读取Ct值。
1.7 统计学方法
数据分析采用SPSS 17.0统计学软件。计量资料以(±s)表示,多组比较用单因素方差分析或重复测量设计的方差分析,两两比较用LSD-t检验,方差不齐则采用Kruskal-Wallis非参数检验。采用Pearson相关性分析miRNAs与尿蛋白的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况及体重变化
实验过程中,CTL组大鼠饮食和活动正常;ADN组大鼠出现食欲减退、水肿、脱毛等情况,甚至有2只大鼠出现明显的腹水;与CTL组大鼠相比,MMF组大鼠虽然也存在食欲减退、生长迟缓的情况,但是较ADN组大鼠轻。比较3组大鼠给药后0、7、14、21和28 d的体重变化,采用重复测量设计的方差分析,结果:①不同时间点的大鼠体重比较,差异有统计学意义(F=243.451,P=0.000);②3组大鼠体重比较,差异有统计学意义(F=28.752,P=0.000);③ 3组大鼠体重变化趋势比较,差异有统计学意义(F=11.594,P=0.000)。进一步两两比较经LSD-t检验,自给药7 d起,ADN组和MMF组大鼠体重低于CTL组大鼠(P<0.05);同时MMF组大鼠平均体重高于AND组(P<0.05)。见表 1 和图 1。
2.2 各组大鼠尿蛋白的变化
3组大鼠尿蛋白含量比较,采用重复测量设计的方差分析,结果:①不同时间点尿蛋白含量比较,差异有统计学意义(F=735.62,P=0.000);② 3组大鼠尿蛋白含量比较,差异有统计学意义(F=28.769,P=0.000);③3组大鼠的尿蛋白含量变化趋势比较,差异有统计学意义(F=54.678,P=0.000)。进一步两两比较经LSD-t检验,给药当天,ADN组和MMF组大鼠尿蛋白含量高于CTL组(P<0.05);ADN组和MMF组大鼠尿蛋白含量比较,差异无统计学意义(P>0.05);但是自给药7 d后,虽然MMF组大鼠尿蛋白含量仍然高于CTL组,但是低于ADN组(P<0.05)。见表2和图2。
表1 各组大鼠不同时间点的体重比较 (g,±s)
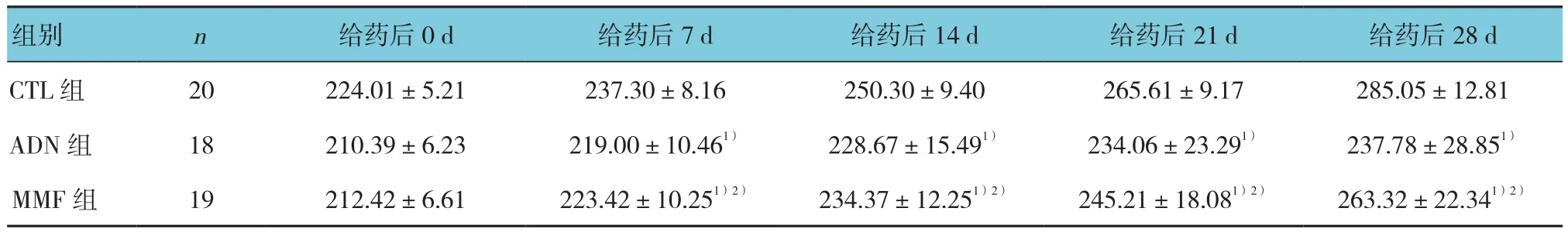
表1 各组大鼠不同时间点的体重比较 (g,±s)
注:1)与CTL组比较,P<0.05;2)与ADN 组比较,P<0.05
组别 n 给药后0 d 给药后7 d 给药后14 d 给药后21 d 给药后28 d CTL 组 20 224.01±5.21 237.30±8.16 250.30±9.40 265.61±9.17 285.05±12.81 ADN组 18 210.39±6.23 219.00±10.461) 228.67±15.491) 234.06±23.291) 237.78±28.851)MMF 组 19 212.42±6.61 223.42±10.251)2) 234.37±12.251)2) 245.21±18.081)2) 263.32±22.341)2)
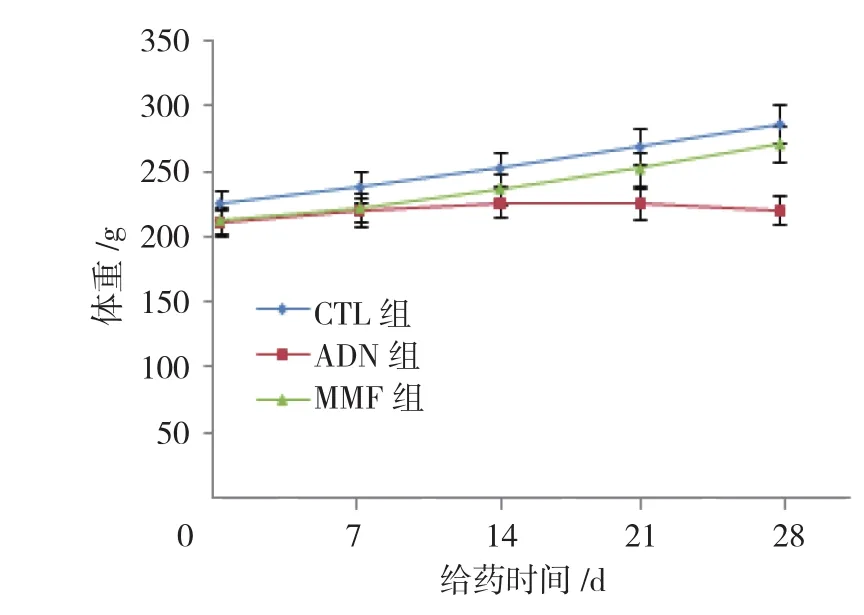
图1 各组大鼠体重变化趋势 (±s)
表2 各组大鼠不同时间点的尿蛋白比较 (mg/24 h,±s)
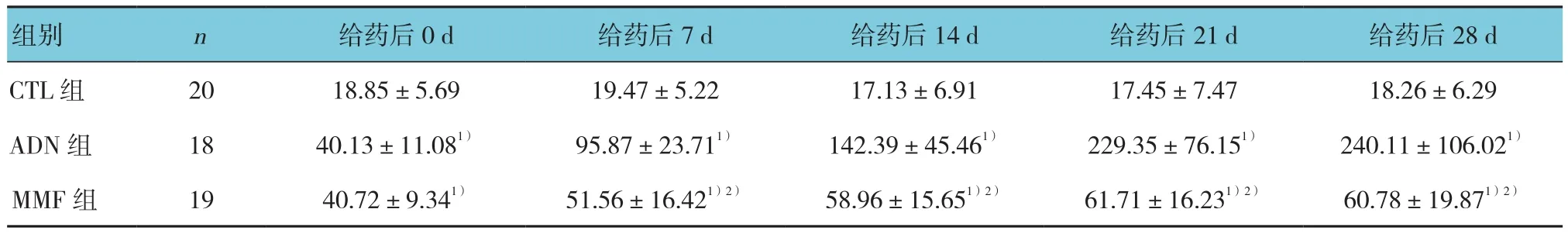
表2 各组大鼠不同时间点的尿蛋白比较 (mg/24 h,±s)
注:1)与CTL组比较,P<0.05;2)与ADN 组比较,P<0.05
组别 n 给药后0 d 给药后7 d 给药后14 d 给药后21 d 给药后28 d CTL 组 20 18.85±5.69 19.47±5.22 17.13±6.91 17.45±7.47 18.26±6.29 ADN 组 18 40.13±11.081) 95.87±23.711) 142.39±45.461) 229.35±76.151) 240.11±106.021)MMF 组 19 40.72±9.341) 51.56±16.421)2) 58.96±15.651)2) 61.71±16.231)2) 60.78±19.871)2)
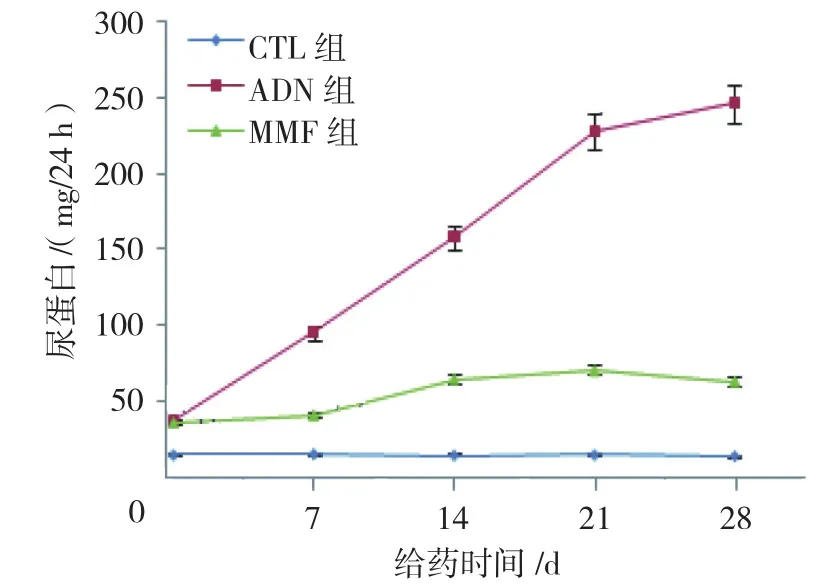
图2 各组大鼠尿蛋白变化趋势 (±s)
2.3 各组大鼠生化指标比较
实验结束时,3组大鼠外周血BUN和Scr水平比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,ADN组、MMF组大鼠血清BUN和Scr含量高于CTL组(P<0.05);与ADN组比较,MMF组大鼠血清BUN和Scr含量降低(P<0.05)。见表 3。
表3 各组大鼠生化指标比较 (±s)
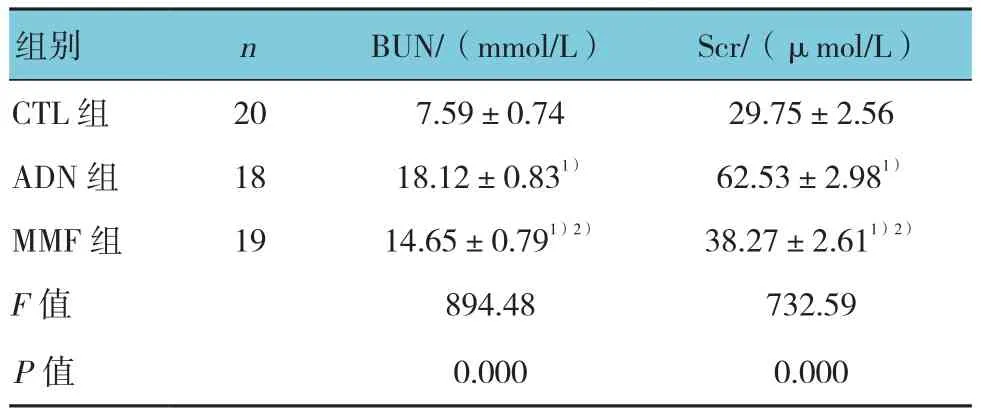
表3 各组大鼠生化指标比较 (±s)
注:1)与CTL 组比较,P<0.05;2)与ADN组比较,P<0.05
组别 n BUN/(mmol/L) Scr/(μmol/L)CTL组 20 7.59±0.74 29.75±2.56 ADN组 18 18.12±0.831) 62.53±2.981)MMF 组 19 14.65±0.791)2) 38.27±2.611)2)F值 894.48 732.59 P值 0.000 0.000
2.4 各组大鼠肾组织病理学变化
光镜下观察CTL组大鼠肾小球形态基本正常,未见系膜增生,上皮细胞足突清晰可见;而ADN组大鼠肾小球肥大,系膜细胞增生,上皮细胞足突广泛融合,毛细管腔狭窄,间质出现轻、中度纤维化;MMF组大鼠肾小球变化较ADN组轻,但是与CTL组比较,仍可见明显差异。见图3。
2.5 各组大鼠肾组织细胞凋亡情况
TUNEL荧光染色定位于细胞核。CTL组、ADN组、MMF组大鼠肾组织细胞凋亡率分别为(3.56±1.32)%、(31.75±6.44)%和(14.73±5.18)%,经单因素方差分析,差异有统计学意义(F=172.608,P=0.000)。进一步两两比较经LSD-t检验,ADN组大鼠肾组织细胞凋亡率高于CTL组(P<0.05);MMF组大鼠肾组织细胞凋亡率虽然高于CTL组(P<0.05),但是低于ADN组(P<0.05)。见图 4、5。
2.6 各组大鼠肾组织miRNAs芯片分析结果
采用GenePix Pro 6.0读取芯片扫描结果,提取探针信号值,将相同的探针值中值合并,对芯片结果进行中值标准化,筛选差异表达的miRNAs(Fold>1.5且P<0.05)。各组芯片之间信号强度相关性分析:CTL组与ADN组的相关系数为0.715,ADN组与MMF组的相关系数为0.632,CTL组与MMF组的相关系数为0.979。与CTL组相比,ADN组主要有19个miRNAs表达上调,23个miRNAs表达下调。与ADN组相比,MMF组主要有7个miRNAs表达上调,8个miRNAs表达下调。其中,相较于CTL组,ADN组大鼠肾组织中rno-miR-23a和rno-miR-300-3p表达上调,rnomiR-24、rno-miR-300-3c表达下调,而与ADN组相比,MMF组大鼠肾组织中rno-miR-24、rno-miR-300-3c表达上调,rno-miR-23a和rno-miR-300-3p表达下调。见图6。
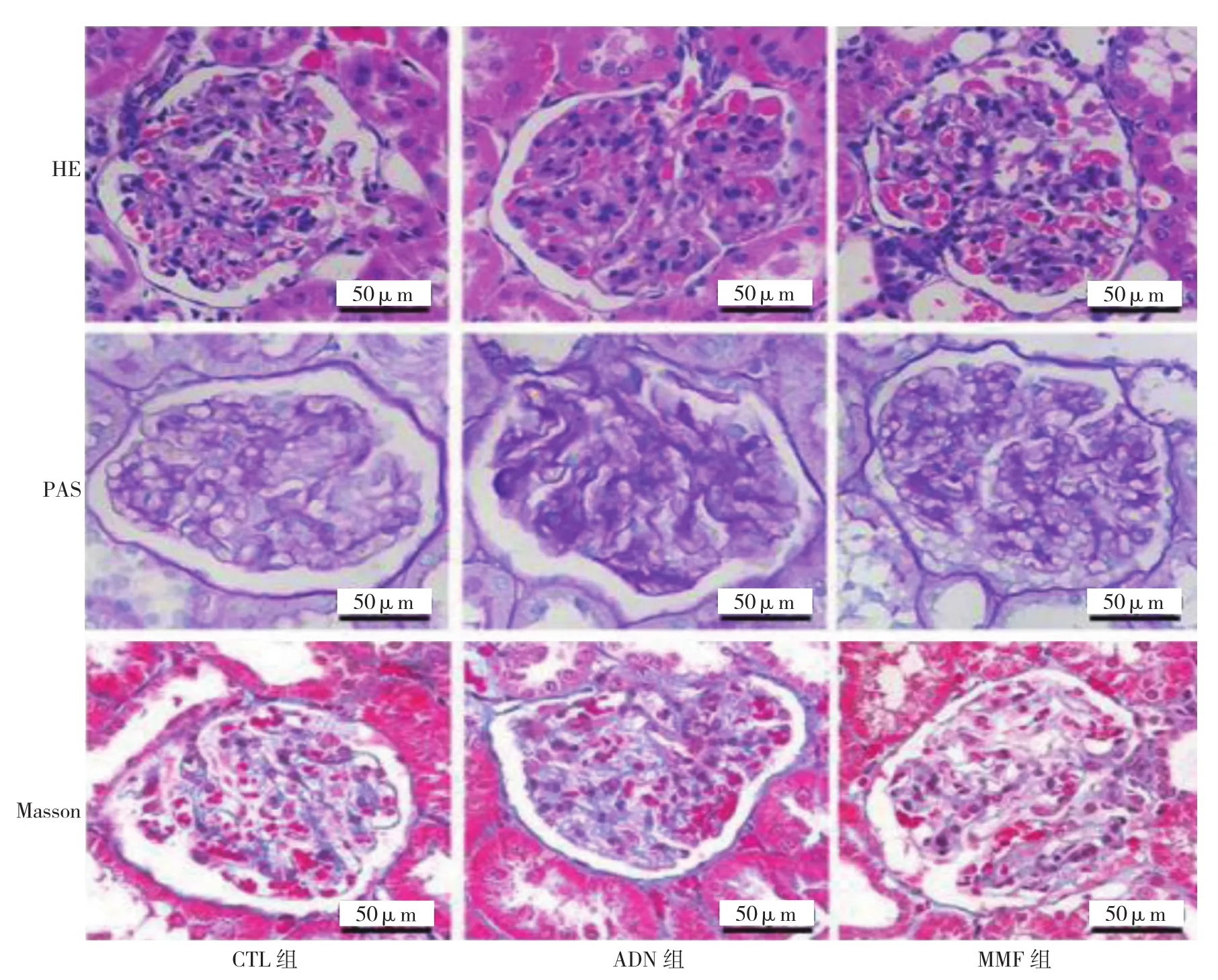
图3 各组大鼠肾组织病理学变化
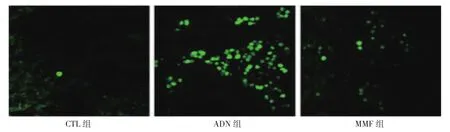
图4 各组大鼠肾组织细胞凋亡情况 (TUNEL×400)
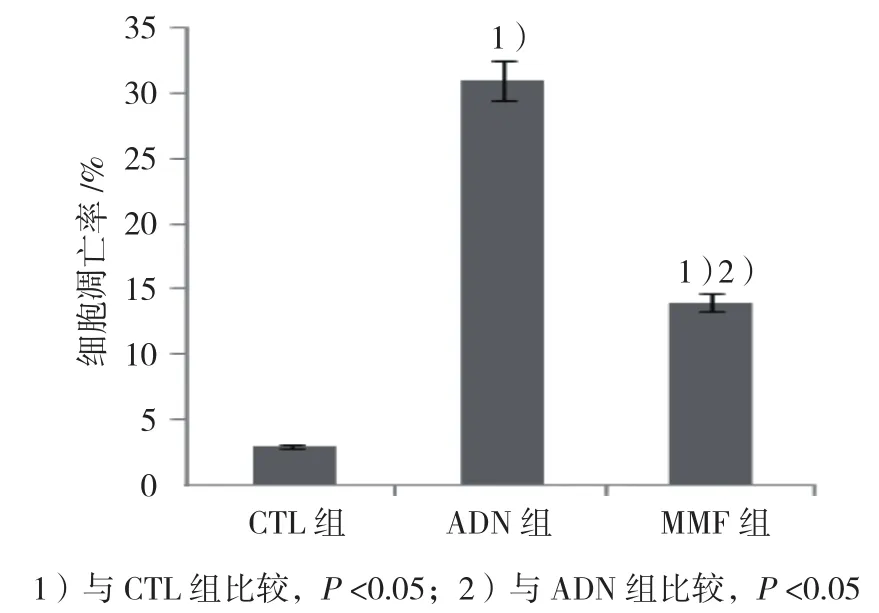
图5 各组大鼠肾组织细胞凋亡率比较 (±s)
2.7 各组大鼠肾组织miRNAs含量比较
3组大鼠肾组织rno-miR-23a、rno-miR-300-3p、rno-miR-24、rno-miR-300-3c表达水平比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,与CTL组相比,ADN组大鼠肾组织rno-miR-23a和rno-miR-300-3p表达上调(P<0.05), 而 rno-miR-24 和 rno-miR-300-3c下调(P<0.05);与ADN组相比,MMF组大鼠肾组织rno-miR-24 和 rno-miR-300-3c表达上调(P<0.05),rno-miR-23a和rno-miR-300-3p下调(P<0.05)。见表4。
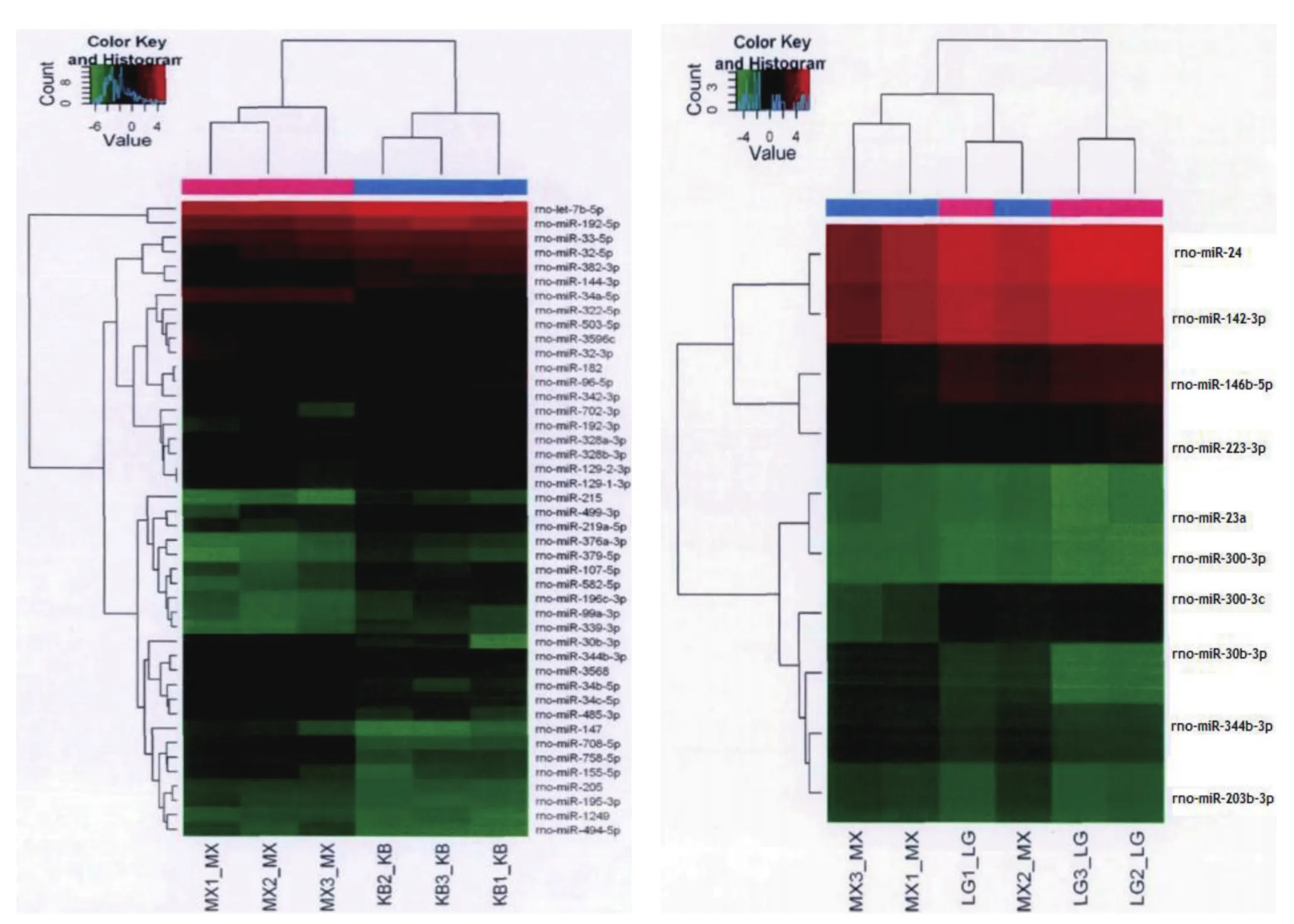
图6 层次聚类图
2.8 大鼠肾组织miRNAs与尿蛋白的相关性
经Pearson相关性分析,rno-miR-23a、rno-miR-300-3p与尿蛋白呈正相关(r=0.773和0.695,均P=0.000);而rno-miR-24、rno-miR-300-3c与尿蛋白呈负相关(r=-0.664 和 -0.647,均P=0.000)。
表4 各组大鼠肾组织miRNAs表达水平比较 (±s)

表4 各组大鼠肾组织miRNAs表达水平比较 (±s)
注:1)与CTL组比较,P<0.05;2)与ADN 组比较,P<0.05
组别 n rno-miR-23a rno-miR-300-3p rno-miR-24 rno-miR-300-3c CTL 组 20 1.00±0.07 1.00±0.03 1.00±0.02 1.00±0.03 ADN组 18 2.89±0.121) 2.71±0.041) 0.61±0.021) 0.54±0.041)MMF 组 19 1.23±0.081)2) 1.47±0.041)2) 0.86±0.041)2) 0.95±0.051)2)F值 2350.62 10772.77 1832.87 714.06 P值 0.000 0.000 0.000 0.000
3 讨论
随着人们饮食习惯的改变,加之环境因素的影响和生活工作压力的增大,我国慢性肾病患者人群呈逐年增加的趋势,成为威胁人类健康的主要原因之一[7]。目前普遍认为,足细胞损伤是糖尿病肾病患者主要的发病机制之一[8]。足细胞是位于肾小球基底膜外侧的最后一道滤过屏障,足细胞损伤导致肾小球基底膜通透性增加,肾小球滤过率降低,从而形成蛋白尿[9]。蛋白尿是绝大多数肾脏疾病早期出现的最常见的临床症状[10]。目前大多数关于NS发病机制的研究都是集中在足细胞特异性表达分子上,如Nephrin、ZO-1、Podoplanin等,尤其是Nephrin蛋白表达下调与足细胞损伤关系最为密切[11],但是关于Nephrin蛋白的调控机制仍未明确。近几年,随着基因组学研究的深入及基因芯片技术的发展,越来越多的学者开始重视miRNAs在各种疾病发生、发展过程中发挥的重要作用。
miRNAs是广泛存在于真核生物细胞中仅具有22个核苷酸长度的内源性小分子物质,与人体内1/3基因的表达密切相关,因具有特异性、高度保守性、集簇性等特点,成为多种疾病研究的新靶点[12]。同样,也有大量miRNAs高表达于肾组织细胞,在肾脏发育和肾功能调控过程中发挥重要作用[13]。既往研究显示,miR-200家族、miR-300家族、miR-23家族、miR-26家族都与肾组织纤维化密切相关[14]。因此,探讨miRNAs与足细胞损伤的关系对于NS发病机制的研究及新药研发具有十分重要的临床价值。
目前,糖皮质激素一直是NS患者的首选药物,但是对于反复发作、激素依赖性/耐药性NS患者,临床建议选择免疫抑制剂治疗[15]。上个世纪末才开始将MMF用于激素抵抗性或复发性NS的治疗[16]。虽然降低蛋白尿的临床疗效已经得到普遍认可,但是其作用机制仍尚未明确。ADN大鼠是公认的、使用最为普遍的肾脏微小病变动物模型,关于模型复制方法,目前没有统一标准。有文献认为一次性注射大剂量阿霉素(≥7.5 mg/kg),虽然模型复制快,病变显著,但是易出现呕吐等副作用,大鼠死亡率较高[17]。而有文献建议多次注射小剂量阿霉素(≤5 mg/kg),虽然症状适中,模型复制成功率较高,但是症状出现缓慢,模型复制周期长[18]。因此,笔者基于多年实验经验,选择一次性尾静脉注射6.5 mg/kg,大鼠生理状况良好,死亡率低,症状适中。根据HE、PAS、Masson染色结果显示,模型大鼠具备典型的急性足细胞损伤的特征,不仅出现蛋白尿,而且可观察到肾小球肥大、系膜细胞增生、足细胞足突广泛融合、毛细管腔狭窄、间质出现轻、中度纤维化等足细胞损伤特征。同时笔者采用TUNEL染色法,证实模型大鼠足细胞凋亡率明显升高。但是经MMF作用28 d后,上述肾组织损伤、蛋白尿症状及足细胞凋亡情况都得到显著改善。为进一步证实MMF对足细胞保护的作用机制,笔者采用基因芯片技术筛查差异性表达的miRNAs,结果显示,与CTL组相比,ADN组有19个miRNAs表达上调,23个miRNAs表达下调。并且层次聚类图显示,miRNAs具有集簇分布的特点。另外,与ADN组相比,MMF组主要有7个miRNAs表达上调,有8个miRNAs表达下调。这其中都包括rnomiR-23a、rno-miR-300-3p、rno-miR-24和rno-miR-300-3c。rno-miR-23a和rno-miR-24位于19号染色体[19],而miR-300-3p和miR-300-3c位于6号染色体[20],因此笔者推测,19号和6号染色体的基因可能与NS发病密切相关,而且彼此在调控生物学行为过程中可能具有协同作用。为证实上述结论,本实验进一步采取qRP-PCR检测各组大鼠肾组织rno-miR-23a、rno-miR-300-3p、rno-miR-24和 rno-miR-300-3c的表达差异,结果与芯片结果基本一致。并且rnomiR-23a、rno-miR-300-3p、rno-miR-24和rno-miR-300-3c表达水平都与尿蛋白密切相关。以往,关于miR-23a/24/300-3p/300-3c的研究证实,这几种基因都属于靶向炎症因子的重要基因,除与炎症的发生、发展密切相关外,还参与细胞的分化、增殖等生物学行为。但是尚没有研究关注其与足细胞损伤的关系。笔者只是初步探讨miR-23a/24/300-3p/300-3c可能参与蛋白尿的生成和足细胞损伤过程,为MMF作用机制的研究提供新思路,并且为进一步药物研究提供潜在的靶点基因,但是还需要后续研究探讨具体对下游蛋白分子或信号通路的影响。
综上所述,通过复制ADN大鼠模型,笔者证实MMF具有抑制足细胞损伤和蛋白尿生成的作用,其机制可能是对19号和6号染色体部分miRNAs有干预作用。但是本项研究只是初步分析MMF对某些重要miRNAs的影响,为NS发病机制的研究及潜在治疗靶点的发现提供理论证据,仍然需要进一步研究证实miRNAs对其相应信号通路及蛋白的调控作用。
