中华蜜蜂嗅觉受体基因AcerOR141的克隆与表达分析
2019-03-02杜亚丽徐凯龙登隆李新宇王春梅兰俊赵慧婷姜玉锁
杜亚丽,徐凯,龙登隆,李新宇,王春梅,兰俊,赵慧婷,姜玉锁*
(1.山西农业大学 动物科技学院,山西 太谷 030801;2.山西农业大学 生命科学学院,山西 太谷 030801)
昆虫嗅觉识别过程需要多种蛋白的参与,其中嗅觉受体(olfactory receptors,ORs)能够介导化学物质(包括各种信息素和植物性气味)与嗅觉神经元(olfactoty sensory neurons,OSNs)的特异性结合,对于配偶、同伴、食物和产卵场所的选择至关重要[1]。中华蜜蜂(Apisceranacerana)是我国特有的当家蜂种,具有敏锐的嗅觉和较强的抗逆能力,善于搜寻零散的蜜粉源,适于在我国的高寒山区进行定地饲养[2]。研究中华蜜蜂普通嗅觉受体有利于我们进一步了解中华蜜蜂的气味识别机制,为其科学饲养管理提供新的理论指导。昆虫ORs在嗅觉神经元树突膜上特异性表达,一般由300~450个氨基酸组成,含有7个α-螺旋跨膜结构域,N-末端在细胞膜内,C-末端在细胞膜外,这与脊椎动物的G蛋白偶联受体(G-protein-coupled receptors,GPCR)的膜拓扑学结构相反。目前已在鳞翅目、双翅目、膜翅目和鞘翅目等多种昆虫中鉴定出了嗅觉受体基因。其中,从膜翅目昆虫西方蜜蜂Apismellifera[3]、丽蝇蛹集金小蜂Nasoniavitripennis[4]、阿根廷蚁Linepithemahumile[5]、红色收获蚁Pogonomyrmexbarbatus[6]、佛罗里达弓背蚁Camponotusfloridanus[7]、印度跳蚁Harpegnathossaltator[8]、东方蜜蜂Apiscerana[9]、小蜜蜂Apisflorea[10]、兰州熊蜂Bombuslantschouensis[11]中分别筛选获得了170、301、367、344、407、377、119、180、165个ORs。昆虫的嗅觉神经元通常表达两类嗅觉受体:一类是传统嗅觉受体ORs,该类受体主要用于识别普通气味分子和信息素,其同源性较低,仅在少部分嗅觉神经元中低丰度表达。另一类是非典型嗅觉受体Orco(olfactory receptor co-receptor),该类受体不能直接识别气味,但是可以协助ORs精确定位到神经元树突膜上而提高ORs对气味分子的敏感性,其高度保守,在大多数神经元中均有表达。按配体结合差异特性又将ORs分为识别普通挥发性气味分子的普通嗅觉受体(general olfactory receptors)和识别性信息素的性信息素受体(pheromone receptors)两类。在对冈比亚按蚊Anophelesgambiae、烟芽夜蛾Heliothisvirescens和黑腹果蝇Drosophilamelanogaster的研究中发现,缺失Orco后会降低昆虫对气味的敏感性,重新导入后又逐渐恢复正常[12]。ORs通常与Orco以异源二聚体的形式组成一个配体门控离子通道,将环境中的小分子化学信息物质所携带的信息转化为电信号,刺激嗅觉神经元产生动作电位并传至脑部的触角叶,使昆虫感知到外界气味进而做出相应的行为反应。不同ORs对不同类气味的反应谱也不同。例如,意大利蜜蜂AmelOR11在雄蜂中表达并特异性地识别反式-9-氧代-癸二烯酸(9-ODA)[13],绿盲蝽AlucOR40只对反-2-己烯醇有特异性反应[14],小菜蛾PxylOR9只对植物挥发物β-紫罗兰酮的刺激具有反应[15],而黑腹果蝇DmelOR67能被大多数气味分子激活[16],豆杆野螟OscaOR3对种内和近缘种的性信息素都有反应[17],中华蜜蜂AcerOR1能广泛地识别丁香酚、月桂酸、橙花醇等9种花香物质[18]。不同昆虫普通嗅觉受体基因间的同源性比较低,使用同源克隆技术很难获得目的基因序列,而目前对中华蜜蜂普通嗅觉受体的研究报道还相对较少。克隆获得了AcerOR141的cDNA序列,并对其编码蛋白的结构进行预测分析,明确其在工蜂不同发育阶段各组织中的mRNA表达情况,为中华蜜蜂普通嗅觉受体的功能研究提供理论参考。
1 材料和方法
1.1 试验材料
试验用中华蜜蜂A.c.cerana于2018年5-7月份在山西农业大学动物科技学院实验蜂场进行样本的标记及收集工作。选择群势较强、健康无病的正常蜂群,抽出2张成熟的封盖子脾(可看到有正在出房的新蜂)置于恒温培养箱中(T(34±1) ℃;RH(75±5)%)。次日,使用专用记号笔在新蜂背部进行标记(约3 000只),20 min后放回原来的蜂群。刚出房的新蜂记为1日龄,之后每5 d采一次样,每次270只,随机分为3组,分离触角、头(去除触角)、胸(去除足和翅膀)、腹、足和翅膀等组织,迅速投入液氮冷冻后置于-80 ℃保存备用。
1.2 主要试剂与试剂盒
TRIzol®Reagent购自美国Invitrogen公司;克隆载体pGEM®-T Easy,化学感受态细胞JM109和凝胶回收试剂盒Wizard SV Gel and PCR Clean-Up System购自美国Promega公司;PrimeScriptTMRT Reagent Kit with gDNA Eraser (Perfect Real Time),RNase-free water,SYBR®Premix Ex TaqTMII (Tli RNaseH Plus)和DL 2000 DNA Marker购自日本Takara公司;2×Easy Taq PCR SuperMix(-dye)和GelStain购自北京全式金生物技术有限公司;低熔点琼脂糖购自西班牙Biowest公司;酵母粉和胰蛋白胨购自英国Oxoid公司;50×TAE Buffer,Ampicillin,IPTG,X-Gal和固相清除剂等试剂均购自北京EBT生物公司;甲醇、无水乙醇、异丙醇、氯仿等分析纯购自天津天力化学试剂有限公司。
1.3 总RNA的提取和cDNA的合成
参照TRIzol试剂说明书提取1.1中收集的成蜂不同发育阶段各组织的总RNA,并利用琼脂糖凝胶电泳和ND-1000(NanoDrop,美国)进行质量和浓度测定。以1 μg总RNA为模板反转录合成cDNA,测定浓度后4 ℃保存备用。
1.4 引物设计
依据转录组分析得到的Unigene序列,利用Primer 3.0 plus在线程序(http://www.bioinformatics.nl/cgi-bin/primer3plus/primer3plus.cgi)设计用于扩增目的基因序列的引物;根据分析获得的ORF序列,利用Primer Premier 5.0软件设计用于qRT-PCR的特异性引物。内参基因为NCBI上获得的AcerArp1(HM640276.1)。引物详细信息见表1。

表1 引物信息Table 1 The information of primers
1.5 基因克隆
以中华蜜蜂触角cDNA为模板,使用2×Easy Taq PCR SuperMix(-dye),在ABI VeritiTM96 well PCR system中进行PCR扩增。反应程序设定为:94 ℃ 4 min;94 ℃ 30 s,X ℃(退火温度X详见表1)30 s,72 ℃ 30 s,扩增循环35次;72 ℃ 8 min。扩增产物用1.0%琼脂糖电泳分离后,利用Wizard SV Gel and PCR Clean-Up System试剂盒进行目的片段的回收,将其连接到pGEM®-T Easy载体后进行双向测序(由北京华大基因科技有限公司完成)。
1.6 序列分析
使用EditSeq工具查找并翻译AcerOR141的ORF区,运用在线工具ProtParam(http://web.expasy.org/cgi-bin/protparam/protparam)分析AcerOR141的基本理化性质;TMHMM-2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测该蛋白的跨膜区域;SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)查找含有的信号肽序列;Conserved Domains(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析存在的保守区域;CBS Prediction Servers(http://www.cbs.dtu.dk/services/)分析潜在的糖基化和磷酸化位点;SMART(http://smart.embl-heidelberg.de/)分析功能结构域;CELLULAR(https://cello.life.nctu.edu.tw/)进行亚细胞定位。将其编码的氨基酸序列导入在线软件PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)预测二级结构。Blastx(http://blast.ncbi.nlm.nih.gov/Blast.cgi)查找同源的氨基酸序列后,使用MEGA6.0软件中的ClustalW比对氨基酸序列,采用NJ法构建系统进化树,Bootrap值为1 000。
1.7 AcerOR141表达量的检测
以1.3中获得的cDNA为模板进行荧光定量PCR检测。qRT-PCR反应体系包括:SYBR®Premix Ex TaqTMII(2×)7.5 μL,上、下游引物(10 μM)各0.6 μL,cDNA模板100 ng,ROX Reference Dye II(50×)0.3 μL,ddH2O补至15 μL。反应程序为:95 ℃ 30 s;接着进行45个循环:95 ℃ 30 s,62 ℃ 34 s。每个样品进行3次平行。应用MXPro-MX3000P软件分析标准曲线及扩增曲线的Ct值,采用2-△△Ct法进行数据处理,结果以平均数±标准误(Mean±SE)表示。通过SPSS17.0软件进行方差分析(ANOVA),接着采用Duncan′s法进行多重比较,最后利用GraphPad Prism 6.0软件作图。
2 结果与分析
2.1 基因克隆与测序分析
用设计的引物对目的基因进行扩增(图1),随后进行克隆和测序。利用DNAStar软件中的SeqMan工具拼接测序结果,获得的cDNA序列全长为1 657 bp,包括303 bp的5′非编码区(5′UTR)、1 299 bp的完整开放阅读框(ORF)和55 bp的3′非编码区(3′UTR),共编码432个氨基酸(图2)。经Blastp比对发现,推测的氨基酸序列与西方蜜蜂AmelOR141一致性为91%,因此确定该序列为中华蜜蜂AcerOR141基因,并提交至NCBI数据库(GenBank登录号为:KT246483.1。)

图1 AcerOR141基因扩增结果Fig.1 Amplification results of AcerOR141 注:M,DNA分子量标准;1,2和3泳道分别为720、405、1 063 bp。Note:M, DNA Marker; Lane 1, 2 and 3 are 720, 405 and 1 063 bp, respectively.
2.2 理化特性和结构分析
ExPASy ProtParam在线分析表明,AcerOR141蛋白分子式为C2259H3533N563O624S24,分子量大小为49.33 kDa,理论等电点为8.74,为碱性蛋白。在组成AcerOR141蛋白的20种氨基酸中,亮氨酸(Leu)所占比例最高,达12.3%;色氨酸(Trp)和脯氨酸(Pro)所占比例最低,为1.6%;带正、负电荷的氨基酸总数分别为40和33。总平均亲水性系数、脂溶指数、不稳定系数分别为0.306、106.06、37.07,表明AcerOR141是一种稳定的脂溶性蛋白。
AcerOR141蛋白无信号肽,具有7个跨膜结构,分别位于第37~59,69~91,130~152,208~230,309~331,341~363,406~428位氨基酸之间,且N端位于胞内,C端位于胞外(图3)。该蛋白的氨基酸序列中,第184~421位间有一个昆虫嗅觉受体7tm-6 superfamily的保守结构域(E值:1.00e-29)。AcerOR141氨基酸序列中不含有O-糖基化位点,但存在4个潜在的N-糖基化位点,为第61、64、164和322位的天冬酰胺(Asn)残基;含有15个潜在的磷酸化位点,包括7个苏氨酸残基(Thr6,124, 222, 268, 274, 308, 334)、3个酪氨酸残基(Tyr199, 340, 378)和5个丝氨酸残基(Ser119, 240, 272, 279, 319)。亚细胞定位结果表明,AcerOR141为细胞质膜蛋白(Plasma Membrance)的可能性为0.997。二级结构预测结果显示,AcerOR141编码的蛋白以α-螺旋(helix)为主,占68.52%;β-折叠(strand)和卷曲环(coil loop)所占比例分别为28.94%和2.55%。
2.3 序列比对和进化树分析
利用Blastp找到与AcerORs同源蛋白的氨基酸序列,其中,AmelOR141和AmelOR13a-like的氨基酸序列一致性为99%,蛋白结构相似,应该为同一个基因。中华蜜蜂与其它膜翅目昆虫的ORs氨基酸序列一致性差异较大,在43%~97%之间。从图4可以看出,所有膜翅目的ORs分为两大分支:即蜜蜂科的中华蜜蜂AcerOR141、西方蜜蜂AmelOR141和AmelOR13a-like、大蜜蜂AdorOR56a-like、小蜜蜂AfloOR85e、熊蜂BimpOR49b-like、地熊蜂BterOR13a、回条蜂HlabOR13a-like、芦蜂CcalOR49b-like与苜蓿切叶蜂MrotOR92a为一大分支;蚁科的牛角刺槐蚁PgraOR49b-like、北方粗切叶蚁TsepOR49b-like、佛罗里达弓背蚁CfloOR13a、育菌蚁CcosOR49b-like和红色收获蚁PbarOR49b-like聚为另一大分支。

图2 AcerOR141基因cDNA和氨基酸序列Fig.2 cDNA and amino acid sequences of AcerOR141 注:红色方框表示起始和终止密码子,红色下划线表示跨膜区,箭头方向表示膜内。TMD1-7:跨膜结构域1-7。Note: The start and stop codons are shown by the red box; the transmembrane regions are indicated by a red line down the sequences; the direction of arrowheads represents the inside of membranes. TMD1-7, the number of transmembrane region.
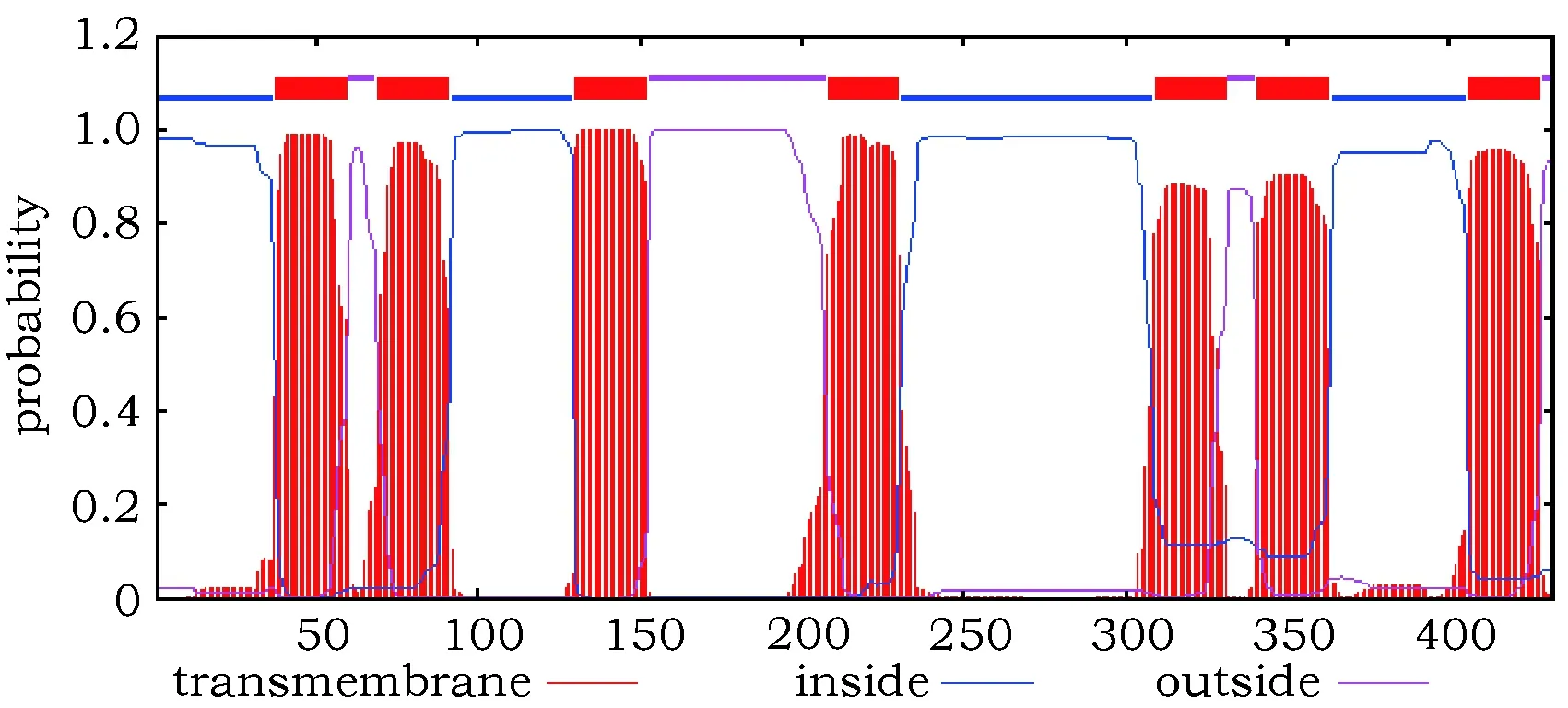
图3 AcerOR141跨膜区域预测图Fig.3 AcerOR141 transmembrane region prediction
2.4 AcerOR141基因时空表达分析
工蜂羽化出房后不同日龄各组织中AcerOR141 mRNA的表达情况见图5。综合各发育阶段的组织特异性分布模式可发现,AcerOR141 mRNA在工蜂触角和头部的表达量较高,且极显著高于其他组织(胸、腹、足和翅膀)(P<0.01),在其它组织中仅有微量的表达。1、15、25和30日龄工蜂触角中AcerOR141的表达量最高,极显著高于其它组织(P<0.01);头部的表达量次之,其余组织之间无明显差异(P>0.05)。5、10和20日龄工蜂头部的表达量最高,触角次之,均极显著高于其它组织(P<0.01)。触角和头部不同日龄的表达模式(图5)显示,AcerOR141在不同日龄的表达量差异较大。工蜂头部的表达量在1日龄时较低,之后大幅上调,5日龄达到最高,随后又逐渐下降,20日龄缓慢增加,之后又突然下降,与1日龄表达量无显著差异(P>0.05)。触角的表达趋势与之基本一致,变化幅度较小,且10日龄表达量达到最高,极显著高于其它日龄(P<0.01)。
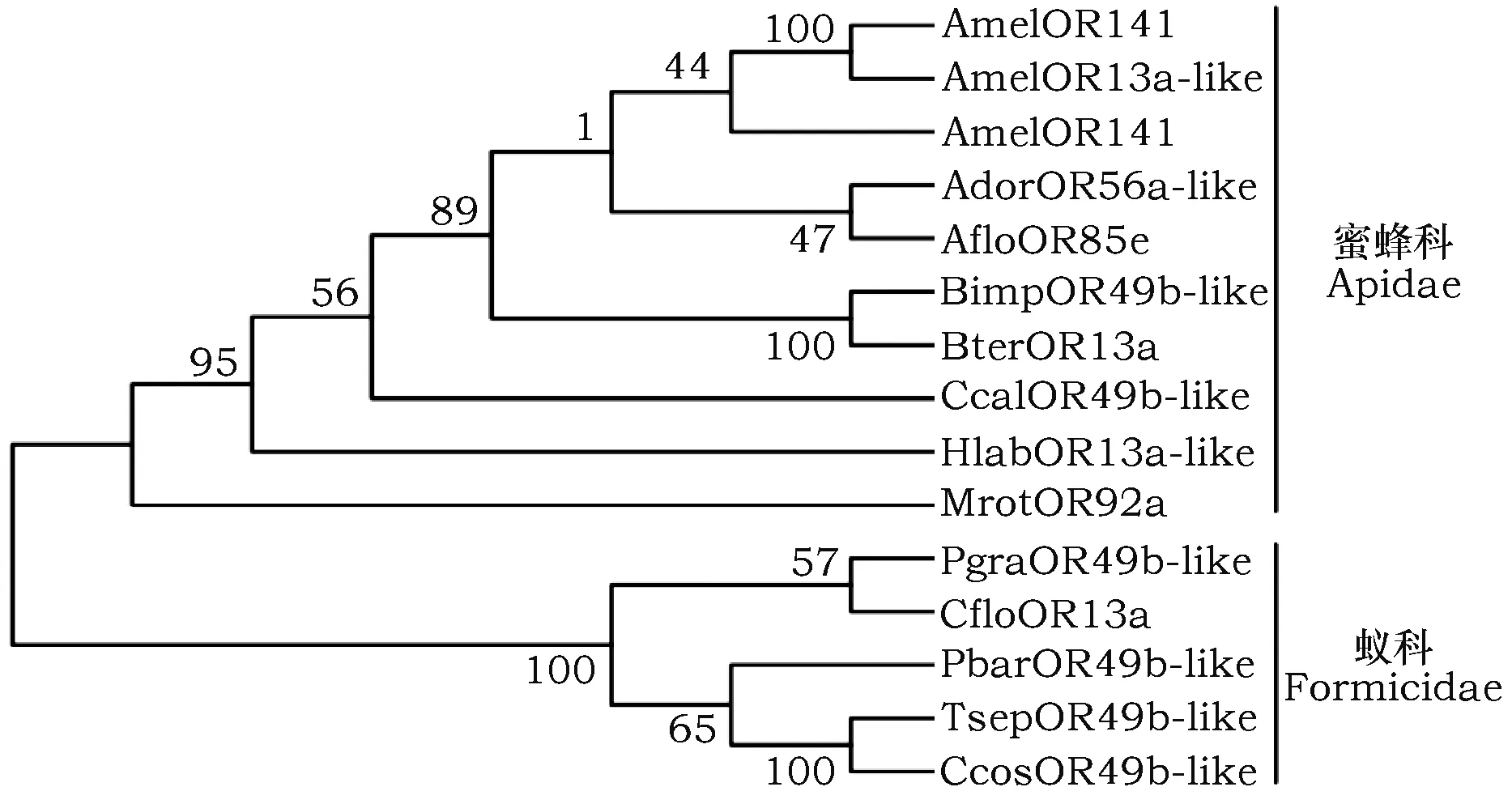
图4 几种膜翅目昆虫ORs的系统进化树Fig.4 Phylogenetic tree of ORs from several Hymenoptera insects 注:各蛋白的来源、登录号The source and accession number of various protein sequence: AcerOR141, 中华蜜蜂Apis cerana cerana (ALR87041.1); AmelOR141, 西方蜜蜂Apis mellifera (Robertson and Wanner, 2006); AdorOR56a-like, 大蜜蜂Apis dorsata (XP_006608157.1); AmelOR13a-like (XP_006563645.1); AfloOR85e, 小蜜蜂Apis florae (XP_012339623.1); BimpOR49b-like, 熊蜂Bombus impatiens (XP_003486905.2); BterOR13a, 地熊蜂Bombus terrestris (XP_003401155.2); HlabOR13a-like, 回条蜂Habropoda laboriosa (XP_017796563.1); CcalOR49b-like, 芦蜂Ceratina calcarata (XP_017889358.1); MrotOR92a, 苜蓿切叶蜂Megachile rotundata (XP_003705978.2); PgraOR49b-like, 牛角刺槐蚁Pseudomyrmex gracilis (XP_020293473.1); TsepOR49b-like, 北方粗切叶蚁Trachymyrmex septentrionalis (XP_018356899.1); CfloOR13a, 佛罗里达弓背蚁Camponotus floridanus (XP_011252458.2); CcosOR49b-like, 育菌蚁Cyphomyrmex costatus (XP_018407571.1); PbarOR49b-like, 红色收获蚁Pogonomyrmex barbatus (XP_011639928.1).
3 讨论
一般认为,昆虫嗅觉受体ORs的典型结构特征是含有7个α-螺旋跨膜结构域,但不属于G蛋白偶联受体。在实验室前期中华蜜蜂触角转录组测序数据的基础上,本研究克隆得到了嗅觉受体基因AcerOR141的全长序列。生物信息学分析表明,AcerOR141编码432个氨基酸,无信号肽序列,具有7个跨膜结构且N-端位于胞内。这与棉铃虫HarmOR29[19]、小菜蛾PxylOR17[20]、绿盲蝽AlucOR40[14]、中华蜜蜂AcerOR2[21]、AcerOR10[22]和AcerOR35[23]的预测结果相一致,因此我们可以确定AcerOR141为中华蜜蜂的嗅觉受体基因。序列比对和进化树分析结果显示蜜蜂科和蚁科嗅觉受体序列保守性较低,亲缘关系较远,这与嗅觉受体具有多样性和物种特异性的特征是一致的。

图5 AcerOR141在工蜂不同发育阶段、不同组织中的差异性表达Fig.5 The differential expression of AcerOR141 at different developmental stages and in different tissues of workers 注:An,触角;H,头(去除触角);T,胸(去除足和翅膀);Ab,腹;L,足;W,翅膀;1 d~30 d:成年工蜂的日龄。柱上不同大写字母表示同一日龄工蜂不同组织间AcerOR141 mRNA的表达差异极显著(P<0.01),小写字母表示工蜂同一组织不同日龄间AcerOR141 mRNA的表达差异极显著(P<0.01)。Note: An: Antenna; H: Head without antenna; T: Thorax without legs and wings; Ab: Abdomen; L: Legs; W: Wings; 1 d~30 d: day-ages of adult worker bees. Significant difference at 0.01 level in the expression of AcerOR141 mRNA between tissues of same day-ages was shown by different upper-case, and significant difference in the expression of AcerOR141 mRNA in antenna and head between day-ages was shown by different lower-case.
在生物体内,翻译得到的蛋白需要进行不同的修饰加工,修饰方式调控着蛋白质的生物功能。N-糖基化修饰是一种新生肽链的共翻译或翻译后修饰方式,将糖链与天冬酰胺的自由基-NH2基连接,可显著增加蛋白结构的稳定性,在蛋白质的折叠和转运等生理过程中起重要作用[24]。AcerOR141含有的4个N-糖基化位点可能会增加AcerOR141的构象稳定性,改变其生物活性。此外,蛋白质磷酸化是调节和控制蛋白质活性和生物功能的一种普通的调节方式,在酶的催化作用下将磷酸基团连接到底物蛋白质的丝氨酸、酪氨酸和苏氨酸上,在细胞信号传递过程中发挥着重要作用[25]。AcerOR141包含15个潜在的磷酸化位点,这可能与嗅觉识别过程中电生理信号的转导有关。
昆虫基因的表达模式在一定程度上能够反映其相应的生物学功能[26]。性信息素受体一般在雄虫触角中特异性高表达,而普通嗅觉受体的表达分布范围较广。本研究qRT-PCR结果显示,工蜂触角和头中AcerOR141 mRNA的表达量均极显著高于其他组织(P<0.01),这说明AcerOR141可能属于普通嗅觉受体。嗅觉受体表达于嗅觉感器神经元内,而触角是昆虫重要的嗅觉器官,其上密布着丰富的嗅觉感器[1],因此,AcerOR141在触角中高表达与其推测的嗅觉受体的生理功能是一致的。本课题组前期研究的中华蜜蜂AcerOR1、AcerOR35、AcerOR96、AcerOR113和AcerOR167均在工蜂触角中特异性高表达[23, 27~29]。此外,昆虫头部的口器附肢表面也分布着大量的感觉器,内部有脑、消化道前端、与附肢相关的肌肉和神经等,是昆虫重要的感觉和摄食中心[30]。中红侧沟茧蜂MmedOR6和MmedOR10在触角、头和足中均有表达,可能参与栖息场所选择和天敌躲避等行为[31]。小菜蛾PxylOR16、PxylOR17和PxylOR18除触角之外,在头、下唇须和喙中有较高的表达,推测其能够识别普通气味物质[20]。致倦库蚊CquiOR118高表达于雌蚊头部,可能参与宿主的搜寻、定位等行为[32]。中华蜜蜂AcerOR141在头部也有相对较高的表达,推测其可以用头部来感受外界环境中的化学物质。
工蜂承担蜂群内除繁殖以外的所有工作,且根据日龄的不同进行明确的劳动分工。一般来说,1~3日龄的幼蜂主要从事清理巢房和封盖幼虫的工作;4~12日龄主要承担照顾蜂王和幼虫、调制日粮等工作;13~18日龄主要进行泌蜡造脾的工作,后期的主要任务是巢门防守;19~21日龄之后开始出巢采集花粉、花蜜、水和树胶等,称为采集蜂[33]。本研究发现25和30日龄采集蜂头部中AcerOR141的表达量较低,极显著低于触角(P<0.01),这可能与采集蜂主要参与外出采集工作,生理上逐渐发生退化,脑部出现氧化损伤、神经元减退等现象,嗅觉记忆功能显著丧失密切相关[34]。
4 结论
本研究成功获得了中华蜜蜂嗅觉受体基因AcerOR141 cDNA序列。生物信息学分析结果表明AcerOR141具有昆虫嗅觉受体的典型特征。时空表达结果显示,AcerOR141 mRNA在工蜂触角和头部的表达较高,极显著地高于其他组织(P<0.01),在胸、腹、足和翅膀中仅有微量的表达,暗示该基因属于普通嗅觉受体,其可能在普通气味组分的识别过程中发挥重要作用,具体功能还有待进一步研究。
