循环miRNA-26a对经皮冠状动脉介入治疗术后对比剂肾病的预测价值分析
2019-02-28
对比剂肾病(contrast media induced nephropathy,CIN)是经皮冠状动脉介入治疗术(percutaneous coronary intervention,PCI)的一个重要并发症[1],出现CIN的病人发生后期心血管事件的风险较无CIN的病人更高,CIN会导致与时间相关的肾脏损伤[2],早期诊断对于病人至关重要,现在CIN通常采用血管内给予造影剂后72 h内血浆肌酐(serum creatinine,SCr)水平升高作为诊断标准。然而,肌酐是CIN不可靠的指标,因为它是肾功能急性变化过程中的间接和不敏感指标[3]。根据最近的一项荟萃分析显示,血浆胱抑素C(cystatin C,CyC)可以准确检测肾脏疾病并进行分期,是一个更好的生物标志物,但是CyC只在对比剂暴露12 h后才增加[4]。一些新的生物标志物,如中性粒细胞明胶酶相关脂质运载蛋白,在变化时间上优于CyC,然而,这些新型生物标志物对CIN的特异性仍不是很高,因为它们很容易受到许多共存变量的影响[5]。因此,对CIN潜在的新型早期生物标志物的研究仍然是最受关注的领域。
微小RNA(microRNA,miRNA)是一组内源性单链非编码RNA,可调控各种生物体和生理过程中的基因表达。组织特异性/富集的miRNA可以在正常状态下发挥独特的功能作用。它们在血浆、尿液和其他体液中的表达模式与各种疾病密切相关,循环中的miRNA可以在血浆中以非常稳定的形式轻易检测到,表达谱具有巨大的潜力,可用作诊断和监测人类疾病(如癌症和组织损伤)的新型无创生物标志物[6-7]。其中,miRNA-26a也涉及与肾病有关的途径。动物研究发现,miRNA-26a主要在小鼠的肾小球以及其他物种(包括人)的肾小球中表达,miRNA-26a的表达降低与肾小球足细胞损伤的进展密切相关[8]。本研究假设miRNA-26a可能在CIN期间释放到循环中,并可用于检测肾功能损伤,利用CIN大鼠模型[9],探讨CIN期间血浆和肾脏中miRNA-26a表达的变化,探究循环miRNA-26a作为疾病早期检测CIN的潜在生物标志物依据。
1 材料与方法
1.1 大鼠CIN模型 将雄性Sprague-Dawley(SD)大鼠(250~300 g)30只分为大鼠CIN组及大鼠对照组,各15只,大鼠禁水3 d,然后以10 mg/kg的剂量肌内
注射呋塞米。大鼠CIN组以10 mL/kg的剂量通过尾静脉在5 d的过程中使用非离子型低渗对比剂(contrast medium,CM)碘海醇(350 mg/mL; GE Healthcare,中国上海),剂量为10 mL/(kg·min)。大鼠对照组给予等量的生理盐水(normal saline,NS)。根据文献报道,在83.3%的CIN大鼠中观察到SCr增加≥25%[9]。组织病理学分析显示,所有CIN大鼠均出现肾小管坏死和髓质充血,表明这种方法可有效地诱导大鼠CIN,在CM/NS给药后0 h、2 h、4 h、8 h、12 h和24 h 获取两组大鼠外周血。重复构建大鼠CIN模型,在CM/NS给药后8 h获取两组大鼠主要器官(肾、心、肝、脾、肺、脑)的组织样本。
1.2 临床资料及血浆收集 选取2016年1月—2018年1月在我中心进行经皮冠状动脉介入治疗并发生术后CIN的病人160例,其中术后出现CIN病人80例为病人CIN组,未出现CIN或其他并发症病人80例为病人对照组,两组年龄、性别、吸烟史、高血压等临床资料比较差异无统计学意义(P>0.05)。纳入标准:PCI术后SCr和CyC测量中病人出现SCr≥25%或CyC≥10%的相对增加。排除标准:近期CM暴露(2 d内),其他原因的肾损伤,进行过透析,心搏骤停,SCr或CyC值缺失,妊娠或哺乳期女性。
所有病人均使用非离子型,低渗透压CM和静脉水化,水合的持续时间和体积由医师决定。用于miRNA分析的血液样品在CM暴露后4~6 h前瞻性收集,将外周血(5 mL)收集到含乙二胺四乙酸管(BD Vacutainer,Franklin Lakes,NJ)中,并在室温下1 h内处理。通过4 ℃离心10 min收集血浆,将其转移至新鲜的不含RNase / DNase管中,在4 ℃以16 000 r/min离心10 min。将上清液转移到新管中并储存在-80 ℃环境中。在入院时和手术后24~48 h测量病人SCr和CyC。入组前,将研究方案详细告知病人本人及家属,并获得知情同意,本研究经我院医学伦理委员会批准实施。
1.3 RNA提取和实时定量 PCR 使用TRIzol试剂提取待测血浆及组织的总RNA,随后用75%乙醇代替异丙醇进行RNA沉淀。使用NanoDrop 1 000分光光度计测定RNA质量。以DBI Bestar qPCR RT试剂盒(DBI Bioscience,Ludwigshafen,德国)将总计1 μg RNA反转录成cDNA。使用7500 Fast Real-Time PCR,在以下条件进行qRT-PCR:95 ℃温育2 min,然后进行40个循环的95 ℃退火15 s,60 ℃ 60 s。miRNA-26a PCR引物由瑞博生物科技有限公司设计,序列如下:miRNA-26a 上游:5′-GTCATCTAGAAAGCTTGATGCAGGAAAGAGCTTTGG-3′,下游:5′-TGACAGATCTCAGCTGACATCCTCTAGGCTGGGGTT-3′;内参U6,上游:5′- CTCGCTTCGGCAGCACATATACT-3′,下游:5′- ACGCTTCACGAATTTGCGTGTC-3′。使用2-ΔΔCt公式对miRNA进行定量。重复3次,取平均值。根据病人依据血浆miRNA-26a相对表达中位数分为miRNA-26a高表达组(68例)以及低表达组(92例)。
1.4 CIN危险因素评分 对入组病人进行CIN危险因素评分,采用Mehran评分系统[10],Mehran风险评分项目:低血压(0分不存在或5分存在),主动脉内球囊反搏(0分不存在或5分存在),充血性心力衰竭(0分为不存在或5分存在);年龄>75岁(如果是,评分为4分),糖尿病(评分为0分或3分);估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)40~60mL /( min·1.73 m2)为2分;20~39 mL /( min·1.73 m2)为4分;<20 mL /( min·1.73 m2)为6分;预先存在的贫血(0分不存在或3分存在)和CM体积(每100 mL,1分),Mehran风险评分为所有项目相加之和。

2 结 果
2.1 miRNA-26a在大鼠CIN模型及病人血浆中的表达 miRNA-26a在大鼠CIN组的血浆及肾脏组织中的表达较大鼠对照组明显升高,差异有统计学意义(P<0.05),miRNA-26a在PCI术后病人CIN组血浆中的表达也较病人对照组明显升高(P<0.05)。详见表1。
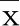

组别样本量血浆肾脏组织大鼠CIN组153.42±0.231)3.34±0.211)大鼠对照组150.98±0.101.03±0.09病人CIN组803.19±0.202)-病人对照组800.99±0.11-
1)与大鼠对照组比较,P<0.05;2)与病人对照组比较,P<0.05
2.2 miRNA-26a在CIN大鼠主要器官中的表达 miRNA-26a在肾脏中出现明显的高表达,在其余5种器官中表达水平明显较低(P<0.05)。详见表2。
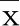

部位miRNA-26a相对表达肾1.00±0.07心0.11±0.031)肝0.12±0.021)脾0.09±0.021)肺0.10±0.011)脑0.15±0.041)
与肾脏比较,1)P<0.05
2.3 血浆miRNA-26a在大鼠CIN模型构建时的表达 大鼠CIN组血浆miRNA-26a表达在CM给药后2 h出现明显升高(P<0.05),4 h时达到峰值,后逐渐回落,12 h时CIN组大鼠血浆miRNA-26a仍明显高于大鼠对照组(P<0.05)。详见表3。
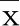

组别 只数0 h2 h4 h8 h12 h24 h大鼠CIN组151.23±0.112.39±0.101)7.11±0.421)2)3.41±0.221)2)2.05±0.191)2)1.35±0.122)大鼠对照组151.22±0.131.26±0.121.24±0.101.20±0.091.29±0.121.30±0.12
与大鼠对照组相同时间点比较,1)P<0.05;与同组上一时间点比较,2)P<0.05
2.4 病人血浆miRNA-26a表达与Mehran风险评分 miRNA-26a高表达组病人Mehran风险评分明显高于低表达组(P<0.05),Mehran评分≥6分病人比例较低表达组明显升高(P<0.05),Pearson相关分析发现血浆miRNA-26a表达与Mehran评分呈正相关(r=0.372,P<0.05)。详见表4。

表4 病人血浆miRNA-26a表达与Mehran风险评分
与miRNA-26a低表达组比较,1)P<0.05
3 讨 论v
循环miRNA在诊断人类疾病中具有巨大的潜力,有望成为新型微创生物标志物。许多miRNA与对比剂肾损伤或者急性肾损伤有牵连,其中一些通过调节细胞凋亡和炎症扩大或减少急性损伤应答来促成发病机制,而另一些则调节纤维化和血管生成,参与肾脏恢复或进展到纤维化[11]。CIN中许多miRNA的生物学和病理学功能尚未完全了解,除了在组织中表达之外,还可以在各种细胞外体液如血浆、尿液、唾液和脑脊液中检测到miRNA。目前已有研究发现某些miRNAs作为CIN早期检测或预测的新型生物标志物的潜力,体内特定miRNAs模拟物或拮抗剂的系统或局部施用可能提供预防或改善肾损伤的策略[12]。在本研究中,血浆miRNA-26a在大鼠CIN模型以及CIN病人中出现明显的表达升高(P<0.05),这说明miRNA-26a可能是CIN的生物标志物。在非离子型低渗CM输注后构建的CIN大鼠模型中,不仅观察到大鼠血浆和肾脏中miRNA-26a的表达变化,还发现在CM暴露后4~8 h miRNA-26a即出现明显增加,其反应速度较传统标志物更快,可能比传统的CIN标记物更具有优势。
miRNA-26a可能与CIN的病理生理学有关,在大鼠CIN模型中,肾脏miRNA-26a的表达远高于其他器官,表明miRNA-26a的血浆水平主要受肾损伤的影响。miRNA-26a是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径的关键调节因子,miRNA-26a可通过沉默结缔组织生长因子(connective tissue growth factor,CTGF)的表达,减少MAPK-JNK/p38途径的激活[13]。MAPK-JNK/p38途径是CM诱导肾小管肾细胞损伤的主要机制[14],miRNA-26a可能在CI-AKI的病理生理学中起重要作用,但是目前引起miRNA-26a表达变化的机制以及其对CIN病理生理学中的作用仍然未知,需要进一步研究。
术前对病人进行CIN风险评估,可为CIN的预防和示警提供参考,Mehran评分系统对于PCI术后CIN具有临床预测意义,能够协助临床医生判断病人预后[15-16]。本研究发现,miRNA-26a与Mehran风险评分具有相关性(r=0.372,P<0.05),可能是一个有效的CIN发生和预后预测因子。在CIN传统标志物SCr/Cyc的基础上,血浆miRNA-26a表达监测可能有助于早期诊断CIN和预后不良病人的早期鉴别。
在CIN大鼠血浆中miRNA-26a表达明显升高,CM输注后4 h即可出现差异性水平改变,且miRNA-26a以肾特异性方式表达,可能与肾损伤直接相关。CIN病人血浆miRNA-26a的表达升高,且miRNA-26a表达与病人Mehran风险评分呈正相关,血浆miRNA-26a可作为CIN早期诊断的潜在生物标志物。miRNA-26a的峰值出现在4 h,持续时间不长, miRNA-26a检测的狭窄时间窗口可能会限制miRNA-26a用作疾病监测的生物标志物的临床实用性,另外,miRNA-26a在CIN过程中的确切生理作用和调控机制还需更多的基础研究支持。
