部分反硝化耦合厌氧氨氧化脱氮性能研究
2019-02-27王维奇王秀杰王思宇
王维奇,王秀杰,李 军,王思宇
部分反硝化耦合厌氧氨氧化脱氮性能研究
王维奇,王秀杰,李 军*,王思宇
(北京工业大学建筑工程学院,北京 100124)
在稳定运行的包埋厌氧氨氧化反应器的基础上,经过94d的启动成功耦合部分反硝化,部分反硝化NO2--N积累率高达63.5%,与此同时NO3--N去除率稳定为98.4%.确定了耦合反应最佳COD/NO3--N比值范围为2.3~2.7.将pH值提升至8.0,8.5后发现,耦合性能下降,这与之前很多报道的结果不同.在耦合反应器的基础上添加PCL(聚己内酯)固体碳源进一步成功耦合全程反硝化,使得厌氧氨氧化所产生的NO3--N能够得到全部去除,TN去除率也由原来的79.4%提升至 88.3%,同时发现大量反硝化生物膜附着生长于PCL颗粒上.
部分反硝化;厌氧氨氧化;包埋;固体碳源
近年来,厌氧氨氧化技术越来越受到关注,其已被环境界公认为最具可持续发展特质的废水脱氮技术[1-3].但由于其需要亚硝酸盐氮作为电子供体,因此其独立应用受到了限制.目前,短程硝化工艺是获得NO2--N的主要途径[4-5].但是其控制要求高,容易遭到破坏,且一旦破坏难以恢复.因此,新的途径亟待开发.Kalyuzhnyi 等[6]根据厌氧氨氧化和异养反硝化提出一种新的脱氮工艺—反硝化氨氧化(DEAMOX),即在单一反应器内,同时进行着厌氧氨氧化反应和反硝化反应,并且厌氧氨氧化反应的电子供体NO2--N来自于反硝化.即将反硝化反应控制在NO3--N→NO2-以获得高的NO2--N积累,有学者将这一工艺命名为部分反硝化[7].Du等[8]在SBR反应器中分别接种驯化成功的高亚硝态氮积累部分反硝化污泥以及UASB反应器中厌氧氨氧化颗粒污泥,分别以乙醇与乙酸钠为碳源,处理同时含有氨氮和硝酸盐废水,实现部分反硝化与厌氧氨氧化的成功耦合,并稳定运行180d.Li等[9]在连续流反应器下部接种驯化成功的部分反硝化颗粒污泥,上部接种厌氧氨氧化污泥,同样实现了部分反硝化与厌氧氨氧化的成功耦合.以上学者之所以能够实现成功耦合,都是利用接种驯化成功的部分反硝化污泥投加到反应器中.但是他们忽略了探究如何直接启动部分反硝化与厌氧氨氧化的耦合,且其驯化部分反硝化污泥手段有一定的特殊性,较为复杂.本实验以已经成功启动并稳定运行的包埋厌氧氨氧化连续流反应器为基础[10],以葡萄糖为唯一碳源,探索部分反硝化与厌氧氨氧化耦合工艺的启动与稳定运行条件.
1 材料与方法
1.1 部分反硝化耦合包埋厌氧氨氧化反应器
耦合反应器如图1所示.反应器为UASB反应器,高1m,内径90mm,有效容积为6L.外部设有水浴层.包埋厌氧氨氧化颗粒采用流离球内填充辫式填料支撑,均匀分布于反应器中.

图1 部分反硝化耦合包埋厌氧氨氧化反应器示意
1-出水口 ;2-水浴出口;3-氮源配水箱;4-碳源配水箱;5-蠕动泵;6-阀门;7-水浴进口;8-水浴层;9-包埋厌氧氨氧化颗粒;10-流离球; 11-分层取样口
1.2 实验配水水质
实验用水采用人工配水,主要成分如表1所示.

表1 人工模拟废水成分组成
微量元素Ⅰ的组成为:FeSO4,(5g/L);EDTA, (5g/L);微量元素Ⅱ的组成为:EDTA, (15g/L); CuSO4·5H2O, (0.2g/L);ZnSO4·7H2O, (0.43g/L); CoCl2·6H2O, (0.24g/L);MnCl2·4H2O, (0.99g/L); NaMoO4·2H2O, (0.22g/L);NiCl2·6H2O, (0.19g/L); NaSeO4, (0.11g/L); H3BO3, (0.014g/L);NH4+-N,NO2--N; NO3--N分别用NH4Cl和NaNO2, NaNO3按需配制.碳源采用葡萄糖.
1.3 部分反硝化耦合包埋厌氧氨氧化工艺的启动
实验以启动成功并稳定运行的包埋厌氧氨氧化连续流反应器为基础,进水NH4+-N,NO2--N浓度分别为30mg/L,45mg/L左右.NO2--N/NH4+-N,NO3--N/NH4+-N消耗比分别为1.25,0.25左右,接近理论值1.32与0.26.1~5d为包埋厌氧氨氧化稳定运行期,水力停留时间为4h,运行温度控制为30℃左右,进水pH值控制为(7.5±0.1),且启动过程保持这些运行条件不变.反应器具体运行工况如表2所示.

表2 反应器运行方式
第6d,开始向进水中投加少量的NO3--N,观察其对厌氧氨氧化的影响;第11d,将进水NO3--N浓度升至43mg/L左右;第16d,进水中添加10mg/LCOD,培养部分反硝化细菌;待运行稳定后,第31d时,将进水COD提升至60mg/L,提高COD/NO3--N比值,提高部分反硝化能力;第42d,将进水COD提升至110mg/L;第50d时,减小进水NO2--N浓度为15mg/L;第57d时,进水不添加任何NO2--N,进水NO2--N浓度为0.第65至94d,调整COD/NO3--N比值,探索实现耦合的最佳条件.
1.4 提高pH值观察耦合性能
根据前人对厌氧氨氧化研究的结论可知,厌氧氨氧化反应最佳pH值范围为7.5~8.5[11].本实验控制耦合反应器进水pH值为(7.5±0.1).因此,本实验将启动94d后已稳定运行的耦合反应器进水pH值分别提升至8.0,8.5,观察耦合效果,探索pH值在合理范围内提升对部分反硝化亚硝态氮积累的影响及耦合包埋厌氧氨氧化的影响.
1.5 添加固体碳源提高总氮去除率
由于厌氧氨氧化反应产能阶段会产生少量硝酸盐氮,这也影响了厌氧氨氧化反应对总氮去除的贡献率.因此本实验在部分反硝化耦合包埋厌氨氧化的基础上,在连续流反应器上部采用铁丝网加流离球的方式添加100g左右的固体碳源-聚己内酯(PCL),用来去除厌氧氨氧化反应产生的硝态氮.
1.6 亚硝酸盐氮积累率(NTR (%))计算方法
NH4++1.32NO2-+0.066HCO3-+ 0.13H+→1.02N2+
0.26NO3-+0.066CH2O0.5N0.15+2.03H2O (1)
式(1)为厌氧氨氧化反应方程式,由此可知理论上NH4+-N,NO2--N; NO3--N 3者的消耗以及产生比值约为1:1.32:0.26.本实验实际运行比例约为1:1.25: 0.25.
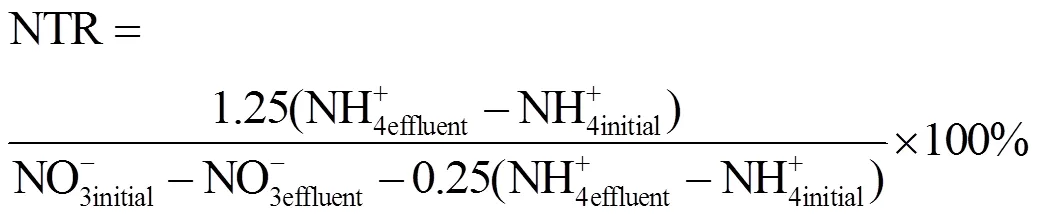
式中所采用的参数为实际运行参数
1.7 水质测定方法
NH4+-N:纳氏试剂光度法;NO2--N:N-(1-萘基)-乙二胺分光光度法;NO3--N:麝香草酚分光光度法;pH值/温度:WTW/Multi3420测定仪.每个实验设置3组平行取平均值.
2 结果与分析
2.1 部分反硝化耦合包埋厌氧氨氧化的启动
厌氧氨氧化反应器采用包埋的方法,目的在于使得厌氧氨氧化菌均匀分布于反应器空间,且由于厌氧氨氧化细菌生长周期较长[12],包埋法能够减少或者避免运行过程中厌氧氨氧化污泥的流失.
1~5d为包埋厌氧氨氧化稳定运行期,由图2可以看出,NH4+-N、NO2--N的去除率分别为100%和82.6%.TN去除率约为76.5%.
第6d、第11d分别向进水中投加10、40mg/L NO3--N.可以看出,NO3--N的投加并没有对厌氧氨氧化细菌氮去除率以及反应比例产生影响.16d后,向反应器中添加少量COD,约为10mg/L,COD/NO3--N≈0.23.目的在于培养异养反硝化细菌,并且反硝化细菌能够根据生长需要自由分布于反应器中.由于投加COD之前反应器中反硝化细菌生物量很低,因此一开始COD无法得到有效去除.为了减弱或者避免初始COD浓度可能对厌氧氨氧化的影响,进水COD的添加量控制在较低状态.有研究表明,少量COD的添加不仅对厌氧氨氧化反应没有影响,而且能够促进厌氧氨氧化细菌的脱氮能力[13-14].由图2可以看出,COD的添加并没有对厌氧氨氧化细菌产生影响,出水NO3--N浓度有少量降低,表明了反硝化细菌在反应器中逐渐生长,30d时,出水NO3--N浓度稳定在49.12mg/L左右,相比投加COD之前下降了1.71mg/L.由于COD添加量较少,因此,大多数COD被用来满足微生物自身的生长需求,因此反硝化效果一般,且NTR值为0.
30,41d后,分别将COD的添加量提高到60, 110mg/L,COD/NO3--N值分别约为1.39,2.56.反硝化效果不断提高,41、49d时,NO3--N去除率分别达到27.4%,72.8%.第41d,NTR值缓慢升高至24.4%,表明部分反硝化效果逐渐提高.但是当COD投加量提升至120mg/L后,NO3--N去除率明显提高,NTR值却没有明显变化,说明部分反硝化效果并没有得到明显提升,增加的COD将NO3--N直接还原成了N2.但是当接下来将进水NO2--N浓度逐渐降低至0后,在不改变COD添加量的状况下,NTR值却明显升高.从图2可以看出,49d后,将进水NO2--N浓度降低为15mg/L后,NTR值迅速提高并稳定至48.9%.降低了进水NO2--N浓度后,此时厌氧氨氧化细菌的部分电子供体只能由部分反硝化提供,因此厌氧氨氧化细菌与反硝化细菌争夺反硝化中间产物NO2--N能力增强,因此更多的NO3--N被还原为NO2--N而并不是N2,因此在不改变其他条件的情况下,NTR值随着进水NO2--N浓度的降低而不断升高,部分反硝化效果得到增强.此时,NO3--N去除率也得到相应提高,56d时,稳定为87.0%.这是由于理论上将1gNO3--N完全还原为N2需BOD5约为2.86g,而理论上将1gNO3--N还原为NO2--N仅需BOD5约为1.14g.因此在进水碳源量相同且相对不足的条件下,NTR值越高,能够还原的NO3--N量越多.
56d后将进水不再投加NO2--N,仅投加NH4+-N、NO3--N以及碳源.实现NO2--N零投加下部分反硝化耦合厌氧氨氧化.进水停止投加NO2--N后,NTR值、NO3--N去除率也同时不断提高,在64d时,分别稳定为63.5%和98.4%.
稳定运行一段时间后,为了确定最佳COD/ NO3--N值范围,在不改变进水NH4+-N、NO3--N浓度条件下,改变COD的投加浓度以改变进水COD/ NO3--N比值.65d时,将进水COD/NO3--N值降为2.3左右. NTR值以及NO3--N去除率依然维持在稳定运行时的较高水平.70d时,继续降低COD/NO3--N值为2.1,NTR值以及NO3--N去除率迅速下降至52.2%和88.1%,为了防止运行情况继续破坏,73d时,将比值还原为2.5,耦合反应器效果仅经过4d左右就迅速恢复到稳定运行的状态.76d后将比值升高为2.7后,耦合效果同COD/NO3--N比值2.5相比,并没有出现下降,说明此时COD浓度的提升并没有影响部分反硝化的效果,只是COD过剩.82d后,继续将比值提升至2.9,此时从图2中可以明显看出, NO3--N去除率依然保持在原来很高的水平,但是NTR值迅速下降至45.0%左右.88d后,将比值继续还原为2.5,观察耦合反应器的恢复状态,相比COD/NO3--N比值由2.1还原为到2.5, COD/NO3--N比值由2.9还原至2.5的反应器耦合效果恢复时间延长为7d左右,由此可见,虽然两者恢复都较为迅速,但是相比由低COD/NO3--N值还原,从高COD/ NO3--N值还原反应器恢复至最佳耦合效果所需要时间更长.
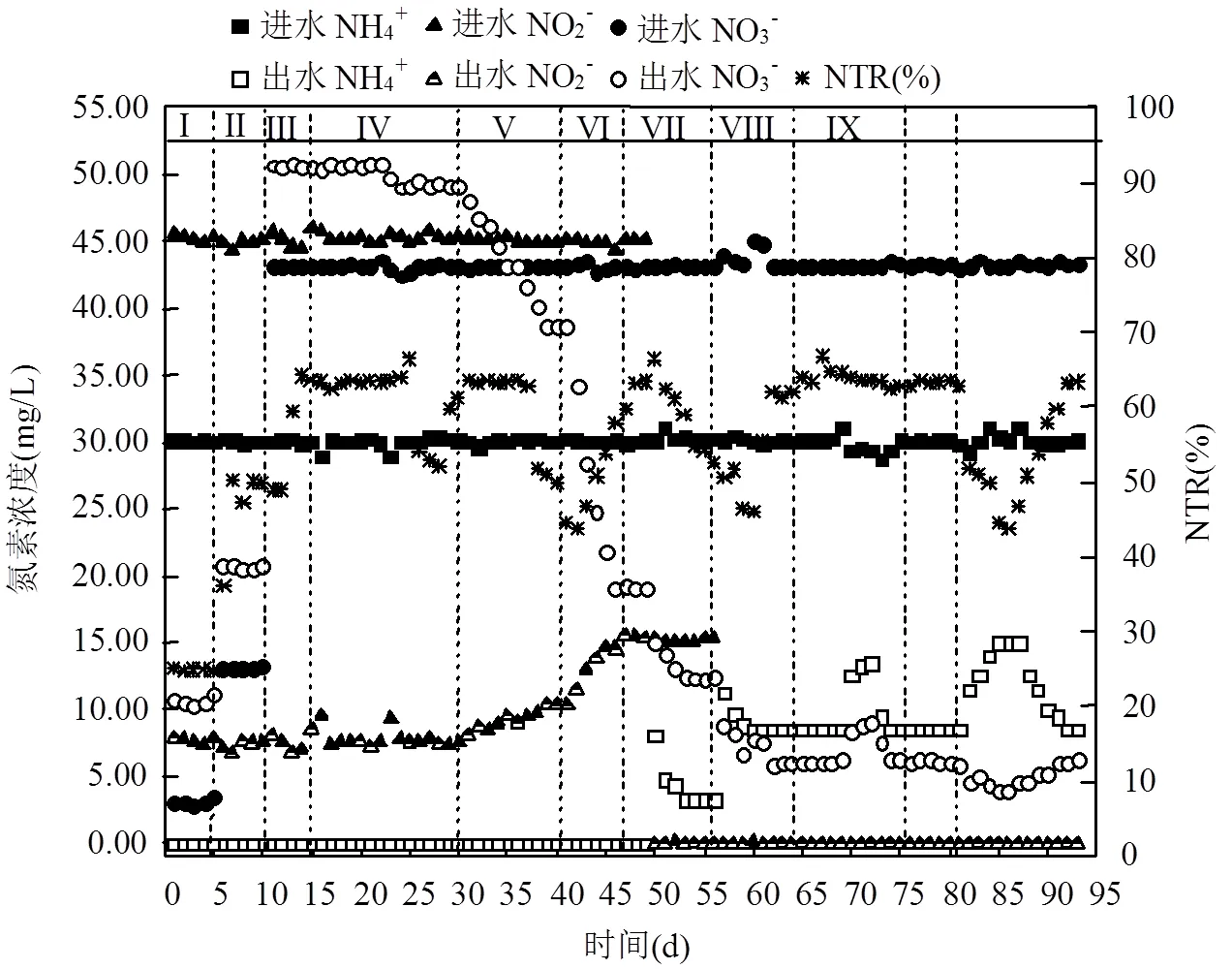
图2 部分反硝化耦合包埋厌氧氨氧化工艺的启动
2.2 pH值升高对耦合系统的影响
根据Glass等[15]、Li等[16]的研究,pH值的升高能够提高反硝化过程NO2--N积累.Glass等研究了序批式反应器中pH值分别为6.5,7,7.5,8.5,9时反硝化过程亚硝酸盐氮积累情况.发现,当pH值为6.5,7时,硝酸盐废水的反硝化作用受到抑制.而当pH值分别为7.5,8.5,9时,反硝化效果显著,且随着pH值的升高, NTR值不断升高.NO2--N积累浓度峰值分别达到250,500,900mg/L.Li等[16]则是利用高硝酸盐氮浓度废水(氮负荷约为55kgN/(m3×d)反硝化自碱化提高反应pH为9.2值左右,NO2--N积累浓度高达(451.1±49.0)mg/L.本实验在厌氧氨氧化最适范围内提升pH值进而研究pH值对耦合反应器的影响.待反应器恢复稳定运行后,将进水pH值由原来的7.5左右提升至8.0以及8.5.由图3可以看出,94~109d, 110~119d分别为进水pH值维持在8.0,8.5阶段.分析数据得知,提升进水pH值至8.0后,耦合反应器氨氮去除率,NTR值不断降低,在102d时趋于稳定,分别由原来的75.1%, 63.4%下降至58.1%,54.6%.109d后,进一步将进水pH值升高至8.5左右,耦合脱氮效果下降明显,在119d时,NTR值已下降至49.4%,氨氮去除率下降为36.1%.分析可知,本实验pH值提升范围符合厌氧氨氧化最佳反应条件.因此pH值对厌氧氨氧化细菌竞争电子供体NO2--N影响较小.因此,pH值升高主要是影响反硝化细菌的NO2--N积累,pH值提高, NO2--N积累能力减弱.这与Glass[15]、Li等[16]的研究并不相同,究其原因,应该是由于所驯化培养的异养反硝化细菌种类有所不同,因此pH值对其影响自然有所差别.119d时,耦合效果仍有继续下降的趋势,因此,120d后,将进水pH值恢复为初始状态,耦合反应器效果同时缓慢恢复.约11d左右后,耦合反应器恢复为最佳状态并稳定运行.相比碳源添加量改变对耦合效果的影响,pH值的改变对耦合效果恢复的影响更大,恢复时间延长.但是由于提升pH值范围较小,同时也并没有超越厌氧氨氧化反应最适范围,因此恢复相对较快.

图3 pH值对部分反硝化耦合包埋厌氧氨氧化工艺的影响
2.3 添加PCL固体碳源提高总氮去除率
PCL是以石油为原料,人工合成的一种可生物降解聚合物(BDPs),为脂肪族聚酯.有很多研究表明,PCL具有良好的可生物降解性以及生物相容性[17],因此PCL被广泛应用于生物反硝化,能够有效降解水中的硝酸盐氮.且有研究显示,PCL具有碳源缓释,过程易控制的特点[18],这也为PCL的实际应用提供了先决条件.本实验采用PCL作为固体碳源,将PCL颗粒采用流离球加细网的方式将100g左右的PCL颗粒固定于反应器上部,以用来将厌氧氨氧化反应产生的硝态氮去除,从而提高反应器的总氮去除率.Chu等[19]将PCL作为生物反硝化固定床载体,通过反硝化作用去除水中的NO3--N,通过数据分析得出,每去除lgNO3--N, PCL的消耗量约为1.6~3.7g.由此可以得出,本实验部分反硝化耦合厌氧氨氧化反应器出水NO3--N约为6.5mg/L,而本反应器水力停留时间(HRT)为4h,因此,投加100g PCL颗粒能够至少运行267d.添加PCL后反应器的进出水时情况如图4所示.
在反应器运行的第139d向反应器中投加PCL,可以看出,初始由于反应器中异养反硝化细菌主要分布于反应器下部,上部较少,因此细菌分解PCL的能力较差,少量PCL能够转移到液相中,因此反硝化效果一般,出水NO3--N浓度并没有明显降低.随着运行时间的增长,反硝化效果快速提高,由于反硝化细菌生长较快,在运行12d后,出水NO3--N已接近0.此后继续稳定运行,反应器表现良好, PCL的添加使得反应器TN去除率由原先的79.4%提升至88.3%.可以看出在部分反硝化耦合厌氧氨氧化的基础上进一步耦合以PCL为固体碳源的全程反硝化能够成功实现并稳定运行.这也将为氮素废水的处理提供一个新思路.在反应器运行174d时,取出少量PCL可以发现大量反硝化生物附着生长于PCL颗粒上,这一结果与大多数研究一致[20].

图4 添加固体碳源后耦合反应器的出水以及TN去除率的变化
3 结论
3.1 经过94d, 在包埋厌氧氨氧化连续流反应器的基础上成功耦合了部分反硝化,厌氧氨氧化所需电子供体完全来自于部分反硝化所产生的NO2--N.耦合参数COD/ NO3--N比值最佳范围为2.3~2.7.此范围内NTR值高达63.5%,且同时 NO3--N的去除率稳定在98.4%左右.
3.2 进水pH值提升至8.0和8.5后,耦合效果不断下降,NTR值下降至49.4%.当还原进水pH值后,经过约11d耦合效果得到迅速恢复.
3.3 添加固体碳源进一步耦合全程反硝化,仅运行12d后,全程反硝化得到成功启动.厌氧氨氧化反应所产生的 NO3--N得到全部去除,TN去除率也由原来的80.3%提升至88.5%.运行一段时间后,发现有大量反硝化生物膜附着生长于PCL颗粒上.
[1] Zhu W, Li J, Dong H, et al. Effect of influent substrate ratio on anammox granular sludge: performance and kinetics [J]. Biodegradation, 2017,28(5/6):437-452.
[2] Zhang L, Narita Y, Gao L, et al. Microbial competition among anammox bacteria in nitrite-limited bioreactors [J]. Water Research, 2017,125:249-258.
[3] Tang X, Guo Y, Jiang B, et al. Metagenomic approaches to understanding bacterial communication during the anammox reactor start-up [J]. Water Research, 2018,136:95-103.
[4] Pedrouso A, Aiartza I, Morales N, et al. Pilot-scale ELAN® process applied to treat primary settled urban wastewater at low temperature via partial nitritation-anammox processes [J]. Separation and Purification Technology, 2018,200:94-101.
[5] Wu J. Comparison of control strategies for single-stage partial nitrification-anammox granular sludge reactor for mainstream sewage treatment—a model-based evaluation [J]. Environmental Science and Pollution Research, 2017,24(33):25839-25848.
[6] Kalyuzhnyi S, Gladchenko M, Mulder A, et al. DEAMOX—new biological nitrogen removal process based on anaerobic ammonia oxidation coupled to sulphide-driven conversion of nitrate into nitrite [J]. Water Research, 2006,40(19):3637-3645.
[7] Cao S, Wang S, Peng Y, et al. Achieving partial denitrification with sludge fermentation liquid as carbon source: the effect of seeding sludge [J]. Bioresource Technology, 2013,149:570-574.
[8] Du R, Cao S, Li B, et al. Performance and microbial community analysis of a novel DEAMOX based on partial-denitrification and anammox treating ammonia and nitrate wastewaters [J]. Water Research, 2017,108:46-56.
[9] Li W, Cai Z, Duo Z J, et al. Heterotrophic ammonia and nitrate bio-removal over nitrite (Hanbon): Performance and microflora [J]. Chemosphere, 2017,182:532-538.
[10] 王维奇,王秀杰,李 军,等.包埋厌氧氨氧化的脱氮特性及其微生物群落结构[J]. 中国环境科学, 2018,38(9):3343-3350. Wang Wei-qi, Wang Xiu-jie, Li Jun, et al.Nitrogen removal characteristics and microbial community structure analysis of entrapped anaerobic ammonium oxidizing bacteria [J]. China Environmental Science, 2018,38(9):3343-3350.
[11] Li J, Zhu W, Dong H, et al. Performance and kinetics of ANAMMOX granular sludge with pH shock in a sequencing batch reactor [J]. Biodegradation, 2017,28(4):245-259.
[12] Strous M, Heijnen J J, Kuenen J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms [J]. Applied microbiology and biotechnology, 1998,50(5):589-596.
[13] 操沈彬,王淑莹,吴程程,等.有机物对厌氧氨氧化系统的冲击影响[J]. 中国环境科学, 2013,33(12):2164-2169. Cao Shen-bin, Wang Shu-ying, Wu Cheng-cheng, et al. Shock effect of organic matters on anaerobic ammonia oxidation system [J].China Environmental Science, 2013,33(12):2164-2169.
[14] 胡勇有,梁辉强,朱静平,等.有机碳源环境下的厌氧氨氧化批式实验[J]. 华南理工大学学报(自然科学版), 2007,35(6):116-119. Hu Yong-you, Liang Hui-qiang, Zhu Jing-ping, et al.Batch Experiments of Anaerobic Ammonium Oxidation Process with Organic Carbon [J].Journal of South China University of Technology (Natural Science Edition), 2007,35(6):116-119.
[15] Glass C, Silverstein J A. Denitrification kinetics of high nitrate concentration water: pH effect on inhibition and nitrite accumulation [J]. Water Research, 1998,32(3):831-839.
[16] Li W, Shan X Y, Wang Z Y, et al. Effect of self-alkalization on nitrite accumulation in a high-rate denitrification system: performance, microflora and enzymatic activities [J]. Water Research, 2016,88:758- 765.
[17] Chu L, Wang J. Nitrogen removal using biodegradable polymers as carbon source and biofilm carriers in a moving bed biofilm reactor [J]. Chemical Engineering Journal, 2011,170(1):220-225.
[18] Xu Y, Qiu T L, Han M L, et al. Heterotrophic denitrification of nitrate-contaminated water using different solid carbon sources [J]. Procedia Environmental Sciences, 2011,10:72-77.
[19] Chu L, Wang J. Denitrification performance and biofilm characteristics using biodegradable polymers PCL as carriers and carbon source [J]. Chemosphere, 2013,91(9):1310-1316.
[20] Wu W, Yang L, Wang J. Denitrification performance and microbial diversity in a packed-bed bioreactor using PCL as carbon source and biofilm carrier [J]. Applied Microbiology and Biotechnology, 2013, 97(6):2725-2733.
Study on the performance of partial denitrification coupled with anaerobic ammonia oxidation for nitrogen removal.
WANG Wei-qi, WANG Xiu-jie, LI Jun*, WANG Si-yu
(The College of Architecture and Civil Engineering, Bejing University of Technology, Beijing 100124, China)., 2019,39(2):641~647
Based on the stable immobilizing anammox reactor, the anammox coupling with partial denitrification, called DEAMOX, was successfully achieved after 94days operation with the value of NO2--N accumulation rate and the removal rate of NO3--N up to 63.5% and 98.4%, respectively. The findings revealed that the optimum ranges of COD/NO3--N for coupling reaction were 2.3~2.7. Besides, the coupling performance was weakened by the raising pH values up to 8.0 or 8.5, which was inconsistent with some published research. The immobilizing anammox further coupling whole process denitrification was achieved by adding solid carbon source of PCL into DEAMOX reactor. Subsequently, the NO3--N produced by anaerobic ammonia oxidation could be completely removed and the removal rate of total nitrogen increased from 79.4% to 88.3%. Besides, there were a large number of denitrifying biofilms attached to the surface of PCL particles.
partial denitrification;immobilization;anammox;solid carbon source
X703.5
A
1000-6923(2019)02-0641-07
王维奇(1993-),男,江苏盐城人,北京工业大学硕士研究生,主要从事污水处理与资源化方面的研究.发表论文1篇.
2018-06-21
水体污染控制与治理科技重大专项(2015ZX07202-013);北京市自然科学基金面上项目(8172012)
* 责任作者, 教授, 18811715723@163.com
