短波单胞菌(Brevundimonas sp.)A1A18对碱性土壤毒死蜱污染的修复
2019-02-26刘艳薇王新谱孙权王锐虎芳芳陈燕贾彦霞
顾 欣,刘艳薇,王新谱,孙权,王锐,虎芳芳,陈燕,贾彦霞
宁夏大学农学院,宁夏 银川 750021
毒死蜱属于有机磷类神经毒剂,兼具触杀和胃毒作用(农业部农药检定所,1989),以百余种作物害虫为靶标,毒杀效果好(Kenaga et al.,1965),成为农业生产中应用最广泛的杀虫剂之一。随着毒死蜱用量及使用面积的增加,其生态毒性越来越受到人们关注。毒理试验表明,低浓度毒死蜱可影响人类大脑的发育和功能,抑制核酸和蛋白质合成(Slotkin,1995)。高浓度毒死蜱可导致人体呼吸系统麻痹,甚至死亡(Hancock et al.,2007;Hulse et al.,2014)。栽培过程中,毒死蜱通过撒播、淋溶等方式进入土壤,促使该农药在植株体内积累,通过生物富集作用,直接威胁人类、其他生物的健康安全。目前,部分欧美国家已在某些领域全面禁用毒死蜱(Rauh et al.,2015;Centner,2018)。中国农业部宣布于2017年1月1日起在蔬菜上禁止使用毒死蜱。然而,该农药仍被允许用于水稻、小麦、棉花、果树、花生和甘蔗等作物的栽培中,加之土壤中的毒死蜱残留在短期内无法彻底降解,半衰期最长达数百天(Chai et al.,2013),仍然有进入食物链的可能性,对农业生态安全具有潜在威胁。
利用微生物降解农药残留,是一种环保、高效、低成本的生物修复方式,被证明是从土壤环境中消除有机磷农药的最可行且有效的选择。如利用黄杆菌(Flabnobacterium sp.)、节杆菌(Arthrobacter sp.)、粪产碱杆菌(Alcaligenes faecalis)、铜绿假单胞菌(Pseudomonas aeruginosa)、鞘胺醇单胞菌(Sphingomonas sp.)、克雷伯氏菌(Klebsiella sp.)和蜡状芽孢杆菌(Bacillus cereus)等细菌降解土壤、水体中的毒死蜱残留,降解率最高接近 100%(Shamsa,2016;Khalid,2016;Feng,2017;李晓慧等,2007;段海明,2012)。笔者从宁夏土壤中分离筛选出一株毒死蜱降解菌,经形态学、生理生化(东秀珠等,2002)和基因测序,将其鉴定为短波单胞菌属(Brevundimonas sp.)A1A18,NCBI编号为MK110476。该属细菌曾被发现对多种有机磷农药具有降解作用(Deshpande et al.,2004;Chanika et al.,2011;Li et al.,2008)。
土壤中毒死蜱的降解速率除了与农药初始质量浓度有关,还与复杂的土壤性质,如酸碱度、温度、湿度、质地、有机质含量、微生物活性和数量等密切相关(Singh et al.,2003;Getzin et al.,1981;Racke et al.,1996;Das et al.,2015)。研究表明,无机肥或有机肥对土壤微生物和降解菌的活性具有显著促进作用,继而促进对目标降解物的降解(Das et al.,2015;Zhang et al.,2012;Chen et al.,2015)。然而,二者配施对农药降解率及施药后土壤微生物的影响鲜见报道。
为此,本研究在探究毒死蜱降解菌短波单胞菌A1A18菌株对碱性砂壤中毒死蜱降解动态的基础上,进一步研究不同肥料与降解菌配施、不同浓度降解菌剂对土壤毒死蜱残留降解动态的影响,以及降解菌施用对土壤微生物的影响,以期为碱性土壤毒死蜱污染的微生物修复研究提供理论依据。
1 材料与方法
1.1 供试温室及土壤
试验地点位于宁夏大学农科试验基地。试验土壤来自银川市军马场未施用过毒死蜱的农田,取 0-20 cm的表层土,剔除其中的石块与植株残体,自然风干,过2 mm筛。一部分用于毒死蜱加标回收试验和盆栽试验;另一部分用于土壤基本理化性质测定。试验土壤为干旱土土纲,正常干旱土亚纲,钙积正常干旱土土类,质地砂壤,基本理化性质如表1。

表1 试验土壤基本理化性质Table1 Physicochemical properties of the tested soil
1.2 试验材料
黄瓜品种为津优35号。40%毒死蜱乳油(永农生物科学有限公司“巨雷”牌),原药质量分数为39.6%,推荐剂量为1500 mL·hm-2。毒死蜱标准品为色谱纯。
毒死蜱降解菌为短波单胞菌A1A18,由宁夏大学农业资源与环境实验室从毒死蜱污染土壤中分离筛选获得。
有机肥为羊粪基有机肥,主要原料为羊粪和秸杆,有机质质量分数45.7%,全氮、全磷、全钾的质量分数分别为28、11、15 g·kg-1。尿素为分析纯(AR),粉状。
1.3 试验方法
1.3.1 菌种活化与增殖
从菌种管中挑取单菌落,划线接种于牛肉膏蛋白胨固体培养基上,37 ℃恒温倒置培养16-18 h。挑取活化后的菌落,接种于牛肉膏蛋白胨液体培养基,37 ℃、200 r·min-1振荡培养 16-18 h,检测菌液浓度后,用无菌生理盐水稀释,制成有效活菌数为2.0×108CFU·mL-1的菌悬液,备用。
1.3.2 试验1
设置灭菌土(A1)、灭菌土+灭活降解菌(A2)、灭菌土+降解菌(A3)、未灭菌土(A4)、未灭菌土+灭活降解菌(A5)、未灭菌土+降解菌(A6)6个处理。取部分试验土壤和菌悬液,于121 ℃下高压蒸汽灭菌20 min,制备成灭菌土和灭活降解菌。在灭菌土和未灭菌土中分别拌入毒死蜱 800倍稀释液,用量为5 mL·kg-1(干土,下同),制备成污染土。将相同浓度的已灭活和未灭活的菌悬液分别与两种污染土充分混匀,使A3、A6处理土壤中降解菌密度为4×107CFU·g-1(干土,下同)。将土壤分装至营养钵(上口直径16 cm,底直径11 cm,高14 cm),装量为每钵1.0 kg,添加无菌水,使土壤含水量保持在20%。试验期间,根据日蒸发量补充无菌水。每处理设置10个重复。于施药后第0(施药后4 h)、1、3、5、7、14、21天分别取各处理0-10 cm深度的土壤样品。采用多点混合取样法采集土样,每处理取混合土样10 g,立即带回实验室,检测各处理土壤样品中的毒死蜱残留量。
1.3.3 试验2
将不同肥料、降解菌与未灭菌土混合,设7个处理,分别为添加尿素(B1)、有机肥(B2)、尿素+降解菌(B3)、有机肥+降解菌(B4)、尿素+有机肥+降解菌(B5),以不施肥只加降解菌为对照(B0),以不施肥不加菌为绝对对照(CK1)。土壤中尿素和有机肥的质量分数分别为0.2%和1%。将菌悬液与土壤充分混匀,使降解菌密度为4×107CFU·g-1。将土壤分装至营养钵中(同1.3.2)。每钵移栽1株三叶一心期、健康的黄瓜苗,培养 3 d。待植株适应后,选取长势均一的瓜苗,用小型喷洒器将 5 mL毒死蜱800倍稀释液均匀喷施于钵中土壤,不沾染叶片。每处理30株。于施药后第0(施药后4 h)、1、3、5、7、14、21天分别取各处理0-10 cm深度的根周土壤样品。采用多点混合取样法采集土样,每处理取混合土样10 g,立即带回实验室,检测各处理土壤样品中的毒死蜱残留量。
1.3.4 试验3
在自然土中添加 1%有机肥和不同数量的降解菌,设置6个处理,土壤中降解菌的初始密度分别为 2×107(C1)、4×107(C2=B4)、6×107(C3)、8×107CFU·g-1(C4),以不施降解菌为对照(C0=B2),不施毒死蜱不施菌为绝对对照(CK2)。土壤分装、瓜苗移栽、毒死蜱喷施和取土样方法同1.3.2。每处理 30株。一部分根周土壤样品用于检测毒死蜱残留量;另一部分根周土壤样品用于检测土壤微生物数量。

表2 碱性土壤中毒死蜱的加标回收率Table2 Recovery of standard addition of chlorpyrifos standard in alkaline soil
1.4 测定方法
菌体浓度:采用平板倾注法。取摇匀的 1 mL待测菌液,用无菌生理盐水进行适量稀释。将1 mL稀释菌液注入无菌培养皿中,倒入约 50 ℃的牛肉膏蛋白胨固体培养基,与菌液混匀,静置,冷凝后倒置于37 ℃恒温箱中培养24 h,对菌落进行计数。每个浓度梯度设置3个重复,计算菌液的活菌浓度。
土壤理化性质:含水量检测采用烘干法;pH值检测采用电位法;有机质检测采用重铬酸钾容量法-外加热法(鲍士旦,2000)。
土壤中毒死蜱残留量检测:从土壤中提取毒死蜱(Fang et al.,2006),采用气相色谱分析法进行检测。仪器条件为 Agilent 7980A-ECD;色谱柱HP-5石英毛细柱,30 m×0.32 mm×0.25 μm;进样口温度220 ℃,检测器温度320 ℃;程序升温测定,初始柱温80 ℃保持1 min,以15 ℃·min-1上升至 150 ℃保持 2 min,再以 6 ℃·min-1上升至270 ℃保持 2 min;载气为高纯氮气(纯度99.999%),流速为1.0 mL·min-1。进样方式为不分流进样,进样体积为 1 μL。采用外标法计算土壤样品中毒死蜱的残留量。
土壤微生物数量:鲜土样过筛(1 mm),采用土壤悬液稀释平板计数法检测土壤中可培养微生物的数量。使用牛肉膏蛋白胨琼脂培养基、马丁氏琼脂培养基和高氏I号培养基分别进行细菌、真菌和放线菌的选择性培养(沈萍等,2007)。
1.5 毒死蜱加标回收试验
取土壤样品,添加毒死蜱标准品,混合均匀,制成毒死蜱质量分数分别为 0.1、0.5、1.0、5.0 mg·kg-1的施药土壤,每个处理设置5个重复,以不添加毒死蜱为空白对照。按照1.4方法步骤检测土壤中毒死蜱残留量,计算其加标回收率。
1.6 统计分析
运用Excel 2010和Origin 9.0软件处理数据和绘图;运用Origin 9.0进行农药降解动力学方程拟合;运用SPSS 17.0软件进行方差分析,在P<0.05水平上进行差异显著性检验。
2 结果与分析
2.1 碱性砂壤中毒死蜱加标回收率
毒死蜱在碱性土壤样品中的加标回收率和相对标准偏差如表2所示。空白对照中未检测出毒死蜱残留。毒死蜱在碱性土壤样品中的平均加标回收率为91.04%-100.70%,相对标准偏差为1.91%-4.42%。表明该方法检测碱性土壤中的毒死蜱,回收率高,相对标准偏差小,符合《农药残留试验准则》(刘光学等,2004)中农药残留检测加标回收率70%-110%的要求。
2.2 碱性土壤中毒死蜱的降解动态
毒死蜱的降解动态特征如图1所示。施药后,随着时间的延长,土壤中的毒死蜱残留量呈降低趋势。其降解过程可分为两个阶段。初始阶段,即施药后至第5天,为快速降解期。灭菌土中添加降解菌(A3),毒死蜱残留的质量分数由2.505 mg·kg-1降至1.437 mg·kg-1,降解率为42.63%。未加菌的灭菌土(A1)中,毒死蜱残留的质量分数由 2.527 mg·kg-1降至 1.670 mg·kg-1,降解率仅为 33.91%。灭菌土加灭活菌(A2)中,毒死蜱残留的质量分数由 2.518 mg·kg-1降至 1.675 mg·kg-1,降解率为33.38%。未灭菌土中添加降解菌(A6),毒死蜱残留的质量分数由 2.439 mg·kg-1降至 0.902 mg·kg-1,降解率为 63.02%。但是,该阶段未灭菌土不加菌(A4)和未灭菌土加灭活菌处理(A5),毒死蜱降解率分别仅为38.72%和39.00%。说明土壤微生物参与下的毒死蜱生物降解速率显著高于非生物降解速率,降解菌的施用可显著加速毒死蜱的降解。无论是灭菌土还是未灭菌土,添加灭活菌对土壤毒死蜱降解的影响与未添加处理均无显著差异。随着时间延长,土壤毒死蜱残留量的变化曲线趋于平缓,降解过程逐渐进入慢速阶段。

图1 灭菌和未灭菌碱性土壤中添加灭活、未灭活降解菌对毒死蜱残留量的影响Fig.1 Effects of inactivated and active degrading bacteria on chlorpyrifos residues in autoclaved and non-autoclaved alkaline soil
利用一级动力学模型(孔德洋等,2014)对毒死蜱在碱性土壤中的降解过程进行拟合:

式中,t为采样距离施药的时间差,d;Ct为经t时间降解的毒死蜱残留量,mg·kg-1;C0为施药后毒死蜱的初始沉积量,mg·kg-1;k为降解速率常数,d。由表3可知,决定系数R2为0.9775-0.9872,均大于0.9500,试验浓度下的毒死蜱在碱性土壤中的降解符合一级动力学模型。
试验结果表明,毒死蜱在灭菌土壤中的降解速率明显低于未灭菌土壤,在未添加降解菌土壤中的降解速率显著低于添加降解菌土壤。至施药后第21天,无菌土 A1和 A2处理的毒死蜱降解率仅为68.98%和71.09%,半衰期分别为10.74 d和10.30 d。灭菌土加降解菌(A3)的毒死蜱半衰期为7.04 d。有菌土(A4)的降解率为76.40%-88.81%,半衰期为 4.09-8.17 d。土壤中天然生存着大量土著微生物,可分解利用土壤中的碳源、氮源、无机盐等物质,并成为土壤自身净化能力的主要生物因素。灭菌土壤与未灭菌土壤相比,毒死蜱残留降解速率显著下降,半衰期延长,表明土壤中的土著微生物对毒死蜱具有一定降解能力。土壤中添加毒死蜱降解菌,显著提高了土壤中毒死蜱的降解速率,缩短了半衰期,说明无论是土著微生物还是施加降解菌对毒死蜱的降解均具有显著促进作用。其中,灭菌土添加降解菌(A3)的毒死蜱降解率比未灭菌土(A4)的稍高,但差异未达到显著水平,说明单独依靠土著微生物或降解菌 A1A18,对土壤中毒死蜱的降解作用均是有限的。土壤中添加灭活菌对毒死蜱半衰期的影响与不添加处理无显著差异。降解菌作为生物体,添加量较少,故土壤中有机物含量变化幅度较小,对土壤中毒死蜱的吸附和降解无显著影响。

表3 碱性土壤中毒死蜱降解的动力学方程与半衰期Table3 Dynamics equation and half-life of chlorpyrifos degradation in alkaline soil

表4 尿素、有机肥与降解菌的不同配施处理下碱性土壤中毒死蜱降解的动力学方程与半衰期Table4 Dynamics equation and half-life of chlorpyrifos degradation in alkaline soil of different fertilization treatments of urea, organic fertilizer and degrading bacteria
2.3 不同施肥处理对碱性土壤中毒死蜱降解动态的影响
为接近实际耕作条件,试验2采用喷施法施用毒死蜱。由表4可知,该喷施方法使表层0-10 cm土壤中毒死蜱的初始质量分数为 2.508-2.592 mg·kg-1,略高于试验 1土壤混匀法(2.499-2.506 mg·kg-1)。
施药后,随着时间延长,各处理的土壤毒死蜱残留量逐渐下降,通过一级动力学模型计算出的半衰期具有差异。由图2可知,在毒死蜱快速降解期,单施 0.2%尿素(B1)、1%有机肥(B2)的毒死蜱降解率分别为41.46%和42.73%,降解速率常数为0.085和 0.090,较未施肥 CK1的农药降解率(38.36%)和降解速率常数(0.082)有所提高,且二者之间无显著差异。施用降解菌各处理,无论是否与肥料配施,均对毒死蜱的降解具有显著促进作用。单施降解菌B0,降解菌与肥料配施的B3、B4、B5降解率分别为57.32%,69.08%、74.55%、72.89%,降解速率常数为0.148,0.221、0.252、0.257,显著高于CK1和单一施肥处理。与单施降解菌B0比较,降解菌与不同肥料配施对毒死蜱的降解具有更强的促进作用。因此,图2中毒死蜱的降解动态可分为3组。第1组最慢,包括未施肥CK1和单施肥的B1、B2,半衰期为7.73-8.17 d;第2组为单施菌的B0,半衰期为4.69 d,降解较快;第3组为降解菌与肥料配施的B3、B4和B5,半衰期为2.69-3.13 d,降解最快。可见,将尿素、有机肥与降解菌配施可显著提高土壤中毒死蜱的降解速率。在碱性土壤中施用 0.2%尿素、1%有机肥,对土壤酸碱度调节,有机质含量、速效养分提升等方面具有积极的影响,可以促进土著微生物和降解菌的代谢,与未施肥处理相比,加速了土壤中毒死蜱的降解,对碱性土壤毒死蜱污染具有较好的消除作用。
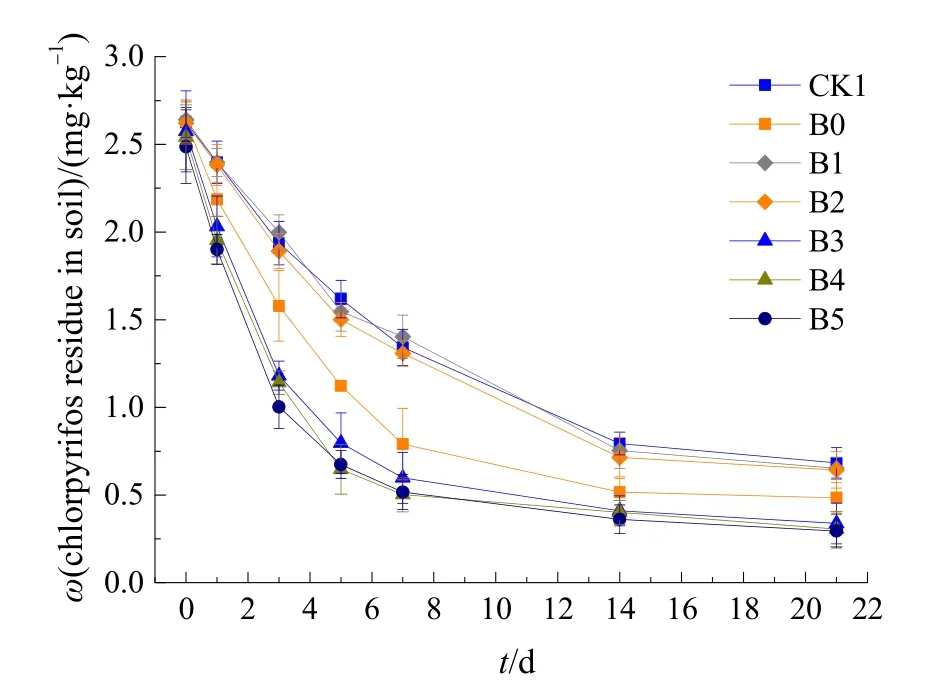
图2 尿素、有机肥与降解菌的不同配施处理对碱性土壤中毒死蜱残留量的影响Fig.2 Effects of different fertilization treatments of urea, organic fertilizer and degrading bacteria on chlorpyrifos residues in alkaline soil

表5 降解菌不同施用量对碱性土壤中毒死蜱残留量的影响Table5 Effects of different application rates of degrading bacteria on chlorpyrifos residue in alkaline soil mg·kg-1
2.4 降解菌不同施用量对碱性土壤中毒死蜱降解动态的影响
碱性土壤中施用不同数量的降解菌 A1A18,毒死蜱残留的降解动态具有差异。如表 5所示,施菌各处理的毒死蜱残留量较未加菌的CK0减少。施药后第 1天,除最低施用量(初始菌落密度为 2×107CFU·g-1)C1的农药残留量与C0无显著差异外,其他各处理均显著低于C0。随着降解菌对环境的适应和降解作用的发挥,施药后第 3-21天,各处理的农药残留量均显著低于CK0。尤其在第3-14天,土壤毒死蜱残留量与降解菌施用量呈反比。最低施用量 C1处理,毒死蜱一级动力学方程为Ct=2.573e-0.159t,半衰期为4.33 d;C2的半衰期为2.74 d。施用降解菌的初始密度分别为 6×107CFU·g-1(C3)和8×107CFU·g-1(C4)的处理毒死蜱降解速率最快,半衰期分别为1.87 d和1.70 d,至施药后21 d,降解率分别达到90.71%和91.65%,差异不显著。由此可知,碱性土壤中毒死蜱残留降解的快慢与降解菌施用量在一定范围内具有相关性。
2.5 降解菌不同施用量对碱性土壤微生物的影响
施用农药后,土壤中的可培养细菌、真菌和放线菌的数量受到不同的影响。施用不同浓度的降解菌,对土壤微生物也具有一定的影响,如图3所示。
试验环境涉及毒死蜱和作物栽培、有机肥的施用,因此,土壤细菌数量变化是多因素综合表现的结果,如图3A所示。未施用毒死蜱的CK2,由于作物生长和有机肥双重影响,土壤细菌数量呈增加趋势。施用毒死蜱后,C0的细菌数量显著下降,至第5天较对照降低65.14%。随后,细菌数量缓慢回升,至第 21天恢复至正常水平。加降解菌的各处理,土壤细菌数量在前期均表现为不同程度的下降。随着时间延长,各处理的细菌数量趋于稳定。添加降解菌数量越大,土壤中细菌总数越多,且都高于CK2的水平。

图3 降解菌不同施用量对碱性土壤中可培养细菌(A)、真菌(B)和放线菌(C)数量的影响Fig.3 Effects of different application rates of degrading bacteria on the number of culturable bacteria (A), fungi(B) and actinomycetes (C)in alkaline soil
施药后1 d,土壤真菌数量较CK2显著增加,如图 3B 所示,增幅大小顺序为:C0>C1>C2>C3>C4,其中单施农药未施降解菌的 C0增幅最高(26.05%)。随着降解菌施用量的增加,C1至C4处理增幅逐渐减小,分别为21.01%、15.97%、13.45%和7.56%。说明细菌型降解菌的施用,对土壤真菌数量的增加具有一定抑制作用。土壤真菌大量增加的持续时间较短,到第 3-5天各处理已基本恢复至初始水平。随着施药后天数的增加,真菌数量呈缓慢降低的趋势,至21 d,各处理的土壤真菌数量与对照组无显著差异。
如图3C所示,施用毒死蜱后,土壤放线菌的数量变化可分为3个阶段。第1个阶段是施药后至第1天,放线菌受到抑制而数量下降。第2阶段,第 2-7天,在毒死蜱的刺激下,放线菌数量快速增长至最高值。比较第7天的放线菌数量,未加菌C0较 CK2增加了31.51%,而加菌各处理较 CK2增加了37.68%-48.06%,即随着降解菌施用数量的提高,放线菌数量有增加的趋势。随后进入第3阶段,放线菌数量缓慢下降,至21 d各处理均降至对照水平。放线菌数量的增加,可能是因为其他微生物数量下降,为其提供了更多的生存空间;或是受碱性环境中毒死蜱及其分解产物的刺激,出现增殖现象,相关机制有待进一步研究。
3 讨论
试验用土壤样品为碱性砂壤,有机质含量低,组成成分较为简单,毒死蜱在其中的平均加标回收率为91.04%-100.70%,相对标准偏差≤4.42%,表明试验方法的准确度、精确度可用于检测碱性砂壤中毒死蜱的残留量。
毒死蜱是二烷基磷酸酯类农药,其水解反应是亲核加成反应,反应速度随着介质中 OH-基团浓度的增加而增加。因此,毒死蜱在中性和弱酸性环境中较为稳定,而在碱性环境中易降解(方华,2007)。试验结果表明,毒死蜱在碱性土壤中的降解包括非生物降解过程和生物降解过程,后者主要是土壤微生物作用,与已有研究结果一致(Chishti et al.,2013)。从动力学角度分析,在pH为8.57的强碱性土壤中,毒死蜱的降解过程符合一级动力学方程,由模拟方程可知毒死蜱的半衰期,非生物降解过程为10.74 d,生物降解与非生物降解综合过程为8.17 d。Racke(1996)研究表明,不同土壤中毒死蜱的半衰期差异很大,土壤的物理、化学和生物学性质都会影响其降解速率,同样是砂壤,碱性环境中的毒死蜱半衰期显著低于酸性和中性环境,半衰期为17-126 d。李界秋等(2007)在pH为6.02的酸性砂壤土施用毒死蜱,其半衰期仅为9.8 d。由于试验土壤和试验条件等各方面均存在差异,如土壤机械组成、酸碱度、含水率、微生物类群和底物初始质量浓度、光照条件、是否种植作物等多种因素影响,本试验土壤中毒死蜱残留的半衰期与他人研究结果不同,但处于较低水平,可能与毒死蜱施用环境为强碱性、砂壤且农药初始质量浓度较低等因素有关。
从降解机制上看,土著微生物和降解菌可将毒死蜱快速降解为中间产物3, 5, 6-三氯-2-吡啶酚(3,5, 6-trichloro-2-pyridinol,TCP),并最终代谢成为简单的小分子化合物(Žabar et al.,2016;John et al.,2015)。Dumas(1989)从缺陷短波单胞菌(B.diminuta)中提取获得磷酸三酯酶,该酶可降解多种有机磷农药。Gorla et al.(2009)利用分子生物学技术,证明该菌的有机磷水解酶定位于细胞内膜的周质一侧,通过双精氨酸转运通路进行有机磷水解,故推测本试验菌株——短波单胞菌 A1A18降解毒死蜱的机制可能与此有关。本试验中未灭菌土毒死蜱残留的降解率较灭菌土高出7.42%;施用降解菌A1A18的毒死蜱降解速率常数为0.170,半衰期缩减至4.09 d,降解率达88.81%。由此进一步证实微生物降解作用是土壤中毒死蜱残留降解的重要途径之一。
毒死蜱可以作为部分微生物的唯一碳源(Silambarasan et al.,2013;Deng et al.,2015),但是大部分微生物的降解作用属于共代谢作用(Sethunathan et al.,1973;钱博等,2007),需要从毒死蜱外的其他物质中获得能量。因此,人为添加外源营养物可以支持土著微生物和降解菌的增殖与活性需求。试验结果证实,尿素或有机肥的添加对毒死蜱的降解具有一定促进作用,但外源降解菌的促进作用更强,使毒死蜱的降解速率常数由 0.082(对照)增至0.148(单施降解菌),说明该毒死蜱降解菌的功能特性较强,具有较好的田间应用潜力。
尿素、有机肥及二者配施可以促进土壤微生物的增殖与活性(Tejada et al.,2014;姬兴杰等,2008),其中有机质对毒死蜱具有一定吸附作用(Singh et al.,2003)。本试验土为砂壤,有机质含量低,尿素或有机肥的施用对土著微生物和降解菌的数量增加及其功能发挥都具有显著促进作用。综合表现为,在施用降解菌 A1A18时,与有机肥配施提高了农药降解率,且效果优于无机肥。但是,两种不同肥料混合配施与有机肥配施对毒死蜱降解过程的影响差异不显著,说明两种肥料对土壤毒死蜱降解的促进作用不具有叠加效应。另一方面,降解菌A1A18施用浓度与目标降解物的降解速率在一定范围内具有相关性。可能是降解菌浓度过低,对农药的整体降解效率也较低。反之,降解菌浓度过高,受土壤营养和目标降解物浓度的限制,农药的整体降解效率也受到限制。因此,对土壤中残留毒死蜱进行微生物修复需添加适宜浓度的降解菌。本试验条件下,降解菌A1A18初始密度为6×107CFU·g-1时,与1%有机肥或与0.2%尿素+1%有机肥配施,毒死蜱的降解效率达到最高。
由上可知,在碱性砂壤中施用低浓度的毒死蜱,一方面砂质土壤结构、强碱性环境和土著微生物都有利于毒死蜱的降解,另一方面,适宜浓度的降解菌在外加碳源、氮源的促进下,较充分地发挥了毒死蜱降解作用。因此,在实验环境中添加降解菌 A1A18并配施有机肥,对毒死蜱具有较好的降解效率。
在一般施药水平下,随着施药后时间的延长,受抑制的微生物数量会逐渐恢复至正常水平(Shan et al.,2006;刘新等,2004;Pozo et al.,2010)。本研究中,毒死蜱施用初期,细菌数量出现不同程度的下降。降解菌不是试验用土的土著细菌,一方面受碱性环境的影响,另一方面,施入土壤的降解菌浓度越高,细菌死亡的数量越多。至于毒死蜱对土壤细菌是否具有毒性,还有待进一步研究。试验中真菌和放线菌数量显著增加,其中真菌对毒死蜱的反应较快但增幅较小,放线菌的反应较慢但增幅较大,变化趋势与已有研究结果相似(Chen et al.,2014;Dua et al.,2015)。究其原因,一方面由于真菌数量的下降,导致其他微生物获得更多的生存空间;另一方面,放线菌和真菌的某些种类在碱性环境中对低浓度毒死蜱具有较好的抗性,在毒死蜱刺激下出现增殖现象,相关机制还有待进一步研究。随着施药后时间的延长,土壤中毒死蜱残留量逐渐减少,各类微生物数量逐渐趋于正常水平。作物栽培和有机肥施用有利于土壤微生物多样性,抑制土壤“真菌化”趋势(Hartmann et al.,2015)。至施药后第 21天,细菌和放线菌数量较绝对对照多,真菌数量呈降低趋势。因此,当降解菌与肥料配施,总体表现为随着施菌浓度的增加,毒死蜱残留降解加速,有助于快速消除环境中毒死蜱残留对土壤微生物的影响。
4 结论
(1)碱性土壤中毒死蜱的降解过程分为生物降解过程和非生物降解过程,其降解动态可采用一级动力学模型(Ct=C0·e-kt)进行模拟研究。
(2)不同浓度的降解菌和不同肥料施用,主要改变毒死蜱的降解速率,直接导致不同处理条件下毒死蜱半衰期发生变化,最终影响毒死蜱在土壤中的累积效应。
(3)短波单胞菌 A1A18对强碱性土壤中残留毒死蜱的降解能力较好,可作为相关土壤修复剂的功能菌株。
(4)降解菌A1A18初始密度为6×107CFU·g-1时,与 1%有机肥配施或与 0.2%尿素+1%有机肥配施,可显著促进碱性土壤中残留毒死蜱的降解速率,快速消除毒死蜱对土壤微生物的影响,可作为毒死蜱污染土壤的微生物修复实施方案。
