纳米锌对杀鲑气单胞菌的灭活效果及其细胞毒性❋
2019-02-21王晓璐于晓清盖春蕾叶海斌刘洪军王勇强
刁 菁, 李 乐, 王晓璐, 许 拉, 于晓清, 盖春蕾, 樊 英, 叶海斌❋❋ , 刘洪军, 王勇强
(1. 山东省海洋生物研究院,山东 青岛 266104; 2.山东省海水养殖病害防治重点实验室,山东 青岛 266104; 3.日照市万泽丰渔业有限公司,山东 日照 250000)
杀鲑气单胞菌(Aeromonassalmonicida)是导致冷水鱼疖疮病及皮肤溃疡病的病原菌,其宿主范围广,包含至少5个亚型,是冷水鱼养殖过程中危害较重的一种常见致病菌[1-3],对于该菌的防治技术研究一直是国内外关注焦点。目前,鱼用疫苗是公认最安全有效的防病途径,特别是针对大型深海网箱及养殖工船等装备型养殖模式,如果在入海前对鱼体实施疫苗免疫,能够提高鱼体对特定病原的抗病力,从而降低深海养殖过程中的疾病发生率。在水产疫苗工业中最为常用的形式是灭活疫苗, 例如弧菌、气单胞菌和草鱼呼肠孤病毒等灭活疫苗的免疫保护性非常明显[4-6]。灭活是灭活疫苗生产中最关键、最基本的技术之一, 抗原灭活效果的好坏与灭活剂息息相关, 理想的灭活应是灭活病原彻底并保持抗原的免疫原性,免疫疫苗后机体产生良好的免疫保护, 同时无论对鱼类还是人类, 均不产生安全问题。化学灭活剂甲醛是最传统且应用最广泛的灭活剂,但是存在刺激性、致癌危险、破坏免疫原性、灭活不彻底、灭活时间长、灭活效果受多种因素影响等缺陷[7], 因此筛选较甲醛更优良的灭活剂已成为当前灭活疫苗研制中需要解决的迫切课题, 对于生产高效、安全的灭活疫苗具有十分重要的意义。
锌是一种动物必需的微量元素,多项研究表明锌能够影响动物的生长、发育、免疫、成骨以及代谢功能[8-9]。同时,锌还具有良好的抗菌作用,特别是利用纳米技术研制的纳米锌抗菌剂,它具有表面效应、体积效应及量子尺寸效应等一系列纳米材料特有性质,能大大提升传统锌材料的抗菌性能,对于革兰氏阳性菌、革兰氏阴性菌以及真菌和病毒等均显示出显著的杀灭作用[10-11],并且纳米锌作为一种新型锌源,具有良好的生物相容性,同时还具有较高的生物活性、良好的免疫调节能力和高吸收率。由于其性状稳定、资源丰富且对环境无毒害作用,目前已推广应用于医药、畜牧、公共卫生等多个领域。
鉴于以上纳米锌优良的特性,为了探究纳米锌用于制备水产动物细菌灭活疫苗的可行性,本研究测定了纳米锌溶液在不同条件下对杀鲑气单胞菌的灭活作用,检测了纳米锌灭活对杀鲑气单胞菌菌体蛋白和免疫原性影响,制备出杀鲑气单胞菌纳米锌灭活疫苗并与甲醛灭活疫苗的免疫保护效果进行了比较,另外研究了纳米锌溶液对鱼类细胞生长及增殖的影响。研究结果为鱼用灭活疫苗的研制及应用提供了新思路。
1 材料与方法
1.1 实验材料
杀鲑气单胞菌为本实验室分离保藏的菌株;鲤上皮瘤 (Epithelioma papulosum cyprini,EPC) 细胞由山东省出入境检验检疫局惠赠;健康硬头鳟(Oncorhynchusmykiss)由日照万泽丰渔业有限公司提供,平均体重为(105±5) g,平均体长为(20±2) cm。
纳米锌水溶液原液(浓度为50 g/L)由南京精德丰新材料科技有限公司研制,其中纳米锌粒径为30~80 nm;M199培养基、胎牛血清、胰蛋白酶为Gibco公司产品;阿尔玛蓝购自美国Invitrogen公司;96孔细胞培养板购自美国Corning公司;Mueller-Hinton(MH)肉汤和琼脂购自青岛海博生物有限公司;上样缓冲液购自索莱宝公司;AP标记羊抗鼠Ig购自Sigma公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳及其他化学试剂均购自上海生物工程有限公司。
1.2 不同条件下纳米锌对杀鲑气单胞菌的灭活效果
待灭活细菌的准备:将MH肉汤中过夜培养的杀鲑气单胞菌室温6 000 r/min离心10 min,细菌沉淀用生理盐水(0.9% NaCl溶液)重悬,再离心收集沉淀,重复2次,最后用生理盐水重悬并调整细菌浓度至1.5×109个/mL,分装于50 mL离心管内,每管30 mL。
纳米锌灭活实验:共设置4个纳米锌灭活浓度,即用生理盐水将纳米锌原液进行稀释并分别加入上述离心管内充分混匀,最终管内纳米锌终浓度分别为50、100、200和400 mg/L,对照管加入等体积生理盐水。然后将每个灭活管内菌液分为3等份,分别放置于4、28及37 ℃条件下进行灭活。每隔12h,从各灭活管内取1mL菌液,离心收集沉淀并用生理盐水洗涤2次去除纳米锌,然后取重悬后的菌液涂布MH琼脂培养板,每个处理涂布3个平板,每板涂布100 μL。将平板置于28 ℃培养箱内,培养48 h后观察并记录细菌生长情况。剩余菌液用于菌体蛋白及免疫原性的检测。
1.3 纳米锌对杀鲑气单胞菌菌体蛋白及免疫原性的影响
1.3.1 SDS-PAGE检测纳米锌对杀鲑气单胞菌菌体蛋白组成的影响 根据1.2实验结果,在收集的不同浓度及不同温度条件下,最短灭活时间的纳米锌灭活菌液及未灭活的对照菌液中,按体积比1∶4加入4×上样缓冲液,沸水中煮沸10 min,冷却后点样进行SDS-PAGE;电泳凝胶由浓度为12%分离胶和浓度为5%浓缩胶两部分组成;采用Tris-Gly电泳缓冲液(0.025 mol/L Tris,0.25 mol/L Gly,0.1% SDS,pH=8.3),4 ℃稳流条件下电泳,浓缩胶30 mA,分离胶60 mA,至溴酚蓝指示剂迁移至分离胶底部边缘时停止电泳;将凝胶放入固定液中固定1h,然后用考马斯亮蓝(CBB-R250)染色4h,放入7%乙酸脱色液中脱色,拍照。
1.3.2 扫描电镜检测纳米锌对杀鲑气单胞菌菌体结构的影响 在6 000 r/min、4 ℃条件下离心20 min,分别收集50和400 mg/L浓度纳米锌在不同温度下灭活的菌体,用2.5%戊二醛前固定, 1%锇酸后固定, 磷酸缓冲液冲洗, 梯度乙醇脱水, 临界点干燥后喷金, 经AMRAY-1830 型扫描电镜进行观察。
1.3.3 间接ELISA检测纳米锌对杀鲑气单胞菌免疫原性的影响 离心收集培养至指数生长期的杀鲑气单胞菌,将菌体密度调整至5×107CFU/mL,参考张铭伟等[12]方法以全菌免疫小鼠制备鼠抗杀鲑气单胞菌多克隆血清抗体。同时,在4 ℃条件下离心收集4种浓度纳米锌在不同温度下最短时间灭活的菌体及未灭活的对照菌体,并用生理盐水调整浓度至OD600为0.1±0.01,然后加入酶标板中4 ℃包被过夜;次日加入3%的牛血清白蛋白(BSA)溶液,37 ℃下封闭45 min;去除封闭液,用PBST洗3次,每次5 min;加入鼠抗杀鲑气单胞菌血清(1∶200),37 ℃ 孵育1 h(间或轻轻震荡),阴性对照为免疫前小鼠血清; PBST洗3次后,加入AP标记羊抗鼠Ig,37 ℃下孵育1 h;PBST洗3次后,将pNPP发色液加入酶标板发色30 min,2 mol/L NaOH终止发色,酶标仪405 nm测OD值。
1.4 杀鲑气单胞菌纳米锌灭活疫苗的免疫保护力测定
根据1.3结果,选择对杀鲑气单胞菌菌体蛋白及免疫原性影响最小的纳米锌灭活参数,制备出纳米锌灭活疫苗;同时利用0.1%的甲醛溶液在28 ℃条件下对杀鲑气单胞菌灭活5 h,经平板涂布培养法验证已彻底灭活,制备出甲醛灭活疫苗;然后将2种灭活疫苗浓度调整至OD600为0.1±0.01,利用腹腔注射的方法分别免疫健康虹鳟,每尾100 μL,对照组注射同体积的无菌生理盐水,每组免疫30尾,每组设3个重复,养殖水温为(17±1) ℃,全天充气,每天换水50%;免疫后40 d用杀鲑气单胞菌进行攻毒,每尾腹腔注射浓度为5.0×107CFU/mL的菌液100 μL;每天定时观察并记录各实验组鱼体死亡数量,计算2种灭活疫苗对杀鲑气单胞菌感染的相对免疫保护率。
1.5 纳米锌对鲤上皮瘤(EPC)细胞毒性的研究
将纳米锌溶液用M199培养基(含2%胎牛血清)2倍梯度稀释至浓度为100、200、400、800、1 600和3 200 mg/L,然后分别与密度为2.5×106个/mL的EPC细胞悬液1∶1混合均匀,接种于96孔细胞培养板中,每孔200 μL,每个处理设3个重复,置于20 ℃培养,12 h后观察细胞贴壁情况,3 d后观察细胞存活情况,6 d后在每个孔内加入10 μL阿尔玛蓝指示剂,置于20 ℃培养4 h,用酶标仪在570 nm测定波长下和605 nm参考波长下测定OD值,计算细胞活性值。
2 结果
2.1 不同温度条件下纳米锌对杀鲑气单胞菌的灭活效果
在3个不同温度条件下分别加入不同浓度的纳米锌,经过不同时间孵育处理杀鲑气单胞菌后,菌体存活情况经测定显示,加入的纳米锌浓度越高,其对杀鲑气单胞菌完全灭活的时间越短,同时随着作用温度的升高,纳米锌对菌体完全灭活的时间缩短(见表1)。400、200、100 和50 mg/L浓度的纳米锌分别在72、96、108和120 h之内可以将杀鲑气单胞菌完全灭活;同样浓度纳米锌在不同温度下对细菌的灭活时间不同,其中在37 ℃条件下纳米锌灭活时间最短,4种浓度纳米锌均可在60 h内将细菌完全灭活,400 mg/L纳米锌在24 h内即可将细菌完全灭活;其次为28 ℃条件下,4种浓度纳米锌均可在96 h内将细菌完全灭活;灭活作用最慢的为4 ℃条件下,完全灭活时间最短为72 h,最长达到120 h。

表1 不同浓度纳米锌在不同温度下孵育处理杀鲑气单胞菌不同时间后菌体的存活情况
注:+表示细菌存活,-表示细菌死亡。Note: + means alive bacteria, - means inactivated bacteria.
2.2 纳米锌对杀鲑气单胞菌菌体蛋白及免疫原性的影响
2.2.1 SDS-PAGE检测纳米锌对菌体蛋白的影响 将收集的不同浓度及不同温度条件下,最短灭活时间的纳米锌灭活菌体收集进行SDS-PAGE,凝胶经考马斯亮蓝染色后观察灭活菌体蛋白组成及浓度变化,如图1所示,不同条件下纳米锌灭活的杀鲑气单胞菌菌体蛋白组成及浓度与未经纳米锌灭活的杀鲑气单胞菌相同,没有出现蛋白条带丢失或蛋白浓度明显降低的现象。
2.2.2 扫描电镜观察纳米锌对菌体形态的影响 利用扫描电镜分别观察了50和400 mg/L浓度纳米锌在不同温度下灭活的菌体形态,如图2所示,在4和28 ℃灭活条件下,2种浓度纳米锌对菌体完整性的破坏程度相差不大,灭活后的菌体大部分保持了原有的完整结构,仅出现少量细菌碎片,但37 ℃灭活条件下,灭活后的菌体结构破坏较明显,视野中出现较多的菌体碎片。

(M. 蛋白Marker;1.正常细菌对照; 2. 400 mg/L-4 ℃-72 h灭活菌体; 3. 400 mg/L-28 ℃-60 h灭活菌体; 4. 400 mg/L-37 ℃-24 h灭活菌体; 5. 200 mg/L-4 ℃-96 h灭活菌体; 6. 200 mg/L-28 ℃-72 h灭活菌体; 7. 200 mg/L-37 ℃-36 h灭活菌体; 8. 100 mg/L-4 ℃-108 h灭活菌体; 9. 100 mg/L-28 ℃-84 h灭活菌体; 10. 100 mg/L-37 ℃-60 h灭活菌体; 11. 50 mg/L-4 ℃-120 h灭活菌体; 12. 50 mg/L-28 ℃-96 h灭活菌体; 13 50 mg/L-37 ℃-60 h灭活菌体。M. Marker; 1. normal bacteria as control; 2. 400 mg/L-4 ℃-72 h inactivated bacteria; 3. 400 mg/L-28 ℃-60 h inactivated bacteria; 4. 400 mg/L-37 ℃-24 h inactivated bacteria; 5. 200 mg/L-4 ℃-96 h inactivated bacteria; 6 200 mg/L-28 ℃-72 h inactivated bacteria; 7. 200 mg/L-37 ℃-36 h inactivated bacteria; 8 100 mg/L-4 ℃-108 h inactivated bacteria; 9. 100 mg/L-28 ℃-84 h inactivated bacteria; 10. 100 mg/L-37 ℃-60 h inactivated bacteria; 11. 50 mg/L-4 ℃-120 h inactivated bacteria; 12. 50 mg/L-28 ℃-96 h inactivated bacteria; 13. 50 mg/L-37 ℃-60 h inactivated bacteria.)
图1 不同浓度纳米锌在不同温度条件下最短时间灭活菌体的SDS-PAGE结果
Fig.1 The SDS-PAGE of inactivated bacteria with shortest time under different concentrations of nanometer zinc and temperature

(A1. 50 mg/L-4 ℃-120 h灭活菌体; A2. 50 mg/L-28 ℃-96 h灭活菌体; A3. 50 mg/L-37 ℃-60 h灭活菌体; B1. 400 mg/L-4 ℃-72 h灭活菌体; B2. 400 mg/L-28 ℃-60 h灭活菌体; B3. 400 mg/L-37 ℃-24 h灭活菌体。A1. 50 mg/L-4 ℃-120 h inactivated bacteria; A2. 50 mg/L-28 ℃-96 h inactivated bacteria; A3. 50 mg/L-37 ℃-60 h inactivated bacteria; B1 400 mg/L-4 ℃-72 h inactivated bacteria; B2 400 mg/L-28 ℃-60 h inactivated bacteria; B3 400 mg/L-37 ℃-24 h inactivated bacteria.)
图2 扫描电镜检测不同浓度纳米锌在不同温度条件下灭活菌体的形态
Fig.2 Scanning electron microscopic image of inactivated bacteria under different concentrations of nanometer zinc and temperature
2.2.3 ELISA检测纳米锌对菌体抗原性的影响 利用制备的抗血清结合ELISA技术检测不同灭活条件下杀鲑气单胞菌抗原性结果显示,与包被未灭活菌体的对照组相比,4 ℃条件下各纳米锌浓度灭活组菌体抗原性均未受到显著性影响,然而在28 ℃条件下,200和400 mg/L纳米锌灭活组菌体抗原性显著低于对照组,而在37 ℃条件下除50 mg/L浓度组外,其它3个浓度灭活组抗原性均显著低于对照组。在4和28 ℃条件下,不同浓度纳米锌灭活菌体的抗原性没有显著性差异,而在37 ℃条件下,不同浓度纳米锌灭活菌体的抗原性受到不同程度的影响,其中400 mg/L纳米锌灭活组菌体抗原性显著低于50 mg/L灭活组(见图3)。

图3 不同灭活条件对杀鲑气单胞菌菌体抗原性的影响
2.3 杀鲑气单胞菌纳米锌灭活疫苗的免疫保护力
根据以上结果,从灭活效率及疫苗抗原性保持的效果出发,选择100 mg/L-28 ℃为杀鲑气单胞菌纳米锌灭活疫苗制备条件。为了比较纳米锌与甲醛灭活全菌疫苗的免疫保护效果,在免疫后40 d以杀鲑气单胞菌活菌进行攻毒。攻毒后,注射生理盐水组的鱼体在攻毒后第2天便开始出现死亡,并且鱼体在接下来的一周内出现大量死亡,直至攻毒后第10天死亡率达到96.7%。2个免疫组鱼体的死亡率显著低于对照组,在攻毒后第10天纳米锌与甲醛灭活菌体免疫组鱼体的死亡率分别为13.3%与20%,计算其免疫保护率分别为86.2%与79.3%,2个免疫组均表现出较好的免疫保护效果(见图4)。攻毒受感的鱼体表现出腹鳍基部充血发红、肛门突出、肌肉出血、肠道出血等杀鲑气单胞菌感染的典型临床症状,并能从受感死亡鱼体中再次分离到该菌株。

图4 纳米锌与甲醛灭活的杀鲑气单胞菌菌苗的免疫保护效果
2.4 纳米锌对鲤上皮瘤(EPC)的细胞毒性
将悬浮的EPC细胞与不同浓度的纳米锌溶液混合后接种于细胞培养板中,观察细胞贴壁及生长情况,如表2所示,高浓度1 600 mg/L纳米锌溶液会影响细胞的正常贴壁,低于800 mg/L浓度的纳米锌溶液不会影响细胞正常贴壁(见图5),但是800 mg/L浓度纳米锌处理后的细胞逐渐收缩脱壁趋于死亡(见图5);利用阿尔玛蓝指示剂测定6 d后EPC细胞活性,发现与对照组相比,浓度低于400 mg/L纳米锌溶液对细胞生长及代谢无显著影响,浓度高于800 mg/L纳米锌溶液会影响细胞正常增殖代谢。
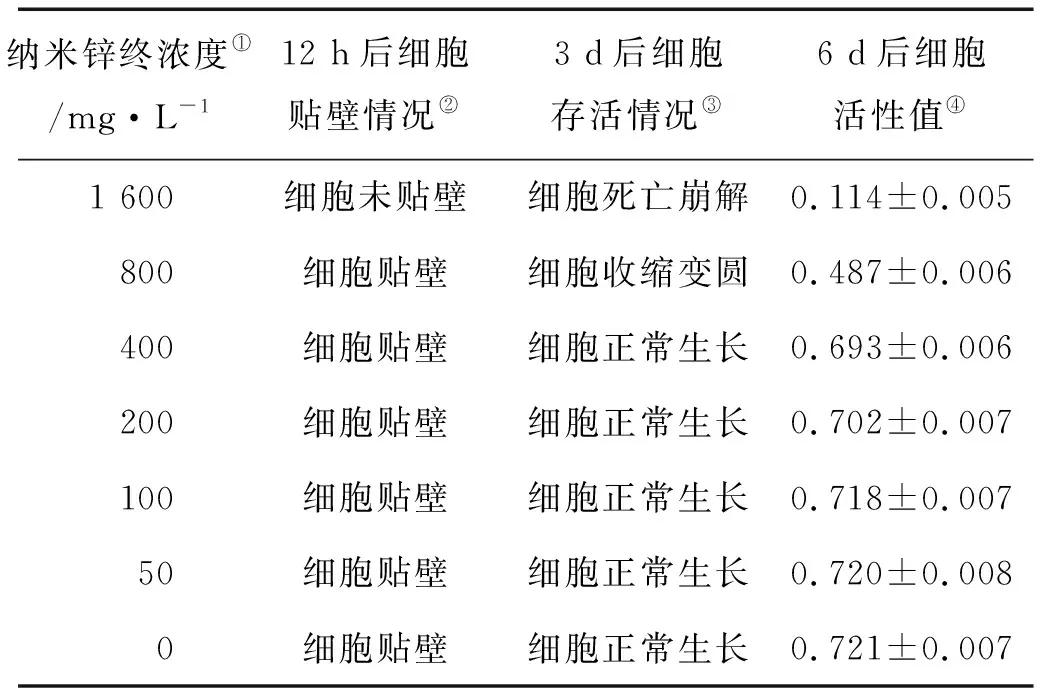
表2 不同浓度纳米锌对EPC细胞贴壁及生长的影响
Note:①Concentration of anometer zinc;②Cell adherence after 12 h;③Cell growth after 3 d;④Cell viability after 6 d

(A. 400 mg/L纳米锌孵育后细胞正常贴壁;B. 1 600 mg/L纳米锌孵育后细胞无法贴壁;C. 400 mg/L纳米锌孵育后3天细胞正常生长;D. 1 600 mg/L纳米锌孵育后3天细胞死亡。标尺=20 μm。A. normal adherence of cells post incubation with 400 mg/L Nano-Zn; B. un-adherent cells post incubation with 1 600 mg/L Nano-Zn; C. Normal growth of cells on day 3 post incubation with 400 mg/L Nano-Zn; D. all cells died on day 3 post incubation with 1 600 mg/L Nano-Zn. Bar=20 μm.)
图5 不同浓度纳米锌作用下的EPC细胞形态
Fig.5 The EPC cell morphology under different concentrations of nanometer zinc
3 讨论
纳米锌是一种新型高功能精细无机材料,粒径在1~100 nm之间,因其特有的表面效应、小尺寸效应和宏观量子隧道效应,使得纳米锌具有无法比拟的特殊性能和用途,其在中性环境中无需光照即可表现出显著的抗菌活性,目前该材料已逐渐被应用于医疗、保健、卫生等多个领域,已成为无机抗菌剂研究的热点[13]。本文首次将纳米锌材料作为水产动物病原菌的灭活剂进行尝试使用,实验结果显示纳米锌对杀鲑气单胞菌具有明显的杀灭效果,其杀菌活性的强弱与纳米锌的浓度密切相关。前期研究结果同样显示,在纳米锌粒径相同的情况下,其抗菌活性会随着浓度的增加而增强[14]。前期研究还表明相同浓度纳米锌对不同种类的细菌具有不同的抑杀效果,Xie等[15]比较研究了纳米锌对4种食物源性病原菌的抑杀效果,结果显示纳米锌在0.5 mg/mL的浓度下即可在3 h内灭活108CFU/mL的空肠弯曲菌(Campylobacterjejuni),相比而言大肠杆菌O157∶H7对纳米锌的杀菌活性具有更强的耐受性。高艳玲等[16]也研究证实,纳米锌对枯草芽孢杆菌(Bacillussubtilis)的抑制能力最强,其次是伤寒沙门氏菌(Salmonellatyphi)、大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus),然而对李氏杆菌(Listeriamonocytogenes)没有明显抑制作用。本研究结果显示不同浓度的纳米锌在不同温度条件下均能有效灭活杀鲑气单胞菌,只是在灭活时长上存在一定差异。分析造成纳米锌对不同细菌灭活效果差异的原因,一方面是由于菌种本身的遗传特性差异决定其对纳米锌的耐受度不同,也有可能会由于不同学者使用的纳米锌颗粒的粒径差异影响其抗菌活性。前期已有研究发现纳米锌抗菌效果与粒径大小相关,一般认为是粒径越小的纳米锌抗菌活性越强[17-19]。另外,本研究还发现随着温度的升高纳米锌对杀鲑气单胞菌的灭活能力有着显著的提升,然而目前有关温度影响纳米锌抗菌活性的机理未有研究报道,我们推测升高温度可促进纳米锌与细菌生物大分子的互作,进而增强其对细胞生物活性分子的破坏[20]。
利用理化方法灭活制备全菌疫苗都会不同程度地对菌体抗原性造成破坏,进而降低疫苗的免疫原性与免疫保护效果[21],因而如何最大限度地保留菌体抗原性是一切灭活策略应该首要考虑的技术问题。本研究结果显示,各浓度纳米锌在不同温度条件下灭活处理并未造成菌体蛋白的明显缺失与变化,说明利用纳米锌杀灭菌体是一种相对温和的灭活方法。然而,扫描电镜与ELISA检测结果发现当高浓度纳米锌在高温条件下处理菌体,可不同程度地对引起菌体破损,且免疫原性也会在一定程度上受到影响。高浓度纳米对菌体抗原性的影响可能与其抗菌机理密切相关,已有研究证实,纳米锌的抗菌机理主要存在4种可能的方式:(1)通过释放的离子与带电的细菌细胞壁之间的静电相互作用;(2)锌离子的释放或活性氧(ROS)的形成造成细菌细胞膜的破坏;(3)锌离子或者ROS的形成破坏细菌细胞的DNA和蛋白质合成;(4)由于膜的破坏,细胞内容物泄漏可导致细胞膜收缩,细胞裂解[22]。因而,在利用纳米锌制备全菌灭活疫苗时,还应该基于菌体破坏情况及抗原影响情况选择最为温和、高效的灭活策略。
纳米锌由于其具有良好的生物相容性,对人体、养殖动物及环境无毒害作用,加之其具有抗红外、紫外和杀菌的功能,在很多领域尤其是在与人类生存和健康密切相关的方面有着独特的优势,将会给人类的医疗和健康带来巨大的贡献[20]。目前评价纳米材料生物毒性的方法包括体内和体外2种,其中体外评价是一种重要的毒性检测手段,一般以组织或细胞为试验对象,这种检测方法快速、简便、组间差异小[23-24]。本研究主要从体外细胞贴壁、形态以及细胞活性三个方面,评价了纳米锌对鱼类细胞的毒性。结果显示,浓度低于400 mg/L的纳米锌溶液对鱼类EPC细胞的生长及代谢无显著影响,而该浓度水平的纳米锌对杀鲑气单胞菌却能表现出较强灭活效果,说明纳米锌对生物细胞具有一定的选择毒性。石慧等[25]研究发现,在半滑舌鳎饲料中添加适量的纳米锌可不同程度地提升鱼体胰脏及肠道消化酶的活性,而未对鱼体健康状态产生明显的毒副作用。另有研究显示,在半滑舌鳎基础饲料中添加纳米锌时,既可以提高半滑舌鳎的生长性能,又可以提高其非特异性免疫力,同时对其肝脏影响较小[26]。因此,利用低浓度的纳米锌作为灭活剂应用于鱼类全菌灭活疫苗的制备不会存在安全性问题。
当前世界范围内,全菌灭活疫苗仍是开展细菌性疫病免疫防控的主流免疫制剂,因此筛选一种安全有效的灭活制剂建立科学高效的灭活策略对于促进全菌灭活疫苗的研制与应用具有重要价值。甲醛是目前应用最广泛的化学灭活剂,但是由于其在安全性及灭活效果方面存在一定的不足[7], 因此筛选较甲醛更优良的灭活剂具有重要的实际意义。本研究结果显示,纳米锌对杀鲑气单胞菌具有良好的灭活效果,且免疫保护实验结果发现纳米锌灭活全菌疫苗显示出较甲醛灭活全菌疫苗更好的免疫保护效果,说明纳米锌灭活对菌体抗原性的破坏较甲醛更为温和,且用于灭活的纳米锌浓度远远低于其毒性浓度,从疫苗制备工艺及安全性上也优于甲醛。
4 结语
本文研究了纳米锌对杀鲑气单胞菌的灭活作用及其细胞毒性,发现纳米锌是一种安全、优良的疫苗灭活剂,具有潜在应用价值。研究结果为高效、安全渔用灭活疫苗的研制提供了数据和参考。
