化学链重整中铈基载氧体的热分析动力学研究
2019-02-18高妍妍朱津锌
张 浩,田 煜,高妍妍,朱津锌,王 力,徐 龙
(西北大学化工学院,碳氢资源清洁利用国际科技合作基地,陕西省洁净煤转化工程技术研究中心,陕西西安 710069)
化学链重整技术(chemical-looping reforming,CLR)是基于化学链燃烧技术(chemical-looping combustion,CLC)而提出的一种新型合成气制备技术,该技术利用载氧体中的晶格氧来代替分子氧,为燃料提供所需的氧元素[1-5]。其反应过程为:第一步在燃料反应器中甲烷与载氧体发生部分氧化反应生成合成气;第二步在氧化反应器中被还原的载氧体被氧化,恢复含氧量。相比于传统的甲烷部分氧化重整(POM)制合成气工艺,该工艺在相对较低的温度下进行反应,整个体系为微放热过程,减少了能量消耗;甲烷和氧不直接接触,避免了爆炸危险;使用载氧体中的晶格氧代替氧气,避免了纯氧设备的使用,节省了资金成本[6-8]。
设计和制造合适的高活性载氧体是实现甲烷化学链重整工艺的关键问题之一。一般来说,载氧体必须具有高反应活性、高输氧能力、高选择性和优异的氧化还原性能[9-10]。铈基载氧体由于其良好的储氧性能,晶格氧活动能力,较高的反应活性,越来越多地受到研究者的关注[11]。He等[12]通过添加Fe、Cu、Mn制备了一系列铈基复合载氧体,结果发现,Ce-Fe-O复合载氧体的n(H2):n(CO)接近2:1,具有优异的合成气制备性能。Zhu等[13-14]设计了化学链蒸汽甲烷重整过程,制备了CeO2-Fe2O3(n(Ce)/n(Fe)=1)复合载氧体,通过研究发现850℃下,氧化铈和氧化铁之间形成了CeFeO3,该物质的形成显提高了晶格氧的移动性。Miller等[15]发现将CeO2添加至Fe2O3中,Fe3+进入氧化铈晶格之中,形成了立方CeO2固溶体,增强了Fe2O3的还原性。Galvita等[16]及任广行等[17]研究发现铈铁复合载氧体通过金属氧化物之间的相互作用可以提高金属的分散度,提高载氧体的反应活性以及循环稳定性。
化学动力学是研究化学反应速度及其影响因素的学科,而动力学参数在反应器设计和反应机理预测中具有重要意义。最普遍的做法是使用一组独立的方程来适应在一定反应条件下得到的实验数据,并用最合适的方程来解释还原机理[18]。Lin等[19]对氢还原氧化铁的机理进行了研究,根据Avarmi-Erofeev模型,通过H2-TPR谱图提出了二维成核机理模型为Fe3O4→Fe。Monazam等[20]对甲烷还原赤铁矿进行了动力学研究,基于一阶不可逆速率动力学和成核及生长过程的Avarmi方程用于还原数据。Lu等[21]通过热重分析仪(TGA)法对磁铁矿载氧体进行了动力学研究,发现利用相界面控制模型可以描述新鲜磁铁矿向方铁矿转化的还原机理,而焙烧后的磁铁矿则为一维成核和生长与扩散机制控制。
本文利用甲烷进行化学链重整中的铈基载氧体,以氢气为探针,对其进行了程序升温还原实验(H2-TPR)和热重分析实验(TGA),基于氢气程序升温还原与热重分析的谱图,利用非定温单升温速率法对铈基载氧体的还原反应动力学进行了分析,并计算出了相应模型的活化能和指前因子。
1 实验步骤与动力学方程
1.1 载氧体的制备
采用共沉淀法制备铈铁混合氧化物载氧体,其中n(Ce):n(Fe)为7:3。制备过程过程如下:称取适量的Fe(NO)3·9H2O(AR,广东光华科技股份有限公司)和Ce(NO)3·6H2O(AR,上海山浦化工有限公司)溶于100mL去离子水中,配成0.1mol/L的溶液,用蠕动泵(Longer-Pump YZ1515X)以0.2r/min的速率将30%的浓氨水缓慢滴加在上述溶液中,并在30℃的恒温水浴锅(DF-101S集热式恒温加热磁力搅拌器,郑州科丰仪器设备有限公司)中不断搅拌,溶液中逐渐会有沉淀生成,当pH值为9~10时停止滴加,然后超声、抽滤,并在抽滤过程中用蒸馏水洗、乙醇洗后,取出沉淀物放入110℃电热恒温鼓风干燥箱(DGG-9030B,上海森信实验仪器有限公司)中干燥12h,然后在马弗炉(KSL-1200X,合肥科晶材料技术有限公司)中900℃下焙烧6h,最后研磨筛分得到粒径为0.45~0.9mm的Ce7Fe3Oδ载氧体样品。在相同条件下制备纯CeO2载氧体作为对照。
1.2 载氧体的表征
载氧体的H2还原热重分析采用耐驰公司的Netzsch STA449F3型差热分析仪。实验用载氧体10mg,以10℃/min升温速率从20℃升至950℃,H2气体流速为10mL/min,吹扫气为氮气,流速170mL/min;保护气为氮气,流速20mL/min。
程序升温还原(H2-TPR)使用天津先权公司生产的TP 5080全自动吸附仪。载氧体质量50mg,反应温度从100℃升至950℃,升温速率10℃/min,使用惰性气体N2作为载气,还原气体H2流量为1.5mL/min,均热导桥流为90mV。
1.3 动力学方程的建立与分析方法
对非等温非均相体系的热分析动力学研究基本沿用了等温均相体系条件下的动力学方程。在本文所进行的实验中载氧体颗粒与H2气体分子接触发生反应,这是一个气固反应为非均相体系,而在载氧体的H2还原热重分析和程序升温还原过程中,采用线性升温的方法,其为变温过程。对于非均相反应的热分析动力学研究,将均相反应体系中的浓度c替代为转化率α。于是,经过转换后的非均相反应的动力学方程形式[22]为:

非等温反应热分析法中常采用等速升温的方法,即升温速率β为常数。

Vallet提出在动力学方程中对d t进行置换,转化后的非等温非均相反应动力学方程形式如下。
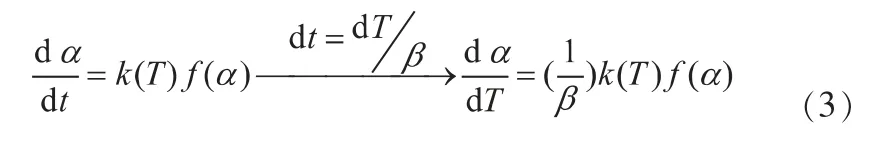
而定量表示速率常数k与温度T的关系可用阿伦尼乌斯(Arrhenius SA)方程。

从而可以得到非等温非均相体系的动力学方程,表达式如下:
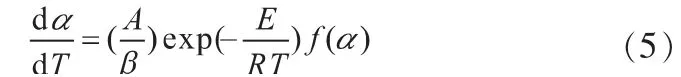
将上式进行左右移项,两边分别在0到α和T0到T之间进行积分,而在开始反应时,反应温度较低,反应速率不计,这样积分区间可以用0-T代替T0-T[23],从而得到:
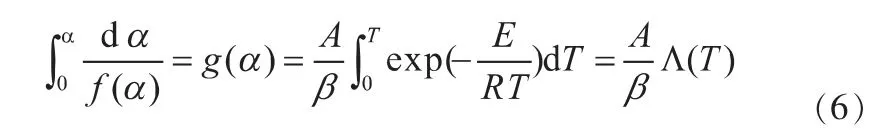
式中,α为给定时刻载氧体的转化率,t为反应进行时间,A为指前因子,E为表观活化能,R为气体常数,T为反应温度,为转化率函数积分,为温度积分[24-25]。设,带入 得:
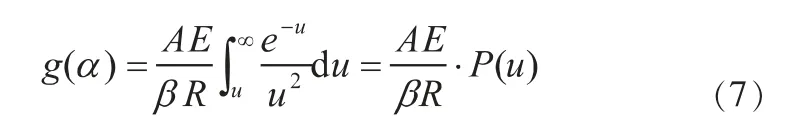
通过分部积分得到[26]:

结合(6)、(7)则得到:
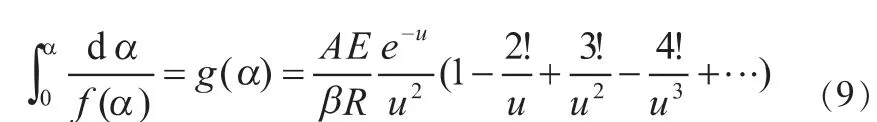
对上式右端括号内取前两项,并对两端取对数,就会得到Doyle一级近似式[27],然后通过斜率和截距求得表观活化能E和指前因子A。

非定温法热分析动力学通常包括单个扫描速率的非定温法和多重扫描速率的非定温法[28]。而在本实验中只得到了载氧体的单条程序升温热失重曲线,所以采用单升温速率法来进行动力学分析,机理函数采用模型配合法进行匹配。常用的气固反应动力学模型函数f(α)及相应的积分函数g(α)如表1所示[29-32]。

表1 常用的气固反应动力学模型函数
2 动力学结果与讨论
2.1 CeO2载氧体氢气还原热重动力学
图1为CeO2载氧体的氢还原曲线,上部分为H2-TPR曲线,下部分为H2-TG曲线。由H2-TPR曲线可将其分为两个温度段,400~608℃和608~950℃,不同固气反应动力学模型分段拟合后g(α)与1/T之间的相关性系数见表2。从表中可看出,温度为400~608℃与608~950℃时,分别用化学反应模型(n=3)和化学反应模型(n=2)进行线性相关分析时,得到的相关性系数最高。因此,CeO2载氧体还原反应过程在400~608℃温度段内属于化学反应模型(n=3)反应,而在608~950℃温度段内属于化学反应模型(n=2)反应。由实验数据得到两个温度段在两种不同的动力学模型下ln[g(α)]与1/T的拟合曲线,如图2所示。
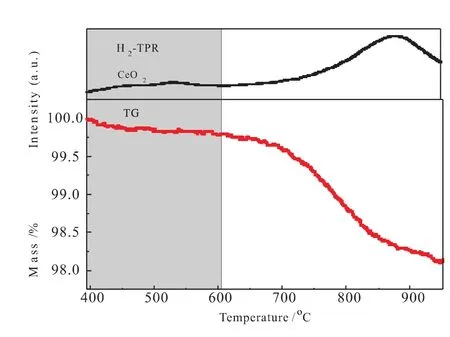
图1 CeO2载氧体氢还原曲线

表2 CeO2不同还原温度段g(α)和1/T之间的相关性系数
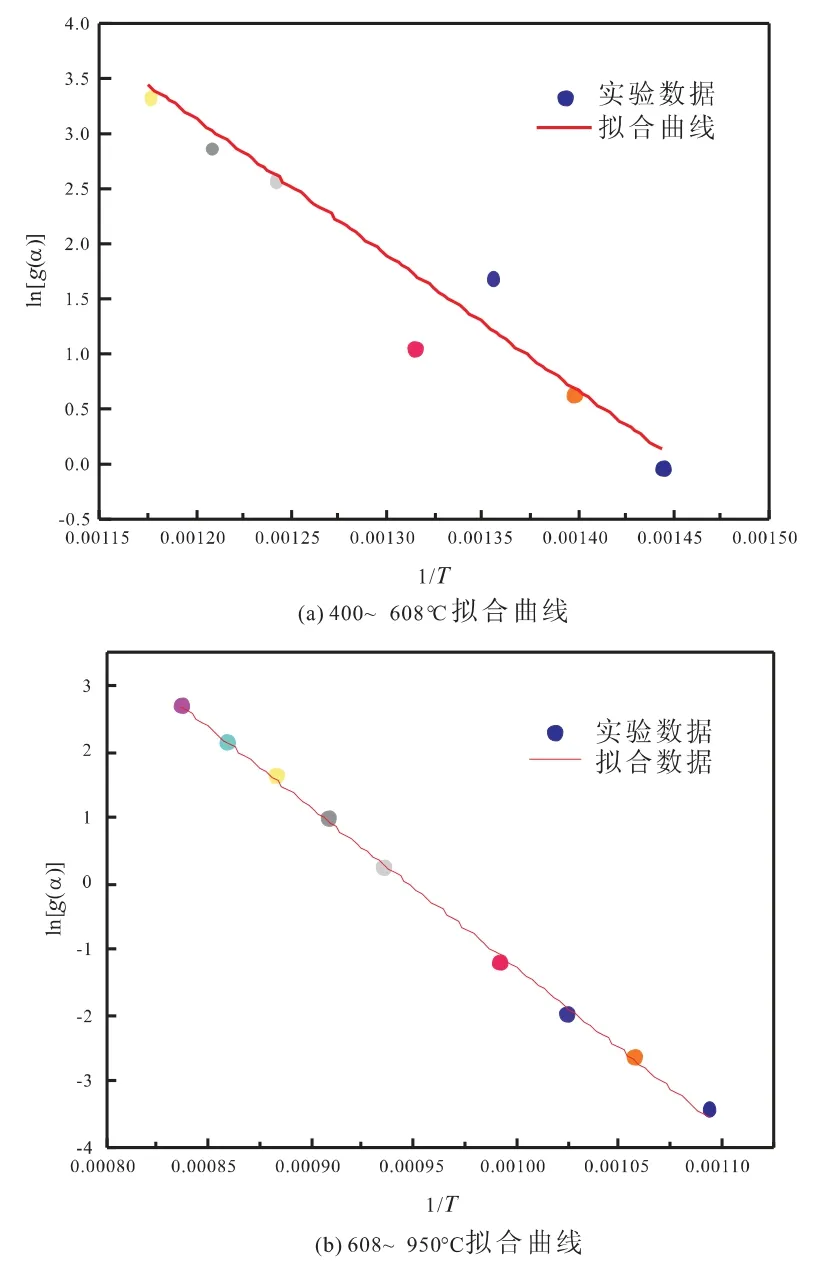
图2 CeO2不同还原温度段ln[g(α)]对1/T的拟合曲线
升温速率均为10℃/min,关联CeO2载氧体的H2-TPR曲线和热失重曲线,对CeO2载氧体的程序升温还原分析表明,400~608℃温度范围为表面吸附氧的还原段,608~950℃为体相晶格氧的还原段。由拟合曲线的斜率和截距可以计算出反应动力学参数如表3所示,其活化能分别为98.1293kJ·mol-1和192.4854kJ·mol-1,表明表面吸附氧相比于晶格氧更容易还原。
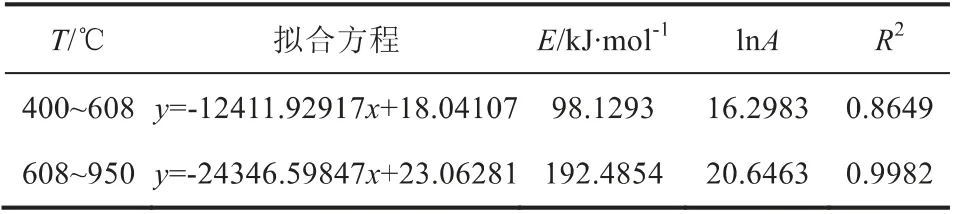
表3 最佳动力学模型的计算结果
2.2 Ce7Fe3Oδ载氧体氢还原热重动力学
图3为Ce7Fe3Oδ载氧体的氢还原曲线,根据H2-TPR曲线可将其分为四个温度段,100~360℃、360~495℃、495~675℃和675~950℃,而在100~360℃温度范围内,H2-TPR图谱上没有明显还原峰,热失重较小,因此只对余下的三个还原温度段的不同气固反应动力学模型进行分段拟合,拟合后g(α)与1/T之间的相关性系数见表4。从表中可看出,温度为495~675℃和675~950℃时都是化学反应模型(n=2)的相关性系数最高,而温度为360~495℃时收缩核模型(柱对称)的相关性系数最高。因此,Ce7Fe3Oδ载氧体还原过程在495~675℃和675~950℃两个温度范围内属于化学反应模型(n=2)反应,而在360~495℃温度范围内属于收缩核模型(柱对称)反应。对相应的动力学模型,由实验数据得到三个温度段ln[g(α)]与1/T的拟合曲线,如图4所示。

图3 Ce7Fe3Oδ载氧体氢还原曲线
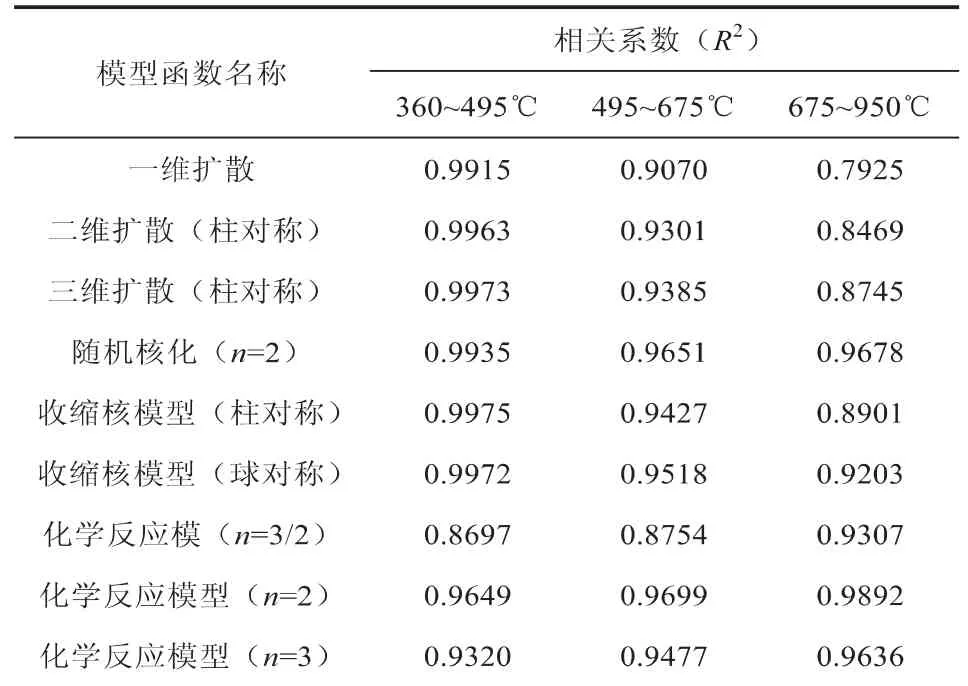
表4 Ce7Fe3Oδ不同还原温度段g(α)和1/T之间的相关性系数
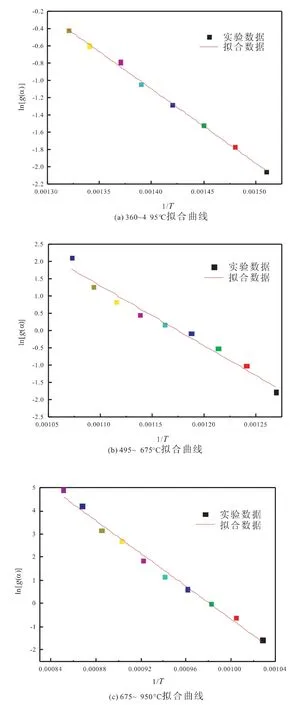
图4 Ce7Fe3Oδ不同还原温度段ln[g(α)]对1/T的拟合曲线
由于升温速率为10℃/min,关联Ce7Fe3Oδ载氧体的H2-TPR曲线和热失重曲线,对Ce7Fe3Oδ载氧体的程序升温还原分析表明,360~495℃温度段为Fe2O3→Fe3O4的 还 原 过 程,495~675℃温 度 段 为Fe3O4→FeO的还原过程,675~950℃温度段为CeO2体相晶格氧被还原以及FeO→Fe的还原过程。由拟合曲线的斜率和截距可以计算出反应动力学参数如表5所示,其活化能分别为67.8879kJ·mol-1、137.07 kJ·mol-1以及278.8759 kJ·mol-1。

表5 最佳动力学模型的计算结果
3 结论
铈铁载氧体的H2还原反应动力学为逐级进行的,随着温度的升高,各阶段的活化能不断增加。对比图2和图4载氧体CeO2和载氧体Ce7Fe3Oδ的H2气氛热失重曲线看出,随着铁含量的增加,载氧体最大失重率逐渐增大,分别达到1.98%和8.09%,且Ce7Fe3Oδ相比于CeO2更早进入热失重稳定阶段。
利用单升温速率法对铈铁载氧体的还原反应动力学进行了分析,并对不同反应机制下的ln[g(α)]与1/T的线性相关性进行了拟合,结果表明对于CeO2载氧体在400~608℃温度范围内适用于化学反应模型(n=3),在608~950℃温度范围内适用于化学反应模型(n=2)。对于Ce7Fe3Oδ载氧体在495~675℃和675~950℃两个温度范围内适用于化学反应模型(n=2),而在360~495℃温度范围内适用于收缩核模型(柱对称)。
基于氢气程序升温还原(H2-TPR)与热重分析(TGA)的谱图分析,通过分段拟合得到了CeO2和Ce7Fe3Oδ载氧体在各个反应阶段的动力学模型、活化能以及指前因子。相对于总包反应动力学研究,更深一步分析了载氧体的反应动力学,虽然没有得到其他载氧体的热分析动力学数据使之进行对比性分析,但这种TG-TPR联合法对载氧体动力学的研究具有创新性意义。
