发酵大豆中产碱性蛋白酶菌株鉴定及其部分酶学性质研究
2019-02-16魏婷婷周桂旭石亚伟
魏婷婷,周桂旭,石亚伟
(山西大学 生物技术研究所,教育部化学生物学与分子工程重点实验室,山西 太原 030006)
碱性蛋白酶(Alkaline protease,AP)是一类最适作用pH为碱性的蛋白酶,可水解肽键、酯键、酰胺键。在洗涤剂中用于蛋白污垢如奶渍、血渍、汗渍等的去除;在食品行业可水解动植物蛋白;在生物技术领域,用于核酸纯化过程中蛋白质的去除,如海洋弧菌X4B-7分离的碱性蛋白酶可解聚组蛋白,降解DNA酶[1]。微生物是碱性蛋白酶生产的重要来源,目前用于工业化生产的菌种主要为芽孢杆菌,如枯草芽孢杆菌、地衣芽孢杆菌、短小芽孢杆菌,嗜碱性芽孢杆菌等[2]。从舟山海域海泥中筛选到产碱性蛋白酶的海洋放线菌A20,其酶活达104.7 U/mL[3],烟台近海土壤中筛选到一株产碱性蛋白酶的解淀粉芽孢杆菌,其酶活达155 U/mL[4],高盐环境中分离出的普鲁兰类酵母,产酶活性为7.2 U/mL[5],从发酵食品中分离出产碱性蛋白酶的短小芽孢杆菌,其酶活为43.67 U/mL[6]。自然界中分离出的产碱性蛋白酶的菌株其产酶活性一般都较低,往往通过菌种诱变、培养基优化、基因工程等手段来提高蛋白酶活性。我国碱性蛋白酶主要生产菌地衣芽孢杆菌2709通过诱变育种、 培养条件优化,最终使碱性蛋白酶酶活比原初提高了170%[7-8];洗毛用枯草芽孢杆菌通过培养基优化使蛋白酶活性提高了33.19%[9];侧孢短芽孢杆菌中胞外蛋白酶BLG4基因克隆到枯草芽孢杆菌WB600中,其酶活是出发菌株的2.58倍[10];嗜碱性芽孢杆菌PB92中碱性蛋白酶基因分别在大肠杆菌和枯草芽孢杆菌中表达,结果显示在枯草芽孢杆菌中比在大肠杆菌中所得酶活高6.8倍[11]。
微生物碱性蛋白酶的分子量多数在18~35kDa之间[12]。以酪蛋白为底物,pH值为7.0~11.0时,碱性蛋白酶有较高的酶活性[13]。碱性蛋白酶的最适温度分布范围较广,多数碱性蛋白酶耐热性不好,有些菌株产生的碱性蛋白酶的最适温度较高,但是不耐高温。如假单胞菌KFCC10818产生的碱性蛋白酶的最适作用温度是70℃,但在70℃保温15 min完全失活[14]。大多碱性蛋白酶发挥作用需要金属离子激活,如Ca2+,Mg2+,Mn2+等,芽孢杆菌属碱性蛋白酶KP-43具有3个钙离子结合位点,其热稳定性与3个钙离子结合位点密切相关[15]。
芽孢杆菌具有良好的分泌特性,其发酵工艺和产物回收技术也较成熟,是近年常用作外源蛋白的分泌型宿主菌[16]。本文以大豆自然发酵的菌群为出发点,筛选分离产蛋白酶的活力较高野生菌株,并对菌株进行分子分类鉴定,进一步利用PCR技术分离碱性蛋白酶基因,在枯草芽孢杆菌中进行重组表达和酶学活性分析。
1 材料
1.1 材料与试剂
吕梁临县栽培黄豆(晋豆21);pBE2R质粒,克隆菌株E.coli×10,表达菌株WB600均为实验室保存;限制性内切酶KpnⅠ、限制性内切酶XbaⅠ、DNA Marker以及EasyPfu DNA Polymerase、T4 DNA Ligase均为北京全式金生物技术有限公司产品;卡那霉素、氨苄青霉素为Sigma公司产品;其他试剂均为国产分析纯。
1.2 培养基
LB液体培养基:蛋白胨1%(质量分数,下同),NaCl 1%,酵母粉0.5%。LB固体培养基:在LB液体培养基基础上添加琼脂粉1.5%。脱脂奶粉平板培养基:酵母粉0.5%,蛋白胨1%,NaCl 1%,琼脂粉1.5%,脱脂奶粉2%。发酵产酶培养基:糊精1%,可溶性淀粉2%,酵母粉 1%,NaCl 0.5%,pH值为7.0[17]。
2 方法
2.1 产酶菌株的筛选
称取100 g黄豆,将黄豆在100℃水中煮30 min,然后捞出沥水后,放在培养皿中,不加盖置于室温下培养,直至豆粒表面产生黏稠状物质,吸取少量黏稠状物质于1.5 mL EP管中,加入少量无菌去离子水混匀,梯度稀释菌悬液。分别吸取100μL不同稀释梯度的菌悬液均匀涂布于含脱脂奶粉培养基平板上,37℃的恒温培养箱中过夜培养。挑选透明圈直径与菌落直径比值较大的单菌落于5 mL的LB培养基中,37℃,200 r/min过夜培养,按2%的接菌量转接于发酵产酶培养基中,置于37℃的恒温振荡培养器中,200 r/min培养24 h,测定发酵液的酶活。
2.2 产酶菌株培养及基因组DNA提取
将复筛所得菌株37℃过夜培养,取5 mL过夜培养菌液,13 000 r/min 离心2 min,弃上清,收集菌体,置于-20℃冰箱中保存备用。基因组DNA提取方法及操作见文献[18]。
2.3 产酶菌株的鉴定
选用细菌16SrRNA基因扩增通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-TACCTTGTTACGACTT-3’)以2.2中提取的基因组DNA为模板进行PCR扩增,PCR反应程序为:95℃预变性3 min,95℃变性30 s,55℃退火30 s,72℃延伸1 min 30 s,30个循环,72℃延伸10 min,将扩增产物与pEASY-Blunt Zero载体连接并转入大肠杆菌DH5α,筛选出阳性克隆并送测序。将测序所得16SrRNA基因序列在GeneBank中进行Blast,利用MEGA5.0软件,绘制系统发育树[19]。
2.4 枯草芽孢工程菌构建及重组酶液制备
参照Genbank报道的纳豆芽孢杆菌中碱性蛋白酶的基因序列(AP011541.2)设计引物,上游引物:5’-GGGGTACCATTATAGGTAAGAGAGGAATGTACACATGAGAAGCAAAAAATTG-3’(下划线部分为加入的KpnⅠ酶切位点),下游引物:5’-GCTCTAGATTATTGTGCAGCTGC-3’(下划线部分为加入的XbaⅠ酶切位点)。以2.2中提取的基因组DNA为模板,扩增碱性蛋白酶基因。将AP的PCR扩增产物经限制性内切酶KpnⅠ和XbaⅠ双酶切后连接经相同酶切后的质粒pBE2R,然后转入DH5α感受态细胞,筛选转化子质粒,将转化子质粒送北京六合华大基因科技有限公司测序。将测序正确的重组质粒pBE2R-AP经Spizizen低盐环境感受态转化法[20-21]转入枯草芽孢杆菌WB600过夜培养,挑取单菌落,接种于LB液体培养基中,37℃,200 r/min过夜培养,按2%的接菌量转接于发酵产酶培养基中,37℃,200 r/min振荡培养84 h,将发酵液12 000 r/min离心10 min,上清液即为粗酶液,用于酶学性质研究。
2.5 碱性蛋白酶活力的测定
2.5.1 菌落水解圈
用灭菌枪头吸取1 μL过夜培养的菌液点于脱脂奶粉平板中,于37℃恒温培养箱中培养24 h,在脱脂奶粉平板上直接观察是否有透明水解圈出现,并用尺子测定透明圈直径与菌落直径。
2.5.2 参照轻工业部颁标准QB-T1803-93(Folin试剂显色法[22])
1 mL酶液1 min水解酪素产生1 μg酪氨酸所需要的酶量为1个酶活力单位,以U/mL表示。
2.6 重组蛋白酶部分酶学性质研究
2.6.1 酶的最适作用pH和pH稳定性
配制一系列pH梯度、终浓度为0.1 mol/L的缓冲溶液:HAc-NaAc(pH5.0)、Na2HPO4-柠檬酸(pH 6.0)、Tris-HCl(pH 7.0~8.0)、Gly-NaOH(pH 9.0~10.0)以及Na2HPO4-NaOH(pH 11.0),用不同pH的缓冲溶液配制质量分数为1%的酪素,与相应缓冲液稀释的酶液混合后50℃保温10 min,Folin法测定酶液在一系列pH条件下的酶活,确定酶液的最适反应pH;将酶液分别在一系列pH梯度缓冲液系统中25℃保存l h和24 h,在最适作用条件下测定酶活。以对照酶活为100%,计算不同pH保存条件下相对酶活[23]。
2.6.2 酶的最适作用温度和温度稳定性
酶液用pH8.0的缓冲液适当稀释,与质量分数为1%的酪素混合,在不同温度下分别保温10 min,Folin法测酶活。确定酶液的最适反应温度;酶液分别在40、50、60、70℃保温3 h,每隔30 min在最适pH和最适温度下测定酶活性,以未保温的酶液的酶活为100%,计算相对酶活[24]。
2.6.3 金属离子、金属螯合剂对酶活性的影响
酶液中分别加入不同的金属离子及EDTA,终浓度均为1 mmol/L,对照体系中不加任何化合物,以对照酶活为100%,计算相对酶活[25]。
2.6.4 不同化学试剂对酶活性的影响
酶液与不同试剂按一定浓度混合,25℃放置1 h,最适作用条件下测其酶活力,计算相对酶活[26]。
3 结果与分析
3.1 产酶菌株筛选结果
通过脱脂奶粉平板培养基筛选获得4株透明圈直径与菌落直径比值较大的菌株,文献报道[27],透明圈与菌落直径的比值与碱性蛋白酶活力高低并非显著的正相关。因此,将4株菌株的单菌落接种于5 mL的LB培养基中过夜培养,按2%的接菌量转接于发酵产酶培养基中,置于37℃的恒温振荡培养器中培养24 h,测定发酵液的酶活,最终确定产酶活最高的菌株。结果如表1所示,BN-2菌株产碱性蛋白酶酶活最高。故将BN-2菌株作为研究对象。

表1 产蛋白酶菌株初筛、复筛
3.2 产酶菌株的分子生物学鉴定结果
以菌株BN-2基因组DNA为模板,扩增16S rDNA序列,将目的条带16S rDNA连接到pEASY-Blunt Zero载体上,将重组载体送测序。测序得到的16SrRNA基因序列在GeneBank中进行Blast,结果显示,该菌株中16SrRNA基因序列与Bacillussubtilissubsp.nattoBEST195中16SrRNA基因序列(AP011541.2)的同源性达100%,同时利用MEGA5.0软件,绘制系统发育树。系统进化树构建结果如图1所示:该菌株和Bacillussubtilissubsp.nattoBEST195遗传距离最小,亲缘关系最近。

Fig.1 Phylogenetic tree constructed based on 16SrDNA sequence图1 基于16SrDNA序列构建的系统发育树
3.3 枯草芽孢杆菌WB600/pBE2R-AP工程菌构建
以菌株BN-2的基因组DNA为模板,扩增碱性蛋白酶基因,结果如图2所示:目的基因片段大约在1.2kb左右,大小与预期结果相符。重组质粒pBE2R-AP经过双酶切后出现两条带,其大小与预期大小相符,说明成功构建了重组质粒pBE2R-AP。将重组质粒pBE2R-AP送北京六合华大基因科技有限公司测序。测序结果在GeneBank中进行Blast,比对结果显示该菌株中碱性蛋白酶基因序列与AprE195基因序列同源性达100%。将测序正确的重组质粒pBE2R-AP转入枯草芽孢杆菌构建成WB600/pBE2R-AP工程菌。

A.PCR product of AP;B.recombinant vector pBE2R-AP results after double enzyme digestionFig.2 PCR products of AP and Identification of recombinant vector pBE2R-AP by enzyme digestionA. AP的PCR产物;B. 重组载体pBE2R-AP双酶切后结果图2 AP的PCR产物和重组载体pBE2R-AP酶切鉴定
3.4 碱性蛋白酶活性分析
用灭菌枪头吸取1 μL菌株BN-2、工程菌WB600/pBE2R-AP、不含碱性蛋白酶的WB600/pBE2R的菌液点于脱脂奶粉平板中,于37℃恒温培养箱中培养24 h。在脱脂奶粉平板上,菌株BN-2、工程菌WB600/pBE2R-AP周围出现透明圈,通过测定得出菌株BN-2透明圈与菌落直径的比值为1.08,工程菌WB600/pBE2R-AP透明圈与菌落直径的比值为1.7,不含碱性蛋白酶的工程菌WB600/pBE2R周围未出现透明圈。同时将2.4中制备的粗酶液用Folin法测定酶活,结果显示:相同培养条件下,菌株BN-2产蛋白酶的酶活达366U/mL,工程菌产蛋白酶的酶活达438U/mL,每毫升发酵液中重组蛋白酶比出发菌株中蛋白酶酶活高1.2倍。
3.5 重组蛋白酶部分酶学性质
3.5.1 酶的最适作用pH
按照2.6.1中的方法测定蛋白酶在一系列pH条件下的酶活性,结果如图3所示,该酶的最适作用pH为8.0,属于弱碱性蛋白酶。对于大部分碱性蛋白酶而言其最适作用pH值为9~11,比如菌株I13产的碱性蛋白酶,其最适作用pH为10.5[28]。海洋氧化短杆菌15E产的碱性蛋白酶最适作用pH值为9.0[29],Baciuussp.所产碱性蛋白酶最适作用pH为10.0~11.0[30]。
3.5.2 酶的最适作用温度
按照2.6.1中实验方法测定在不同作用温度下,蛋白酶活的变化,结果如图4所示:该酶的最适作用温度为50℃。碱性蛋白酶的最适温度分布范围较广,比如嗜碱芽孢杆菌Bacillussp B18的蛋白酶最适温度能达到85℃[31],从深海真菌中分离的一种碱性蛋白酶,最适反应温度为45℃[32]。

Fig.3 Optimal reaction pH of protease图3 蛋白酶最适作用pH

Fig.4 Optimum reaction temperature of protease图4 蛋白酶最适反应温度
3.5.3 酶的热稳定性
酶液按照2.6.2中实验方法分别在40℃、50℃、60℃、70℃保温3 h,每隔30 min在最适反应条件下,测定一次酶活。结果如图5所示:该酶在40℃中处理3 h时其相对酶活为60%,在50℃中处理30 min时残余酶活力仅为51%,说明其耐热性不好。一般而言芽孢杆菌和弧菌等细菌产的碱性蛋白酶比较耐热。如短杆菌产生的碱性蛋白酶在50℃和60℃分别保温60 h和7 h仍保持50%的酶活力[33],但也存在耐热性差的一些碱性蛋白酶,如嗜碱菌S9产的碱性蛋白酶在50℃中处理10 min时残余酶活力仅为60%左右[34],其稳定性比我们分离到的碱性蛋白酶的稳定性还差。
3.5.4 酶pH的稳定性
酶液按照2.6.2中方法在一系列pH缓冲液系统中25℃保存1 h和24 h,在最适反应条件下测定酶活。结果如图6所示,该酶在pH 7.0~9.0缓冲液中保存24 h后,至少保持75%的酶活性,显示较好的耐弱碱性,在pH为8.0时最稳定,残余酶活力达94%。
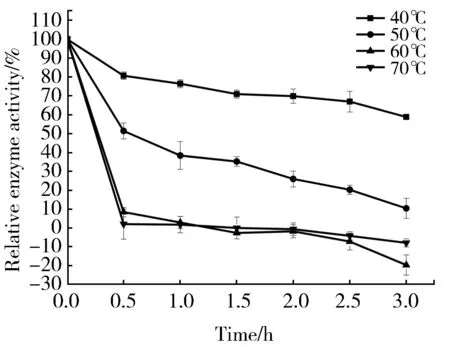
Fig.5 Thermal stability of protease图5 蛋白酶的热稳定性

Fig.6 pH stability of protease图6 蛋白酶的pH稳定性
3.5.5 不同金属离子、金属离子螯合剂对酶活的影响

Fig.7 Effects of metal ions and metal ion chelating agents on the activity of protease图7 金属离子、金属离子螯合剂对蛋白酶活性的影响
按照2.6.3中的实验方法在酶液中分别加入不同金属离子及EDTA,使其终浓度均为1 mmol/L,在最适反应条件下测定酶活性。结果如图7所示:Ca2+、Mn2+能有效激活酶活力,尤其1 mmol/L的Mn2+对该酶活性有48%的促进作用,1 mmol/L的Ca2+对该酶活性有8%的促进作用,1 mmol/L的Cu2+对该酶活性有85%的抑制作用,其余金属离子对该酶活性有轻微抑制作用。EDTA对酶活性也有20%的抑制作用,说明该酶可能为金属离子依赖型酶。
3.5.6 洗涤剂组分对酶活的影响
按照2.6.4中实验方法,酶液与不同浓度、不同洗涤剂组分按一定比例混合,25℃放置1 h,在最适反应条件下测其酶活力(表2)。结果表明:不同洗涤剂对该酶活性有不同程度的抑制作用。体积分数为1%的TritonX-100、Tween20、Tween80对该酶活性的抑制作用相对较小。
4 结论
我们从自然发酵的大豆中通过初筛、复筛得到一株产蛋白酶活性较高的菌株BN-2,经16S rDNA特征片段比较分析,初步确定该菌株为Bacillussubtilissubsp.nattoBEST195。Bacillussubtilissubsp.nattoBEST195作为纳豆菌的一种,已经完成了全基因组测序,但其中的碱性蛋白酶的却鲜有研究工作[35-37]。重组碱性蛋白酶比出发菌株中碱性蛋白酶酶活高1.2倍,可能和pBE2R载体中含P43组成型启动子有关,何小丹等人的研究也证实B.licheniformisYPlA来源的碱性蛋白酶基因在P43强启动子的作用下其表达能力明显优于碱性蛋白酶自带的启动子,其酶活比出发菌株酶活高4.39倍[38]。对于大部分碱性蛋白酶而言其最适作用pH值为9~11,但该菌株中碱性蛋白酶的最适作用pH为8.0,相比较作用条件更为温和。Mn2+对大部分的碱性蛋白酶酶活有抑制作用但本实验中1 mmol/L的Mn2+对该菌株中的碱性蛋白酶酶活有48%的促进作用,这与文献报道[39]1 mmol/L的Mn2+对放线菌来源的一种碱性蛋白酶的酶活有13%的促进作用相一致。相反,Cu2+对所有碱性蛋白酶的酶活都有明显的抑制作用,比如1 mmol/L的Cu2+对绿假单胞菌中碱性蛋白酶活性有26%的抑制作用[40],而本实验中1 mmol/L的Cu2+对该菌株中酶活性有85%的抑制作用,其抑制效果更为明显。1 mmol/L的EDTA对该菌株中碱性蛋白酶活性也有20%的抑制作用,表明该酶可能为金属离子依赖型酶。洗涤剂组分中TritonX-100、Tween20可以使某些碱性蛋白酶活性有所提升,但在本文中洗涤剂中各组分在1%浓度下对该酶的略微抑制作用。在下一步研究中,将利用蛋白质工程的手段进一步提高酶活性以及pH稳定性和热稳定性,使其适合在工业生产中的应用。

表2 洗涤剂组分对酶活性的影响
