四膜虫锌指结构蛋白Zfp1影响离子胁迫下金属硫蛋白基因的表达
2019-02-16周焕新王伟
周焕新,王伟
(1.山西大学 生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006;2.太原科技大学 环境与安全学院,山西 太原 030024)
0 引言
金属硫蛋白(Metallothioneins,MTs)是一类小的超家族胞浆蛋白,能够通过半胱氨酸(Cys)残基螯合重金属离子[1],广泛存在于微生物、植物、无脊椎动物和脊椎动物的各种组织和器官[2]。MTs不仅参与重金属离子的解毒[3],同时也参与必需金属离子平衡调节[4],在细胞的氧化应激、增殖、凋亡和衰老等一系列生理生化过程中发挥重要作用[5]。原生动物嗜热四膜虫(Tetrahymenathermophila)包含5种金属硫蛋白亚型,依据诱导物类型和Cys残基排布模式被划分为7a和7b两个亚家族。7a亚家族的MTT1、MTT3和MTT5属于镉诱导型金属硫蛋白(CdMT),7b亚家族的MTT2和MTT4属于铜诱导型金属硫蛋白(CuMT)。四膜虫5种MTs基因的编码序列均无内含子,适应细胞对逆境环境胁迫下基因表达的快速响应[6-8]。
哺乳动物MTs的表达受金属应答元件结合转录因子(Metal-responsive transcription factor 1,MTF-1)的调控,当细胞处于逆境环境时,MTF-1作用于MTs基因转录调节区域的金属响应元件(Metal response element,MRE)、抗氧化响应元件(Antioxidant response element,ARE)、糖皮质激素响应元件(Glucocorticoid responsive elements,GRE)等实现对MTs基因转录调控[9]。MTF-1含有高度保守的锌指结构域,包含有6个Cys2His2锌指结构域以及3个转录激活区:酸性区域、富含脯氨酸(Pro)区域和富含丝氨酸(Ser)及苏氨酸(Thr)的区域[10]。在金属离子应激条件下,果蝇MTF-1结合MRE激活MTs基因的转录[2]。四膜虫中存在多种进化高度保守的含有锌指结构域的转录因子[11]。四膜虫不同的MTs基因在应激条件下的转录表达水平存在差异。MTT1、MTT3和MTT5能够被多种应激条件所诱导,并表现出相应的特异性,MTT1和MTT5主要参与重金属离子镉和铅的解毒,MTT3主要参与Zn2+的平衡调节[7],而MTT2和MTT4主要参与Cu+的代谢[12-13]。然而参与嗜热四膜虫中金属离子诱导下的MTs基因转录表达的转录调控因子并不清楚,本研究基于四膜虫基因组数据库(http:∥www.ciliate.org),首次筛选鉴定了含有锌指结构域的基因ZFP1(TTHERM-01002770),通过同源重组敲除ZFP1基因,获得ΔZFP1细胞株,初步分析了金属离子胁迫下ZFP1敲除突变细胞中MTs基因的转录水平,为金属离子诱导下的金属硫蛋白的转录调控提供相关依据。
1 材料与方法
1.1 材料
嗜热四膜虫B2086细胞株(Cornell University,The nationalTetrahymenaStock Center,http:∥tetrahymena.vet.cornell.edu/index.html)。酵母提取物、胰蛋白胨(英国OXOID公司)、EDTA 铁盐;氨苄青霉素、巴龙霉素(上海生工),链霉素、两性霉素、葡萄糖(北京索莱宝科技有限公司);pMD18-T克隆试剂盒(TaKaRa公司);限制性内切酶、T4 DNA连接酶和Dream TaqDNA聚合酶(Thermo公司);SYBR Premix Ex TaqTM(TaKaRa公司);胶回收试剂盒(OMEGA公司),质粒提取试剂盒(北京天根生化);引物合成和DNA 序列测序由上海生工完成。
1.2 嗜热四膜虫细胞培养
嗜热四膜虫于SPP培养基(1%胰蛋白胨(g/L),0.2%葡萄糖(g/L),1.0%酵母提取物(g/L),0.003% EDTA铁盐(g/L))中30℃,170 r/min恒温摇床培养。
1.3 敲除载体构建
以嗜热四膜虫大核基因组为模板,通过引物KO-ZFP1-5-F/KO-ZFP1-5-R和KO-ZFP1-3-F/KO-ZFP1-3-R分别扩增ZFP1基因的上游序列876 bp和下游序列544 bp,PCR反应条件为:94℃,5 min,94℃,30 s,52℃,30 s,72℃,90 s,30个循环,72℃延伸 10 min。回收片段与pMD18-T载体连接,转化大肠杆菌DH5α,筛选获得重组质粒pMD18-ZFP1-5′和pMD18-ZFP1-3′。限制性内切酶SacⅠ和NotⅠ分别酶切质粒pMD18-ZFP1-5′和载体pNEO4并回收片段T4 DNA连接酶连接(16℃过夜),转化并筛选获得pZFP1-5′-NEO4质粒。限制性内切酶KpnⅠ和XhoⅠ分别酶切质粒pMD18-ZFP1-3′和pZFP1-5′-NEO4,回收目的片段通过T4 DNA连接酶连接并转化转化大肠杆菌DH5α,筛选获得重组质粒pN-ZFP1。
1.4 细胞转化及突变株筛选
重组质粒pN-ZFP1用限制性内切酶SacⅠ和KpnⅠ酶切线性化,浓缩至1~1.5 μg/μL。通过基因枪(GJ-1000,宁波新芝科技有限公司)将线性化质粒转化到嗜热四膜虫细胞中。通过提高SPP培养基中巴龙霉素浓度进行细胞表型分配的筛选。PCR对敲除株进行鉴定,PCR反应条件为:94℃,5 min;94℃,30 s,53℃,4 min,72℃,90 s,30个循环;72℃延伸 10 min。
1.5 Cu2+和Cd2+胁迫下细胞的增殖
通过急性毒性试验测定Cu2+和Cd2+对突变细胞24 h半数最大效应浓度(Concentration for 50% of maximal effect,EC50)。Cu2+处理的终浓度分别为:15、30、45、60、100和120 μmol/L;Cd2+处理的终浓度分别为:5、10、15、20、30和40 μmol/L.野生型细胞和突变细胞在30℃、170 r/min恒温培养至对数生长前期(1×105cells/mL),吸取500 μL细胞分别转至24孔培养板,加入新鲜SPP培养基至2 mL,不同金属离子母液按浓度梯度分别加入培养孔,继续培养24 h,血球计数器记录不同处理细胞密度计算抑制率,以金属离子浓度对数值和抑制率进行数据拟合,得到剂量-效应曲线和EC50。
1.6 MTs基因的表达分析
ΔZFP1细胞和野生型细胞在53.0 μmol/L CuSO4和25.3 μmol/L CdCl2诱导1 h后,不同处理的突变细胞和野生型细胞mRNA分别被提取,分光光度计检测所提取的mRNA的OD260/280在1.8~2.0之间,以mRNA为模板反转录PCR获得cDNA。以野生型细胞为对照,对突变细胞中的MTs基因在不同金属离子压力下的转录水平进行分析,17S rRNA作为内参,RT-PCR反应条件为:95℃,15 min,95℃,15 s,56℃,30 s 40个循环。每个独立的样本采取3个平行,结果通过仪器自带的StepOne Software读取,采用2-ΔΔCT处理法进行分析。统计上采用T检测,P<0.05具有统计学意义。

表1 本研究中使用的PCR引物
2 实验结果
2.1 嗜热四膜虫ZFP1基因分析
嗜热四膜虫ZFP1基因全长2 160 bp,编码 719个氨基酸(图1C),N端包含4个B-Box锌指结构域,分别为F1、F2、F3和F4(图1A),每个锌指结构域由相应的“linker”链接,C端富含丝氨酸(Ser)区域共包含43个Ser,谷氨酰胺(Gln)富含区域共包含51个Gln(图1C),SWISS-MODEL(https:∥www.swissmodel.expasy.org)模拟的Zfp1(19-134aa)三级结构具有四个锌指结构域(图1B)。基于四膜虫基因组数据库(http:∥www.ciliate.org)分析,Zfp1与四膜虫T.malaccesis,T.ellittti,T.borealis中的同源基因的一致性为73%、62%和51%。而锌指结构域的一致性为98%、89%和85%。通过四膜虫功能基因组数据库(http:∥tfgd.ihb.ac.cn)分析,ZFP1在生长期有着较低的表达量,在饥饿期表达上调,在有性生殖时期4 h达到最大值(图2A)。野生型细胞在Cu2+诱导下,ZFP1转录水平上调2.9倍,在Cd2+诱导下,ZFP1转录水平上调1.4倍(图2B),表明ZFP1响应金属离子的调控。

Fig.1 Sequence analysis of Zfp1 from T. thermophilaA:Zfp1锌指结构蛋白结构域,Zfp1包含4个锌指结构域,每个锌指结构域由相应的连接序列链接,C端包含富含丝氨酸和谷氨酰胺的结构域。B:SWISS-MODEL模拟的Zfp1三级结构图。C:Zfp1氨基酸序列分析。图1 嗜热四膜虫Zfp1的序列分析

Fig.2 Transcriptional expression analysis of ZFP1A:ZFP1基因的微阵列表达谱,L1为生长期的表达水平;S0、S6、S9、S15和S24为饥饿0 h、6 h、 9 h、 15 h和24 h的表达水平;C0、C4、C8和C12为有性生殖0 h、4 h、8 h和12 h的表达水平。B:金属离子Cd2+ 和Cu2+诱导下的ZFP1转录水平分析。图2 ZFP1基因转录表达分析
2.2 ΔZFP1突变细胞株的鉴定
通过同源重组方法获得的ΔZFP1细胞(图3A),在含有巴龙霉素的SPP培养基中进行筛选。以ΔZFP1基因组为模板,ZFP1-F和ZFP1-R扩增获得3.4 kb重组片段;WT基因组为模板,获得3.9 kb片段(图3B)。qRT-PCR检测ΔZFP1细胞中ZFP1的表达,结果表明ZFR1无转录本产生,获得ZFP1基因完全敲除的突变细胞(图3C)。

Fig.3 Construction and identification of ΔZFP1 cellsA:ZFP1基因敲除同源重组示意图。B:ΔZFP1细胞重组位点PCR扩增产物琼脂糖凝胶电泳,M:DNA 标准,野生型条带大约3.9 kb,重组条带大约3.4 kb。C:ZFP1基因转录水平的qRT-PCR分析。图3 ΔZFP1突变细胞株的构建和鉴定
2.3 ZFP1的敲除影响细胞对Cu2+和Cd2+的耐受性
为了分析ZFP1是否参与细胞对金属离子的耐受性,以Cu2+和Cd2+对野生型细胞和ΔZFP1细胞的生长抑制进行了测定。野生型细胞对Cu2+和Cd2+的EC50值分别为83.1 μmol/L和32.8 μmol/L;ΔZFP1细胞对Cu2+和Cd2+的EC50值分别为53.0 μmol/L和25.3 μmol/L(图4),表明ΔZFP1对Cu2+和Cd2+耐受性降低,说明敲除ZFP1基因影响了细胞对铜、镉的耐受性。
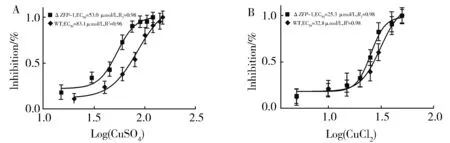
Fig 4 Inhibition of ΔZFP1 cells growth under Cu2+和Cd2+ stress野生型细胞和ΔZFP1细胞暴露在含有CuSO4或CdCl2胁迫下的增值。A:野生型细胞和ΔZFP1细胞暴露在含有CuSO4的SPP培养基中的EC50值分别为83.1 μmol/L和53.0 μmol/L。B:野生型细胞和ΔZFP1细胞暴露在含有CdCl2的SPP培养基中的EC50值分别为32.8 μmol/L和25.3 μmol/L。图4 Cu2+和Cd2+抑制ΔZFP1细胞的增殖
2.4 Cu2+和Cd2+离子胁迫下MTs的转录分析
哺乳动物MTF-1缺失的突变体中,MTs基因的表达显著下调[14]。在Cu2+诱导下,ΔZFP1细胞中MTT2、MTT3、MTT4和MTT5的转录水平显著降低(p<0.01),而MTT1的转录水平升高(P<0.01)(图5A),表明ZFP1基因参与了Cu2+诱导的MTT2、MTT3、MTT4和MTT5的表达。Cd2+诱导下,ΔZFP1中仅发现MTT4转录水平显著降低(P<0.01)而MTT3和MTT5(P<0.01),MTT1和MTT2(P<0.05)表达上调(图5B),表明ZFP1基因可能并不直接参与Cd2+诱导下MTT1、MTT2、MTT3和MTT5基因的转录调控。

Fig.5 Transcription level of MTs induced by Cu2+ and Cd2+ in ΔZFP1 cellsA:ΔZFP1细胞在含有CuSO4培养基中的MTs的表达分析。B:ΔZFP1细胞在含有CdCl2的SPP培养基中的MTs的表达分析。图5 Cu2+和Cd2+诱导下ΔZFP1细胞中MTs基因转录水平
3 讨论
MTs基因表达受多种应激条件的影响,如金属离子、甾体类激素、化学物质、纳米材料、炎症等[1,5]。MTs基因转录受MTF-1的调控,在金属离子诱导下,MTF-1中的锌指结构与MTs基因转录调节区的MRE结合,响应细胞内游离Zn2+浓度调节,从细胞质转移至细胞核实现与DNA结合完成转录调节[15-16]。在哺乳动物中MRE大多以多拷贝形式存在,并且表现为特有的固定核心序列“TGCRCNC”其中R=A/G,N=A/T/C/G[17]。在嗜热四膜虫基因表达调控元件中鉴定出金属硫蛋白保守基序(Metallothionein Conserved Motif 1,MTCM1)的顺式调控元件,包含一个TGANTCA(N为任意核酸)序列,这种顺式作用元件类似于酿酒酵母中从事拮抗金属和氧化应激作用的YAP-1和c-jun的应答元件(TGAG/CTCA)[18-19]。这种保守基序MTCM1在MTT1调控序列中出现6次,MTT3调控序列中出现2次,MTT5调控序列中出现13次,MTT2调控序列中出现1次,MTT4调控序列中出现3次[20]。相应的MTT5基因在Cd的胁迫下表达水平最高,MTT1次之,而MTT3最低;Cu的胁迫下,MTT4的表达水平显著高于MTT2[8]。哺乳动物MTF-1调控了控制金属离子浓度动态平衡和抗氧化反应的基因的表达[21]。敲除MTF-1的突变小鼠对镉离子的毒性更加敏感[22]。嗜热四膜虫中存在多种进化高度保守的含有锌指结构域的转录因子,并且发挥着不同功能,Zfr1p在性发育过程中发挥着重要的调控功能[11]。本研究中嗜热四膜虫缺失ZFP1基因,生长发育未受到影响,表明ZFP1与生长发育无关。但是ΔZFP1细胞表现为对金属离子的耐受性降低,这一结果与我们先前研究的缺失MTs基因影响细胞对金属离子的耐受性的结果相类似,先前的研究表明敲除MTT2和MTT4基因,导致细胞对Cu2+的耐受性降低[23],敲除MTT1,MTT3,或MTT5基因导细胞对Cd2+耐受性降低[23-24]。而敲除ZFP1基因的突变细胞表现为Cu2+和Cd2+耐受性降低,说明ZFP1的缺失影响了细胞对金属离子的耐受性。
在大多数生物中,多种MT异构体存在是一个普遍现象,并且不同MT异构体表现出不同的功能。在同样的胁迫条件下,不同的异构体具有不同响应程度,表明这些MT异构体具有不同的调控机制[20]。金属离子诱导ΔZFP1细胞发现,在Cu2+诱导下,MTT2、MTT3、MTT4和MTT5转录水平降低(图5A),ZFP1基因缺失影响了MTs的转录调控,表明Zfp1与Cu2+胁迫下MTT2、MTT3、MTT4和MTT5转录相关,而MTT1转录水平上调暗示可能存在其他特异的转录调控因子补偿了细胞缺失ZFP1所导致的MTs基因转录下调(图5A)。ΔZFP1细胞在Cd2+诱导下MTT1、MTT2、MTT3和MTT5转录水平上调,表明ZFP1可能并不直接参与Cd2+胁迫下四膜虫CdMT(MTT1、MTT3和MTT5)和MTT2的转录,暗示四膜虫MTs基因转录调控存在多种调节因子,但是,ZFP1缺失导致突变体细胞在Cd2+诱导下,MTT4的表达显著降低。因此我们推测四膜虫金属离子诱导下的MTs转录调控是一个由多因子共同参与调控的过程,同时单一的锌指结构蛋白也可能参与不同MTs基因转录调控。
