基于响应面法的药膳参苓谷物冲调粉提取工艺研究
2019-02-14,*,,,,
,*,,,,
(1.湖南中医药大学,湖南 长沙 410208;2.湖南省药食同源功能性食品工程技术研究中心,湖南 长沙 410208;3.抗肿瘤中药创制技术湖南省工程研究中心,湖南 长沙 410007)
参苓谷物冲调粉提取物的配方为古方参苓白术散通过加减化裁而来,由人参、茯苓、白扁豆、陈皮、莲子、山药、薏苡仁、黄精、枸杞组成,具有扶助正气、健脾益肾之功效。该方出自《太平惠民和剂局方》,临床常用于脾胃虚弱、饮食不进、多困少力、呕吐泄泻的治疗,久服可养气育神、醒脾悦色、顺正辟邪,是为培土生金治法的常用方剂[1]。此方应用广泛、疗效确切,可改善晚期恶性肿瘤患者的部分临床症状,提高免疫功能,改善生活质量[2-3]。现代研究证实参苓白术散能提高IL-2、干扰素γ、肿瘤坏死因子水平,通过调节免疫系统提高人体抵御癌细胞的能力[4]。药理研究表明人参对实体肿瘤有一定疗效,其含有丰富的三萜皂苷类及多糖类等生物活性成分,二者皆具有抗肿瘤、免疫调节、抗氧化、降血糖、抗辐射等作用[5-7]。研究表明,植物多糖具有抗肿瘤活性,且毒副作用小,是潜在的新型抗肿瘤药物资源[8]。本实验考察参苓谷物冲调粉醇提工艺的醇浓度、加醇量、浸泡时间指标,水提工艺的加水量、提取时间、浸泡时间指标,然后采用响应面试验设计法优化醇提、水提工艺参数,为其工业化生产提供依据。
1 仪器与材料
1.1 仪器
Ultimate 3000高效液相色谱系统(赛默飞世尔科技有限公司);UV9100B紫外可见分光光度计(北京莱伯泰科仪器股份有限公司);YP-B5001型电子天平(上海光正医源仪器有限公司);RHP-400型高速多功能粉碎机(浙江永康市荣浩工业有限公司);SHH.W21电子三用水箱(北京中兴伟业仪器有限公司);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);YJD20老药师常温煎药机(长沙市卓成医疗器械有限公司);RE-200013旋转蒸发仪(巩义市予华仪器有限责任公司)。
1.2 药材及试剂
人参皂苷Rg1对照品(批号:110703-200726)购自中国食品药品检定研究院,供含量测定用;人参皂苷Rb1对照品(批号:110704-200921)购自中国食品药品检定研究院,供含量测定用;人参皂苷Re对照品(批号:110702-200925)购自中国食品药品检定研究院,供含量测定用;无水葡萄糖对照品(批号:110833-201506)购自中国食品药品检定研究院,供含量测定用;甲醇、乙腈为色谱纯,水为重蒸馏水,其他HPLC用试剂皆为色谱纯;苯酚、浓硫酸、乙醚、无水乙醇等比色用试剂皆为国产分析纯。
2 方法与结果
2.1 苯酚-硫酸比色法测定参苓谷物冲调粉提取物醇提液中多糖的含量
2.1.1 对照品溶液制备 取无水葡萄糖对照品约0.025 g,精密称定,置于250 mL容量瓶中,加适量水溶解,稀释至刻度,摇匀,制得含0.1004mg/mL的葡萄糖标准溶液。
2.1.2 供试品溶液制备 精密移取各工艺条件下制得的醇提样品液(约相当于生药量0.5 g),加乙醚100 mL加热回流1 h,静置,放冷,小心弃去乙醚液,残渣置水浴上挥尽乙醚。加入80 %乙醇100 mL,加热回流1 h,趁热滤过,滤渣与滤器用热80 %乙醇30 mL分次洗涤,滤渣连同滤纸置烧瓶中,加水150 mL,加热回流2 h。趁热滤过,用少量热水洗涤滤器,合并滤液与洗液,放冷,移至250 mL量瓶中,用水稀释至刻度,摇匀,得供试品1;吸取2 mL供试品1置于10 mL试管中,加水至刻度线,得供试品2。精密吸取1 mL供试品2,加入1 mL蒸馏水,1 mL 5 %的苯酚,5 mL浓硫酸,摇匀,室温置10 min,40 ℃水浴加热15 min,冷却至室温,在最大吸收波长处测定吸光度A。
2.1.3 最大吸收波长选择 精密吸取葡萄糖对照品溶液和参苓谷物冲调粉提取物水提样品溶液1 mL,按照“2.1.2”项下方法在400~600 nm范围内分别进行全波长扫描,结果对照液和供试液最大吸收波长皆为490 nm,故选择490 nm为测定波长。
2.1.4 标准曲线绘制 精密吸取无水葡萄糖对照品溶液0、0.2、0.4、0.6、0.8、1.0 mL,分别置于10 mL具塞试管中,分别加蒸馏水补至2.0 mL,各再精密加入5%苯酚溶液1mL,摇匀,迅速加入5 mL浓硫酸,摇匀,室温放置10 min,置于40 ℃水浴加热15 min,取出,迅速冷却至室温,以相应试剂为空白,在490nm的最大吸收波长处测定吸光度。以吸光度对无水葡萄糖溶液浓度进行线性回归,得线性方程:Y=0.0171 76+0.0435 39X,R=0.992 9。
2.2 HPLC法测定参苓谷物冲调粉提取物醇提液中人参皂苷Rg1、Re、Rb1的含量
2.2.1 色谱条件[9-10]Ultimate 3000色谱柱,固定相为C18烷基键合硅胶,流动相为水-乙腈,运行时间30 min,检测波长203 nm,柱温30℃。按人参皂苷Rg1、Re、Rb1分别计算理论塔板数均>4000,分离度>1.5。
2.2.2 人参皂苷Rg1、Re、Rb1对照品溶液配制 称取人参皂苷Rg1、Re、Rb1对照品各约10 mg,分别精密称定0.010 3 g、0.010 4 g、0.010 1 g,置于10 mL容量瓶中,加入甲醇定容至刻度,分别制得1.03 mg/mL、1.04 mg/mL、1.01 mg/mL人参皂苷对照品溶液。
2.2.3 供试品溶液制备 精密移取参苓谷物冲调粉提取物部分药材的醇提各样品液适量,过0.22μm微孔滤膜至进样小瓶中,即制得部分药材醇提供试品溶液。
2.2.4 阴性对照品溶液制备 按处方比例称取除去人参的其他药材,按照醇提液的制备工艺和供试品溶液的处理方法制备阴性对照品溶液。
2.2.5 人参皂苷Rg1、Re、Rb1标准曲线的制备及线性范围 取1.03 mg/mL人参皂苷Rg1、1.04 mg/mL的人参皂苷Re、1.01 mg/mL的人参皂苷Rb1对照品溶液分别依次稀释成100 μg/mL、90 μg/mL、80 μg/mL、70 μg/mL、60 μg/mL、50 μg/mL、40 μg/mL、30 μg/mL、20 μg/mL、10 μg/mL的浓度,按照“2.2.1”项下色谱分离条件进样10 μL,测定峰面积积分值,以峰面积积分值为纵坐标Y,分别以人参皂苷Rg1浓度、人参皂苷Re浓度、人参皂苷Rb1浓度X为横坐标绘制标准曲线。结果表明,人参皂苷Rg1线性回归方程为:Y=0.802 8X+0.1463,R2=0.999 4;人参皂苷Re线性回归方程为:Y=0.387 1X+0.159 3,R2=0.999 2;人参皂苷Rb1线性回归方程为:Y=0.795 4X+0.276 3,R2=0.999 7,即人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1对照品溶液浓度在10~100 μg/mL范围内线性关系良好。
2.2.6 分离条件的考察 精密吸取对照品溶液10 μL,供试品溶液、阴性对照品溶液各20μL,分别注入高效液相色谱仪,按照“2.2.1”项下色谱条件进样分析,结果可知,供试品色谱中,在与对照品色谱相应的位置上有一相同的色谱峰,而阴性对照液未见干扰。见图1、图2、图3。
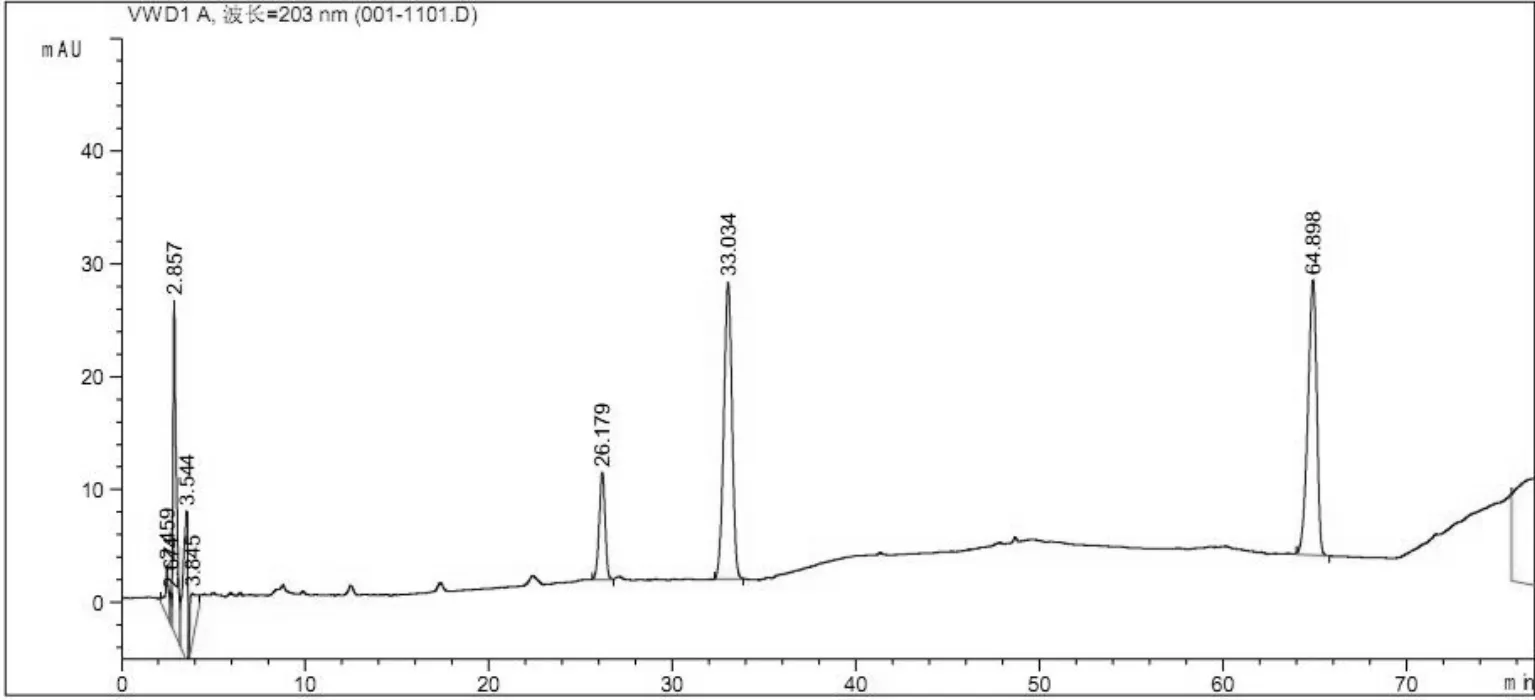
图1 对照品HPLC(由左到右依次为人参皂苷Re、人参皂苷Rg1、人参皂苷Rb1)
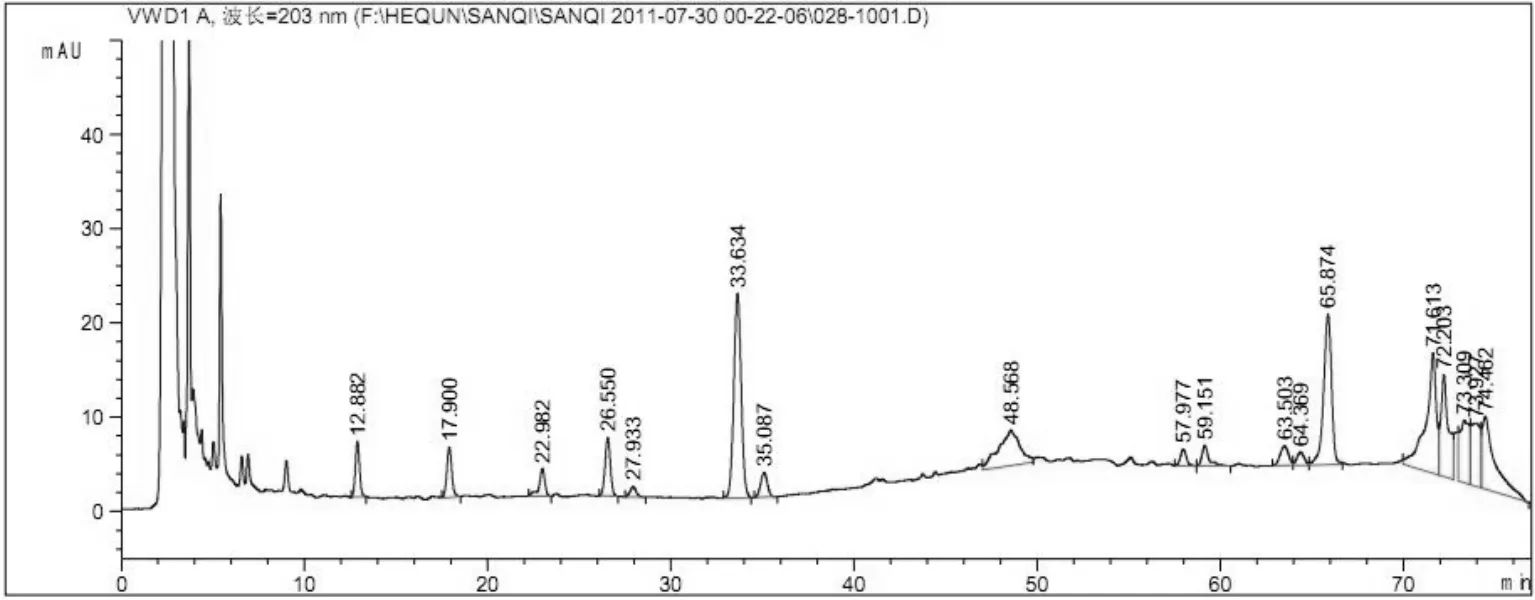
图2 参苓谷物冲调粉提取物水提样品供试液HPLC
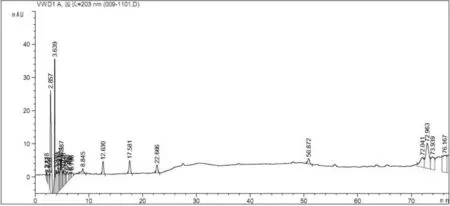
图3 阴性对照品溶液HPLC
2.2.7 方法学考察 人参皂苷Rg1、Re、Rb1的仪器精密度RSD分别为1.012 %、1.062 %、1.089 %;供试品溶液在48 h内稳定,测定应在48 h内完成;重复性试验RSD分别为1.871 %、1.683 %、1.764 %;加样回收率试验结果表明,参苓谷物冲调粉提取物部分药材的醇提样品液中人参皂苷Rg1、Re、Rb1平均回收率分别为99.34 %、101.9 %、100.5 %,RSD分别为1.65 %、1.926 %、1.538 %。
2.3 参苓谷物冲调粉提取物醇提基本方法
将人参、黄精、陈皮加一定浓度和倍量的乙醇,浸泡后,同法回流2~3次,过滤合并滤液,浓缩并定容至一定体积。
2.3.1 参苓谷物冲调粉提取物醇提次数考察 取人参、黄精、陈皮3份,每份100 g,按表1设计方案中的参数分别回流法醇提,制备3份醇提液,50 ℃减压浓缩并定容至100 mL,按“2.2.3”项分别处理成供试液,每份按照“2.2.1”项下色谱条件分别进样10 μL,测定3种人参皂苷含量,结果见表1。由表1结果可知,醇提2次3种人参皂苷之和提取量占醇提3次的95 %以上,故醇提2次为佳。

表1 参苓谷物冲调粉提取物醇提次数的考察
2.3.2 响应面设计试验法优选参苓谷物冲调粉提取物醇提工艺参数 在预试验的基础上,对参苓谷物冲调粉提取物醇提关键工艺参数,即醇浓度、加醇量、醇提时间采用3因素3水平Box-Bebnken试验设计的响应面设计试验法,通过Design Expert 8.0软件对实验数据进行回归分析。以药材中3种人参皂苷总含量(%)为评价指标值,筛选最优醇提工艺参数。各因素水平见表2。

表2 参苓谷物冲调粉提取物醇提Box-Behnken设计试验因素水平及编码
注:加醇量为药材量12倍时,第1次加醇7倍量、第2次加醇5倍量;加醇量为药材量16倍时,第1次加醇10倍量、第2次加醇6倍量;加醇量为药材量20倍时,第1次加醇12倍量、第2次加醇8倍量。醇提时间为1.0 h时,第1次0.6 h、第2次0.4 h;水提时间为2.0 h时,第1次1.2 h、第2次0.8 h;水提时间为3.0 h时,第1次2.0 h、第2次1.0 h。
2.3.3 参苓谷物冲调粉提取物醇提响应面试验设计及结果 响应面试验安排及结果见表3,表3共14个试验点,其中12个为析因点,2个为零点,析因点为自变量取值醇浓度(A)、加醇量(B)和醇提时间(C)所构成的顶点,零点为区域的中心点,其中零点试验重复2次,用以估算试验误差。
2.3.4 模型的建立及显著性分析 利用Design Expert8.0软件对表3试验数据进行二次回归拟合,得Y值对醇浓度(A)、加醇量(B)和醇提时间(C)的二次多项回归模型方程为:Y=0.5562-0.0381625×A+0.0227875×B+0.00185×C-0.014275×A×B-0.0025×A×C-0.0026×B×C-0.0422875×A2-0.0115375×B2+0.0055875×C2,对该模型进行显著性检验,结果见表4。
试验选用的模型P值<0.05具有显著性,失拟项不显著(P=0.6748>0.05),说明该模型是有统计意义的;复相关系数R2adj=0.9779,说明该模型能解释97.79%响应值的变化,因而该模型的拟合程度比较好,可以用此模型来分析和预测参苓谷物冲调粉提取物水煎工艺参数。
2.3.5 参苓谷物冲调粉提取物醇提工艺各因素对加强指数影响的曲面分析结果 利用Design Expert 8.0软件对参苓谷物冲调粉提取物醇提工艺数据进行处理,得到曲面分析结果,见图4、图5、图6。从回归方程各项方差的进一步检验也可看出,一次项中影响显著因素为醇浓度、加醇量,在所选的各因素水平范围内,按照对结果的影响排序,即醇浓度>加醇量>醇提时间。3个因素中,醇浓度与加醇量之间交互作用明显,而其他两两因素之间交互作用不明显。
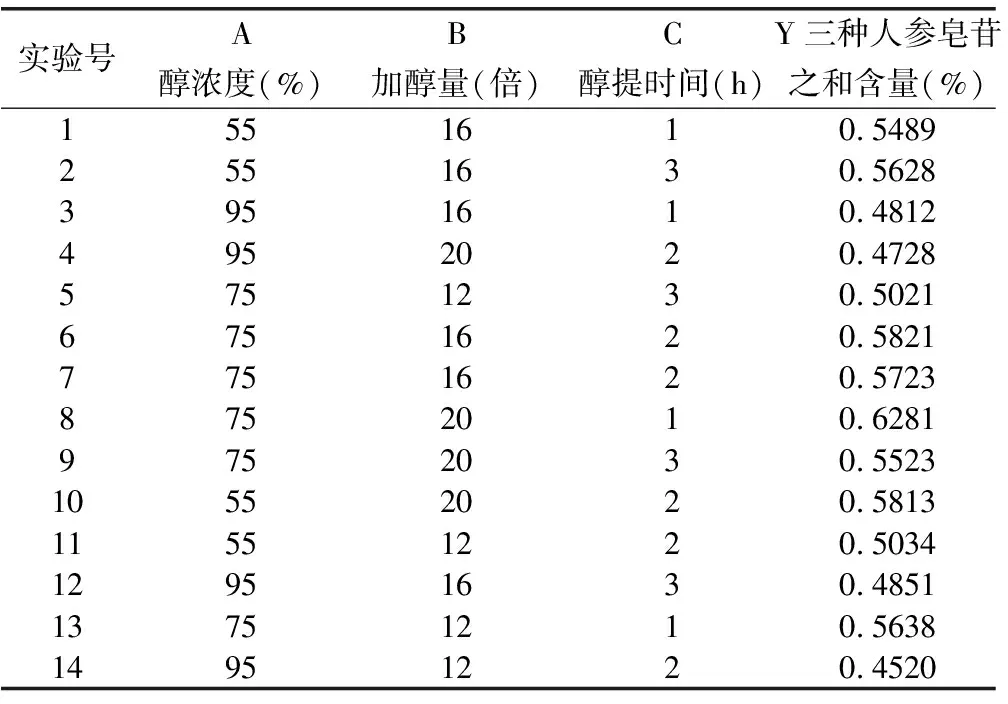
表3 参苓谷物冲调粉提取物醇提响应曲面设计试验测定结果
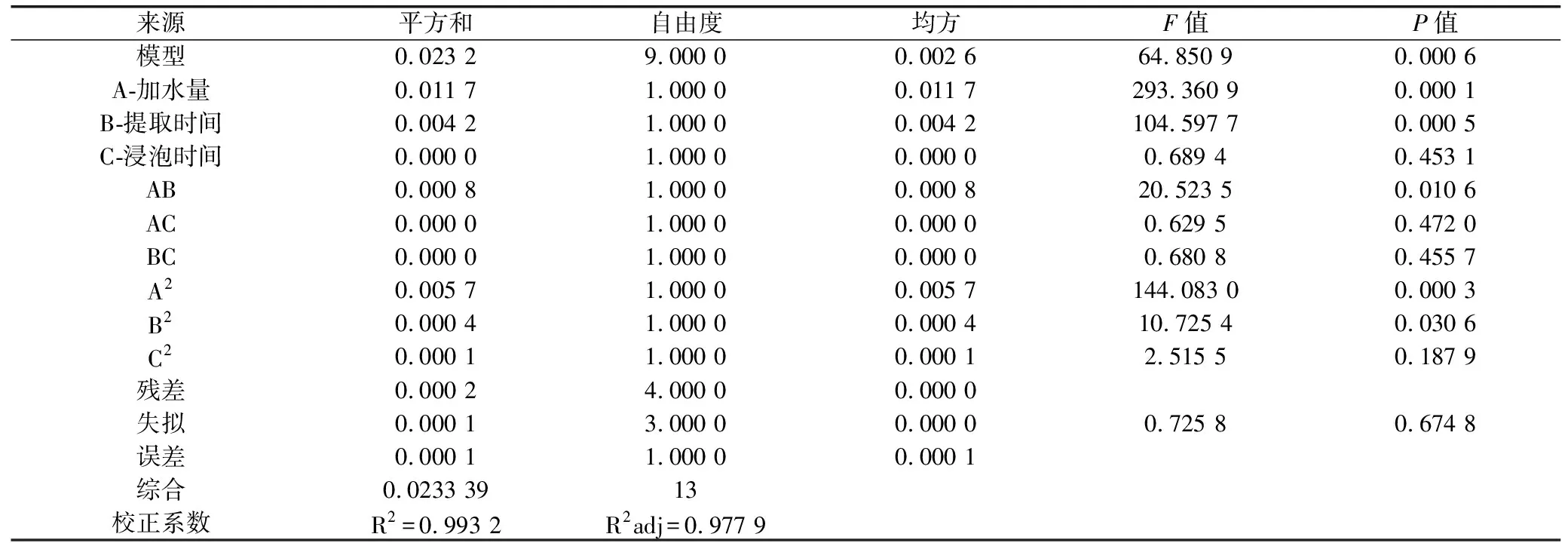
表4 回归模型方差分析
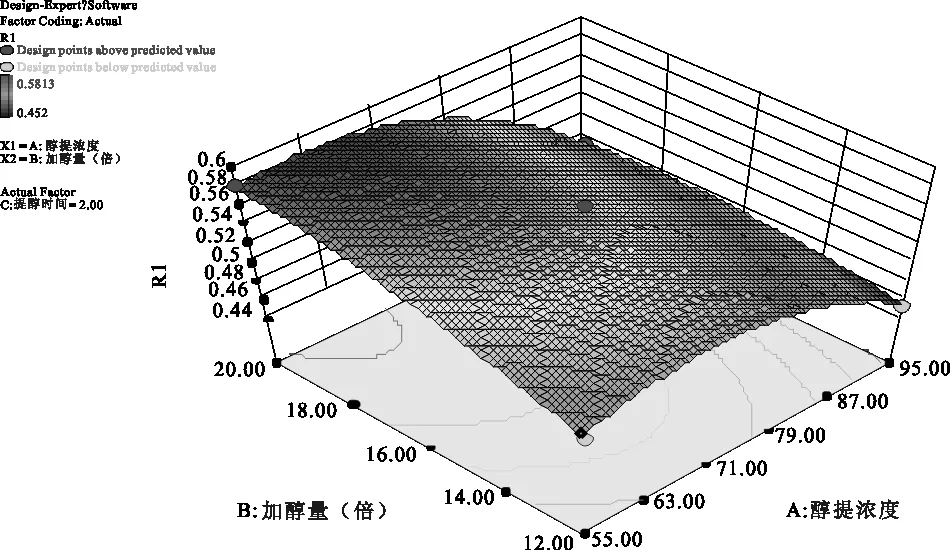
图4 醇浓度(A)和加醇量(B)对Y值影响的曲面图
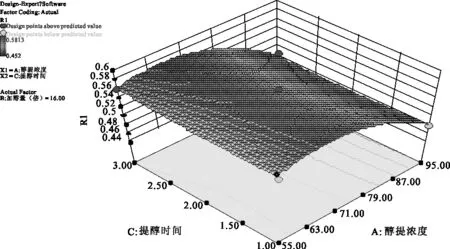
图5 醇浓度(A)和加醇量(C)对Y值影响的曲面图
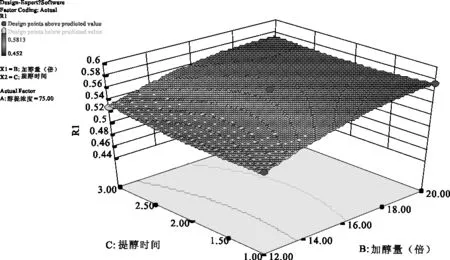
图6 加醇量(B)和醇提时间(C)对Y值影响的曲面图
2.3.6 参苓谷物冲调粉提取物醇提工艺条件优化结果 采用Design-Expert 8.0软件对方程Y求解,得到参苓谷物冲调粉提取物醇提的最优工艺参数:醇浓度为62.01 %,加醇量为20倍,醇提时间为3.0 h,理论上Y值为0.59 %。
2.3.7 验证试验结果 对参苓谷物冲调粉提取物醇提工艺所得到的优化条件进行微调:醇浓度为62 %,第1次提取加醇量为12倍,醇提时间为2.0 h,第2次提取加醇量为8倍,醇提时间为1.0 h。3批小试验证试验实际测得Y值为0.64 %,RSD=1.83 %(n=3),与理论值相接近,所以基于响应曲面法所得的优化醇提提取工艺参数准确可靠。
2.4 茯苓、枸杞子、黄精、山药等与醇提药渣一并水提工艺条件研究
2.4.1 参苓谷物冲调粉提取物水提基本方法 将茯苓、枸杞子、黄精、山药加一定量水浸泡2.0h,加入醇提药渣一并水提回流2次或3次,每次水提回流一定时间,过滤,合并滤液,浓缩至一定体积。
2.4.2 参苓谷物冲调粉提取物水提次数考察 取茯苓、枸杞子、黄精、山药等3份,每份100 g,分别浸泡,加入醇提药渣,按表5设计方案中的参数分别水提,制备3份水提液,50 ℃减压浓缩至100 mL,按照“2.1.2”项下方法分别处理成供试液,每份按照“2.1”项下测定多糖含量,结果见表5。由表5结果可知,水提2次多糖提取量占水提3次的94%以上,故水提2次为佳。
2.4.3 响应面设计试验法优选参苓谷物冲调粉提取物水提工艺参数 在预试验的基础上,对参苓谷物冲调粉提取物水提关键工艺参数,即水提温度、加水量、水提时间采用3因素3水平Box-Bebnken试验设计的响应面设计试验法,通过Design Expert 8.0软件对实验数据进行回归分析。以药材中多糖含量(%)为评价指标值,筛选最优水提工艺参数。各因素水平见表6。
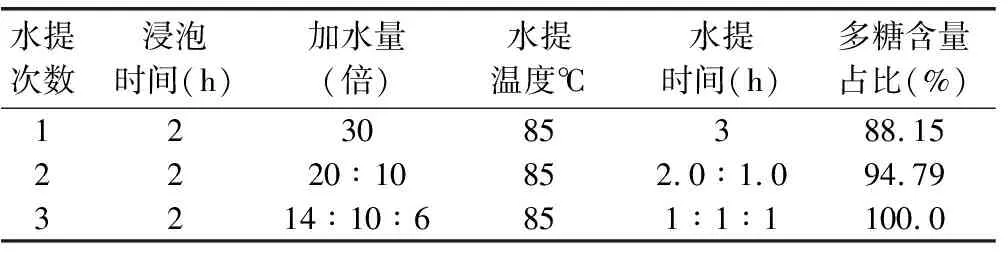
表5 参苓谷物冲调粉提取物水提次数考察设计

表6 参苓谷物冲调粉提取物水提Box-Behnken设计试验因素水平及编码
注:加水量为药材量10倍时,第1次加水6倍量、第2次加水4倍量;加水量为药材量20倍时,第1次加水12倍量、第2次加水8倍量;加水量为药材量30倍时,第1次加水18倍量、第2次加水12倍量。水提时间为1.0 h时,第1次0.6 h、第2次0.4 h;水提时间为2.0 h时,第1次1.2 h、第2次0.8 h;水提时间为3.0 h时,第1次2.0 h、第2次1.0 h。
2.4.4 参苓谷物冲调粉提取物水提响应面试验安排及结果 响应面试验安排及结果见表7,表7共14个试验点,其中12个为析因点,2个为零点,析因点为自变量取值水提温度(A)、加水量(B)和水提时间(C)所构成的顶点,零点为区域的中心点,其中零点试验重复2次,用以估算试验误差。
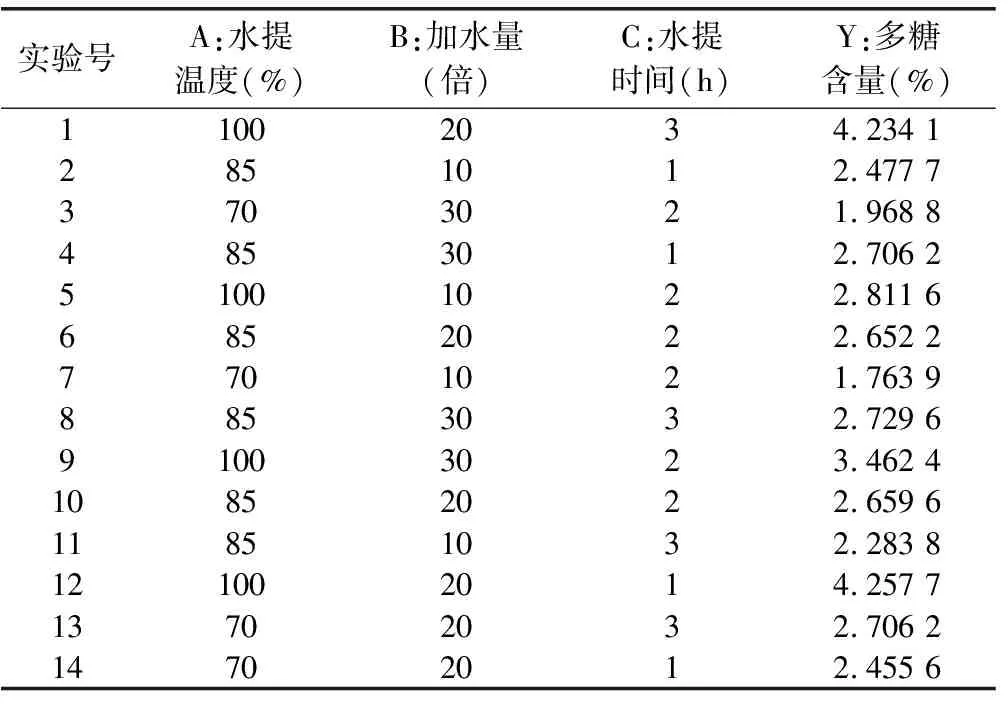
表7 参苓谷物冲调粉提取物水提响应曲面设计试验测定结果
2.4.5 模型的建立及显著性分析 利用Design Expert8.0软件对表3试验数据进行二次回归拟合,得Y值对水提温度(A)、加水量(B)和水提时间(C)的二次多项回归模型方程为:Y=2.66+0.73×A+0.19×B+7.062E-003×C+0.11×A×B-0.069×A×C+0.054×B×C+0.35×A2-0.51×B2+0.40×C2,对该模型进行显著性检验。结果见表8。
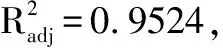
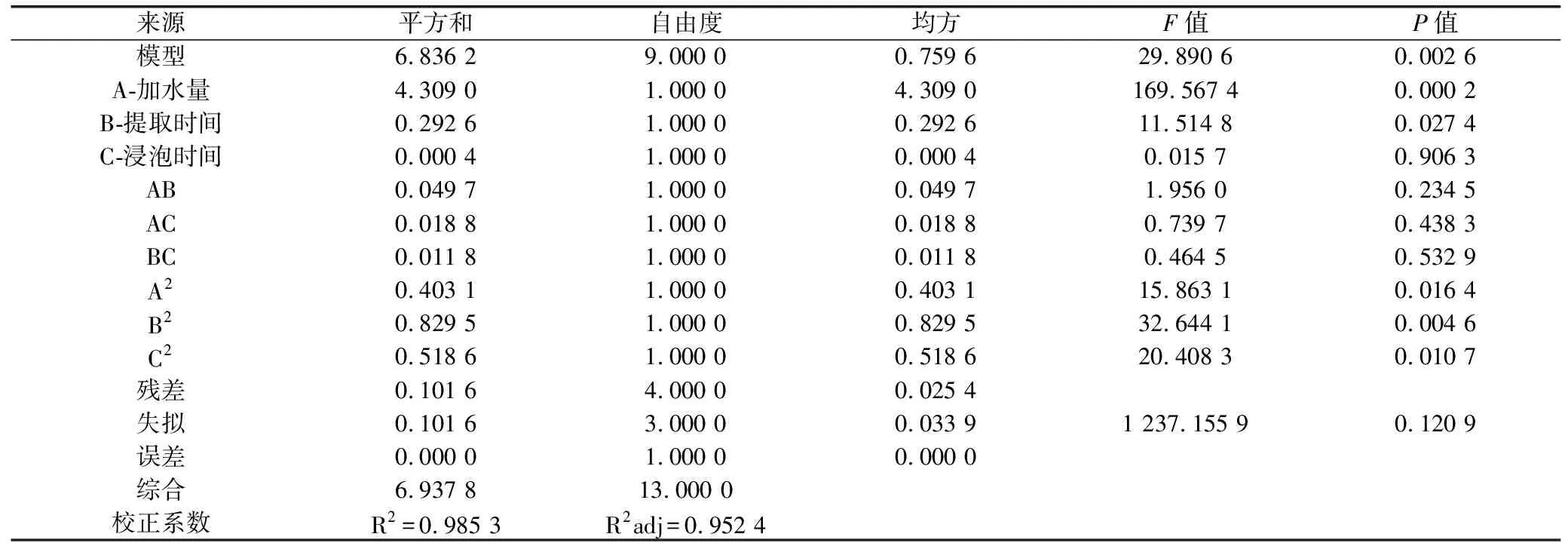
表8 回归模型方差分析
2.4.6 参苓谷物冲调粉提取物水煎工艺各因素对加强指数影响的曲面分析 利用Design Expert 8.0软件对参苓谷物冲调粉提取物水煎工艺数据进行处理得到曲面分析结果见图7、图8、图9。从回归方程各项方差的进一步检验也可看出,一次项中影响显著因素为水提温度、加水量,在所选的各因素水平范围内,按照对结果的影响排序,即水提温度>加水量>水提时间。3个因素中,各两两因素之间交互作用不明显。
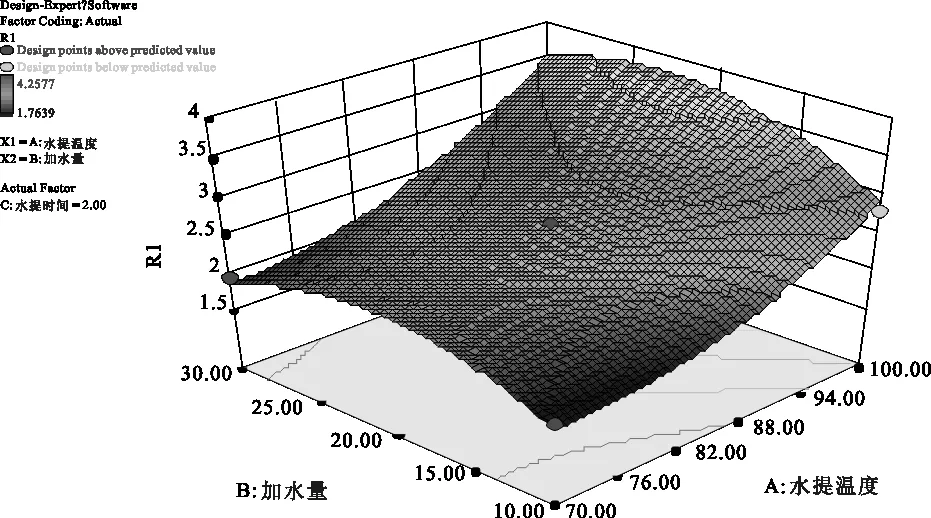
图7 水提温度(A)和加水量(B)对Y值影响的曲面图
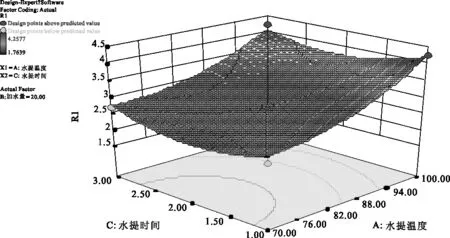
图8 水提温度(A)和水提时间(C)对Y值影响的曲面图
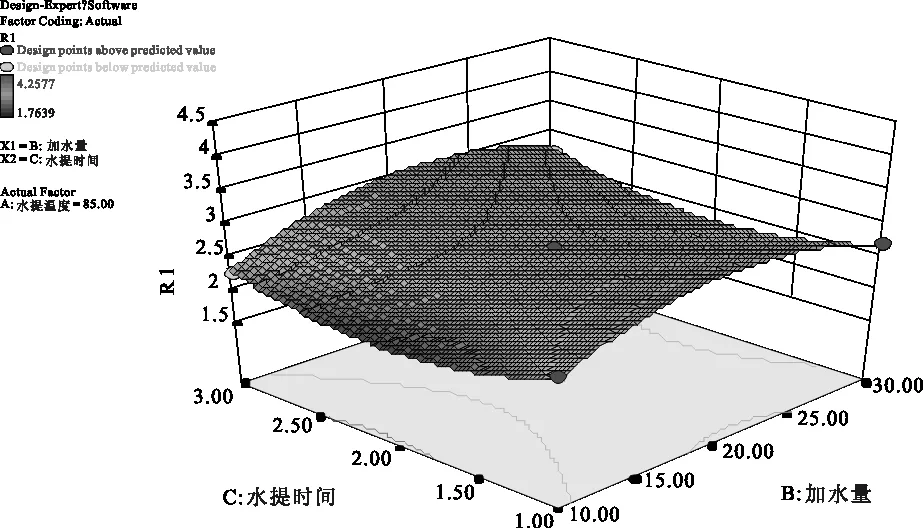
图9 加水量(B)和水提时间(C)对Y值影响的曲面图
2.4.7 参苓谷物冲调粉提取物水煎工艺条件优化结果 采用Design-Expert 8.0软件对方程Y求解,得到参苓谷物冲调粉提取物水煎的最优工艺参数:水提温度为100 ℃,加水量为22.43倍,水提时间为3.0 h,理论上Y值为4.239 %。
2.4.8 验证试验结果 对参苓谷物冲调粉提取物水提工艺所得到的优化条件进行微调:水提温度为100 ℃,第1次提取加水量为12倍,水提时间为2.0 h,第2次提取加水量为10倍,水提时间为1.0 h。3批验证试验实际测得Y值为4.213 %,RSD=2.92 %(n=3),与理论值相接近,因此基于响应曲面法所得的优化水提提取工艺参数准确可靠。
3 讨论
参苓谷物冲调粉由药材和食材组成,其是由中药材制成的干浸膏粉与谷物食材混合制成的便捷营养冲调粉,添加天然调味剂、调色剂而来。本研究对药材提取工艺及参数进行了系统研究,为后续的喷雾干燥制成干浸膏粉工艺研究奠定了基础并提供了参考依据,具有实用意义和应用价值。
乙醇浓度、加醇倍量对药材中人参皂苷的提取量影响显著。从理论上讲提取次数越少越好,提取次数太多,时间周期长,效率低,溶剂倍数多,给浓缩带来不便。本实验经过多次反复研究,得出最优醇提工艺参数为醇提2次,浸泡时间1.0h,62%乙醇,加乙醇量为药材量的12倍、8倍,醇回流时间为2.0h、1.0h;最优水提工艺参数为水提2次,浸泡时间2h,水提温度100℃,加水量为药材量的12倍、10倍,水提时间为2.0h、1.0h。采用该醇提方法提取本方中人参、黄精、陈皮中的皂苷成分,水提方法提取本方中茯苓、枸杞、山药、白扁豆等的多糖成分成本较低、操作简便、提取条件易于控制且提取效率较高,在工业化大生产中具有广泛的应用前景。
采用苯酚-硫酸法测定本方水提液中多糖的含量误差较大,系导致响应面设计实验结果无统计意义的主要原因,应增加多糖测定的重复次数,以重复试验的误差作为误差来源,系本研究的不足之处。
