日照海岸线可培养放线菌的抑菌活性及其多样性研究
2019-02-14梁光杰车程川巩志金刘金锋姜曰水刘宝晴
梁光杰,车程川,曹 利,巩志金,刘金锋,姜曰水,孙 萍,刘宝晴,杨 革*
(曲阜师范大学 生命科学学院,山东 曲阜 273165)
放线菌是细菌中较大的门之一,属于革兰氏阳性菌,脱氧核糖核酸(deoxyribonucleic acid,DNA)中含有较高的鸟嘌呤(guanine,G)+胞嘧啶(cytosine,C)含量[1]。放线菌因其能产生具有重大经济意义的次级代谢产物和其他具有药用意义的化合物被认为是重要的微生物[2-4]。近几十年来,有研究[5-7]已从陆地环境中分离到大量放线菌菌株,并对陆生放线菌的多样性及其次级代谢产物进行了广泛深入的研究,取得了一系列成果。但从陆生放线菌中发现新的放线菌菌株及产具有生物活性化合物的放线菌变得日益困难。
由于海洋特殊的生长环境,如高盐度、高压力和较低的温度,海洋微生物多种多样且产生多种生物活性的次生代谢产物[8]。随着海洋资源的开发,包括海水[9]、海洋冰雪和海洋沉积物[10],在海洋环境中产生新型生物活性次级代谢物的放线菌引起了越来越多的关注[11-14]。MALDONADO L A等[15]对加利福尼亚湾海洋沉积物的研究发现近300株放线菌,属于马杜拉放线菌属(Actinomadura)、迪茨氏菌属(Dietzia)、戈登氏菌属(Gordonia)、小单孢菌属(Micromonospora)、野野村菌属(Nonomuraea)、红球菌属(Rhodococcus)等。在30个有代表性的属中,链霉菌属是最丰富的种属,而其他20个属,如小单胞菌属(Micromonospora)和盐孢菌属(Salinispora)则较少。然而,这两个属在其他海洋生态系统中被报道为优势属[16-19],说明海洋环境中具有丰富的放线菌资源。
日照海岸线位于黄海以东、渤海与黄河三角州之间,其独特的地理位置形成了优越的生态环境,丰富的微生物资源远未开发。因此,本研究对该海岸线海洋放线菌进行筛选,并对其抑菌活性及多样性进行研究,为今后该地区放线菌资源和海洋新药的开发提供了理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 指示菌
大肠杆菌(Escherichia coli)ATCC25922、金黄色葡萄球菌(Staphylococcus aureus)ATCC25923、产气杆菌(Aerobacter aerogenes)CGMCC 1.183、变形杆菌(Proteus)CGMCC 1.491、铜绿假单胞菌(Pseudomonas aeruginosa)CGMCC 1.15148、黄曲霉(Aspergillus flavus)CGMCC 3.3950:均由本实验室保存。
1.1.2 试剂
可溶性淀粉、硝酸钾、磷酸二氢钾、磷酸氢二钾、氯化钙、碳酸钙、硫酸铵、氯化钠、氯化钾、苯酚、磷酸氢二钠、七水硫酸亚铁、七水硫酸镁(均为分析纯):国药集团化学试剂有限公司;腐殖酸、甘油、精氨酸、几丁质、海藻糖、脯氨酸、酪蛋白、丙酸钠、萘啶酮酸、制霉菌素、放线菌酮(均为生化试剂):生工生物工程(上海)股份有限公司;革兰氏阳性细菌DNA提取试剂盒:北京索莱宝科技有限公司。
1.1.3 培养基
腐殖酸(humic vitamin acid,HVA)培养基:腐殖酸1 g,CaCO30.02 g,Na2HPO40.5 g,MgSO4·7H2O 0.05 g,KCl 1.7 g,FeSO4·7H2O 0.01 g,维生素B(vitamin B,VB)1 mL,琼脂18 g,水1 000 mL。121℃灭菌20 min。
甘油精氨酸(glycerine arginine,GA)培养基:甘油6mL,精氨酸1 g,FeSO4·7H2O 0.01 g,MgSO4·7H2O 0.5 g,K2HPO41 g,琼脂18 g,水1 000 mL。115℃灭菌30 min。
M4培养基:几丁质2 g,K2HPO40.7 g,KH2PO40.3 g,MgSO4·7H2O 0.5 g,琼脂18 g,水1 000 mL。121℃灭菌20 min。
海藻糖脯氨酸琼脂(trehalose proline agar,TPA)培养基:海藻糖5 g,脯氨酸1 g,NaCl 1 g,CaCl22 g,K2HPO41 g,MgSO4·7H2O 1 g,(NH4)2SO41 g,VB 1 mL,琼脂18 g,水1 000 mL。115℃灭菌30 min。
酪蛋白丙酸钠琼脂(casein sodium propionate agar,CSPA)培养基:酪蛋白2 g,丙酸钠4 g,MgSO4·7H2O 0.1 g,K2HPO40.5 g,CaCO32 g,琼脂18 g。115 ℃灭菌30 min。
以上所有筛选培养基都用自然海水配制,调节pH至7.5~8.0,并且加入萘啶酮酸(25μg/mL)、制霉菌素(50μg/mL)、放线菌酮(50μg/mL)抑制细菌跟真菌的生长[20]。
高氏一号(M1)液体培养基:可溶性淀粉20 g,KNO31 g,KH2PO40.5 g,FeSO4·7H2O 0.01 g,MgSO4·7H2O 0.05 g,NaCl 0.5 g,水1 000 mL。121℃灭菌20 min。
M1固体培养基:在M1液体培养基中加入琼脂18 g。
1.2 仪器与设备
DK-8D电热恒温水槽:上海精宏实验设备有限公司;PHS-3CpH计:上海仪电科学仪器股份有限公司;SW-CJ-2D净化工作台:苏州净化设备有限公司;GNP-9080隔水式恒温培养箱;Lab-Therm LT-X振荡培养箱:比欧科技国际发展有限公司;1-14小型台式离心机、3-18KS高速冷冻离心机:美国Sigma公司;SZ-93A自动双重纯水蒸馏器:德国默克密理博公司;CL-32L高压蒸汽灭菌锅:日本ALP公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIO-RAD公司。
1.3 方法
1.3.1 样品的采集
样本采集于日照海岸线的海洋沉积物、泥沙和沙子,采样地点被编号为T1、T2、T3、T4、T5、T6、T7、T8、T9和T10,共采集了35份样本于4℃条件下储存,用于筛选菌株。样品信息见表1。
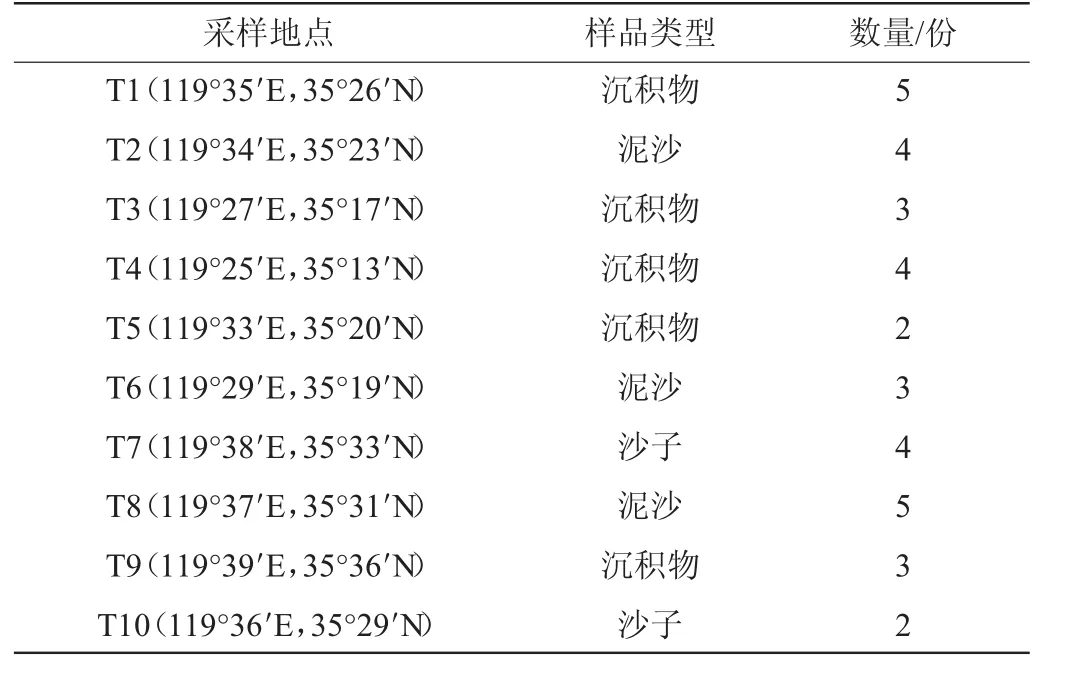
表1 样品信息Table 1 Information of samples
1.3.2 放线菌的筛选
使用不同的预处理方法和培养基筛选放线菌。预处理方法1(F1):样品自然风干14 d;预处理方法2(F2):121 ℃真空干燥2 h;预处理方法3(F3):样品按照1∶10(g∶mL)料水加入1.5%苯酚溶液,在30℃条件下浸泡30 min[21];预处理方法4(F4):样品按照1∶10(g∶mL)料水比加入无菌水在55 ℃条件下加热15 min[22];预处理方法5(F5):采用差速离心法(dispersion and differential centrifugation,DDC)法对样品进行处理[23]。预处理后的样品用25%林格氏液进行梯度稀释。取100 μL梯度稀释的样品悬液(10-1、10-2、10-3、10-4)涂布于筛选培养基(HVA培养基、GA培养基、M4培养基、TPA培养基、CSPA培养基)上。
涂布好的筛选培养基于28℃条件下静置培养1~4周,然后采用M1固体培养基对生长出来的放线菌进行分离纯化,将纯化后的放线菌保藏于-80℃,备用。
1.3.3 抑菌活性测试
将筛选出的放线菌接种至M1液体培养基中,28℃、180 r/min条件下培养14 d,发酵液经10 000 r/min离心10 min,取上清。收集的上清液经0.22μm过滤器过滤,4℃储存,用于抑菌活性测试。
使用牛津杯法测定所筛选菌株的抑菌活性[24]。吸取0.2 mL指示菌菌液到培养基表面,涂布均匀,在培养基表面垂直摆放牛津杯,轻轻安放,使其与培养基接触无空隙,在牛津杯中加入0.2 mL发酵上清液,于一定条件下培养。其中大肠杆菌、金黄色葡萄球菌、产气杆菌、变形杆菌和铜绿假单胞菌于37℃条件下培养24 h,黄曲霉于28℃条件下培养72 h。培养结束后,按照十字交叉法采用游标卡尺测抑菌圈直径。
1.3.4 放线菌多样性分析
基因组DNA的提取:将放线菌菌株接种到50 mL M1液体培养基中,28℃、180 r/min条件下培养2 d。12 000 r/min条件下离心5 min,收集菌体,使用革兰氏阳性细菌DNA提取试剂盒提取基因组DNA。
16SrRNA基因PCR扩增:通过PCR扩增放线菌的16S rRNA基因,所用的引物为引物A(5'-AGAGTTTGATCCTGGCTCAG-3')和引物B(5'-AAGGAGGTGATCCAGCCGCA-3')。PCR反应体系为基因组DNA 2μL,2×Master Mix 25μL,引物A和B各2μL,双蒸水(ddH2O)19μL。反应条件为95℃预变性5 min;95℃变性40 s,55℃退火45 s,72℃延伸75 s,共35个循环;72℃再延伸10 min。PCR扩增产物送往济南力戈科技有限公司进行测序。
系统发育树分析:将测序结果与美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库中的序列进行比对[20],采用分子进化遗传学分析软件MEGA 5.0中的邻接法(neighbor joining,NJ)构建系统发育树[25]。
2 结果与分析
2.1 可培养放线菌的筛选
从日照海岸线采集了35份海洋样本,采用不同的筛选培养基及预处理方法进行放线菌的筛选。培养1~4周后,根据菌落形态特征挑选单菌落,并在M1固体培养基上进一步分离纯化,共分离到208株放线菌,不同类型样品中所筛选到的放线菌数量结果见表2。

表2 不同类型样品中所筛选到的放线菌数量Table 2 Number of Actinobacteria isolated from different samples
由表2可知,从海洋沉积物样品中分离的放线菌数量(173株)远远高于从泥沙(30株)和沙子(5株)样品中分离的放线菌数量,原因可能是海洋沉积物样品中含有丰富的各种营养物质,有利于放线菌的附着、生长和繁殖。不同采样地点、培养基种类及预处理方法条件下所筛选到的放线菌数量结果见图1。
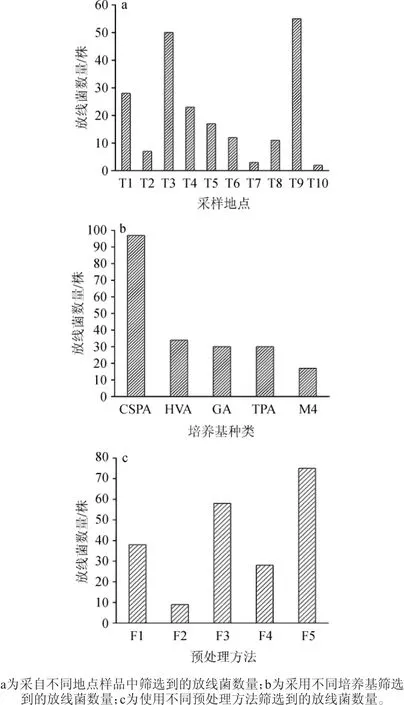
图1 不同条件下筛选到的放线菌数量Fig.1 Number of Actinobacteria isolated under different conditions
由图1a可知,从采样点T9样品中筛选到的放线菌数量最多,为55株,然后依次是T3(50株)、T1(28株)、T4(23株)、T5(17株)、T6(12株)、T8(11株)、T2(7株)、T7(3株)、T10(2株),表明采样点T1、T3、T9具有开发海洋放线菌资源的巨大潜力,并且为以后进一步开发日照海岸线放线菌资源提供了地理位置信息。YUAN M等[20,26]对世界其他海域的放线菌进行了筛选。如ATALAN E等[23]从Chukchi Shelf海洋沉积物中筛选到73株放线菌;SOLANO G等[26]从北太平洋及哥斯达黎加的加勒比海岸中筛选到137株放线菌。而本研究从日照海岸线中共筛选出208株放线菌,说明日照海岸线具有丰富的放线菌资源。
鉴于大多数海洋放线菌不能从一种培养基中获得,因此使用适当的分离培养基来改善放线菌的筛选至关重要[27]。本研究采用5种不同的培养基对放线菌进行筛选。
由图1b可知,采用CSPA培养基筛选到的放线菌数量最多(97株)。其他培养基HVA、GA、TPA、M4所筛选出来的放线菌数量依次为34、30、30、17株,表明CSPA培养基更适合该地区的放线菌的筛选。原因可能是CSPA培养基中含有丙酸钠,丙酸钠可以抑制部分细菌和真菌的生长,从而降低其与放线菌的竞争作用,更加有利于放线菌的生长,而且本研究中所有培养基都采用日照海岸线的自然海水配制,最大还原了放线菌生长的自然环境,所以有利于放线菌的筛选。
由图1c可知,预处理方法F5筛选到的放线菌数量最多,为75株,其他预处理方法F3、F1、F4、F2所筛选到的放线菌数量依次为58株、38株、28株、9株。原因可能是预处理方法F5以去氧胆酸钠为弱的表面活性剂,综合运用了物理化学手段(超声、振荡、化学溶剂),能尽可能的破坏样品颗粒的聚集将放线菌释放出来,再通过细度分选、分步收集,将样品中混生的微生物有效的分离出来。
2.2 放线菌的抑菌作用
对所筛选的208株放线菌进行抑菌活性测试,其中91株放线菌至少对一种病原体表现出抑制作用。不同采样地点所筛选出的具有抑菌效果的放线菌数量见表3。
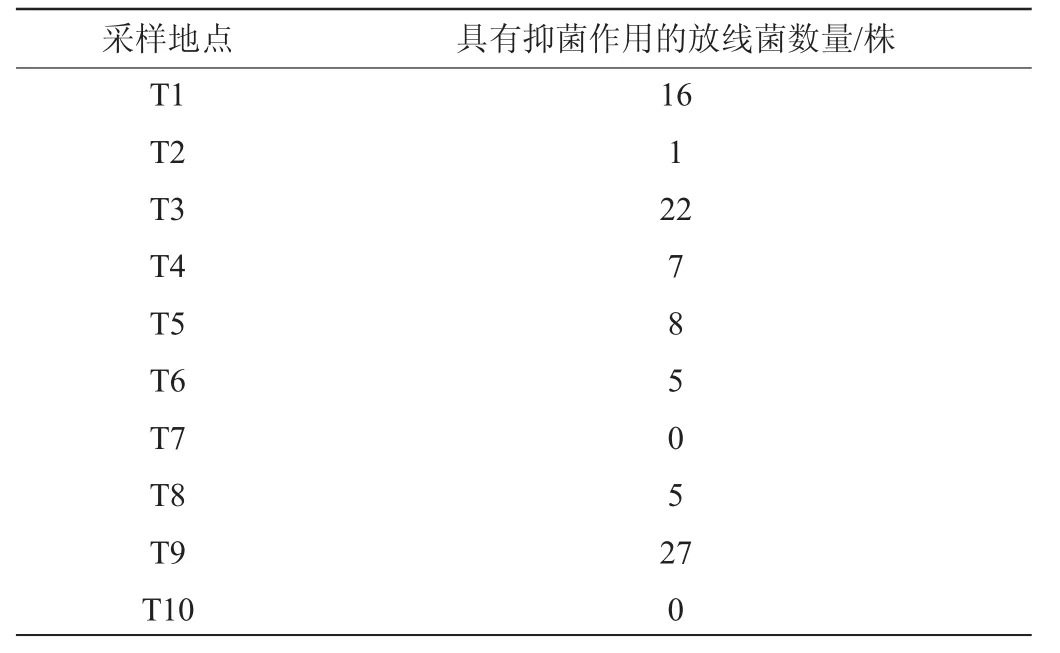
表3 不同采样地点所筛选到的具有抑菌效果的放线菌数量Table 3 Number of Actinobacteria with antibacterial activities isolated from different sampling sites
由表3可知,采样点T9、T3、T1所筛选到的具有抑菌活性的放线菌数量较多,分别为27株、22株、16株,说明这3个采样点含有丰富的具有抑菌活性的放线菌。在91株具有抑菌活性的放线菌中,抑制各个指示菌的放线菌数量见图2。
由图2可知,在91株具有抑菌活性的放线菌中,38.46%(35株)的放线菌对产气杆菌具有抑制作用,27.47%(25株)的放线菌对变形杆菌具有抑制作用,18.68%(17株)的放线菌对金黄色葡萄球菌具有抑制作用,9.89%(9株)的放线菌对大肠杆菌具有抑制作用,2.2%(2株)的放线菌对铜绿假单胞菌具有抑制作用,3.3%(3株)的放线菌对黄曲霉具有抑制作用。其中抑菌活性较好的25株放线菌的抑菌活性见表4。

图2 抑制各个指示菌的放线菌数量Fig.2 Number of Actinobacteria inhibiting each indicator microbes

表4 25株放线菌的抑菌活性Table 4 Antibacterial activity of 25 Actinobacteria
由表4可知,25株放线菌对指示菌的抑菌圈均≥10 mm,显示出良好的抗菌活性(牛津杯的直径为6 mm,抑菌圈直径>6 mm被认定具有抑菌活性[28]),其中菌株F8、Y6和B11具有广谱抗菌活性,菌株Y6、C、F8和B11的抗菌活性透明圈见图3。

图3 菌株B11、F8、C及Y6的抑菌活性Fig.3 Antibacterial activity of strains B11,F8,C and Y6
2.3 放线菌多样性分析
选取上述25株具有良好抑菌活性的放线菌进行16S rRNA基因序列分析。将25株放线菌的16S rRNA基因序列提交至NCBI,获得GenBank登录号。25株放线菌菌株的GenBank登录号及其16S rRNA基因与其他菌株的相似性见表5,系统发育树见图4。
由表5及图4可知,基于16S rRNA基因序列分析,将25株放线菌菌株初步分为22个种系,3个不同的属。其中链霉菌属(Streptomyces sp.)菌株数量最多(18株),其次是拟诺卡氏菌(Nocardiopsis sp.)(4株)和糖单胞菌属(Saccharomonospora)(3株)。结果表明,本研究中分离的放线菌表现出一定的多样性,且链霉菌属为优势菌属。与SOLANO G等[26,29-30]的研究结果一致,说明在大多数海洋环境中链霉菌属在放线菌中是优势菌属。
有研究表明[31-33],链霉菌属是新型抗生素的生产者,大约75%用于商业生产的抗生素来自链霉菌。如Stretomyces sannanensis可以产生新的化合物(氨基糖苷类抗生素、sannamycinsA、B和C)来抑制革兰氏阳性细菌[34-35];从海洋链霉菌(Streptomyces sp.)MSU5中分离出具有抗钩端螺旋体潜力的化合物细霉素B等[36-38]。由此可见,本实验中筛选到的链霉菌具有很大的开发价值。
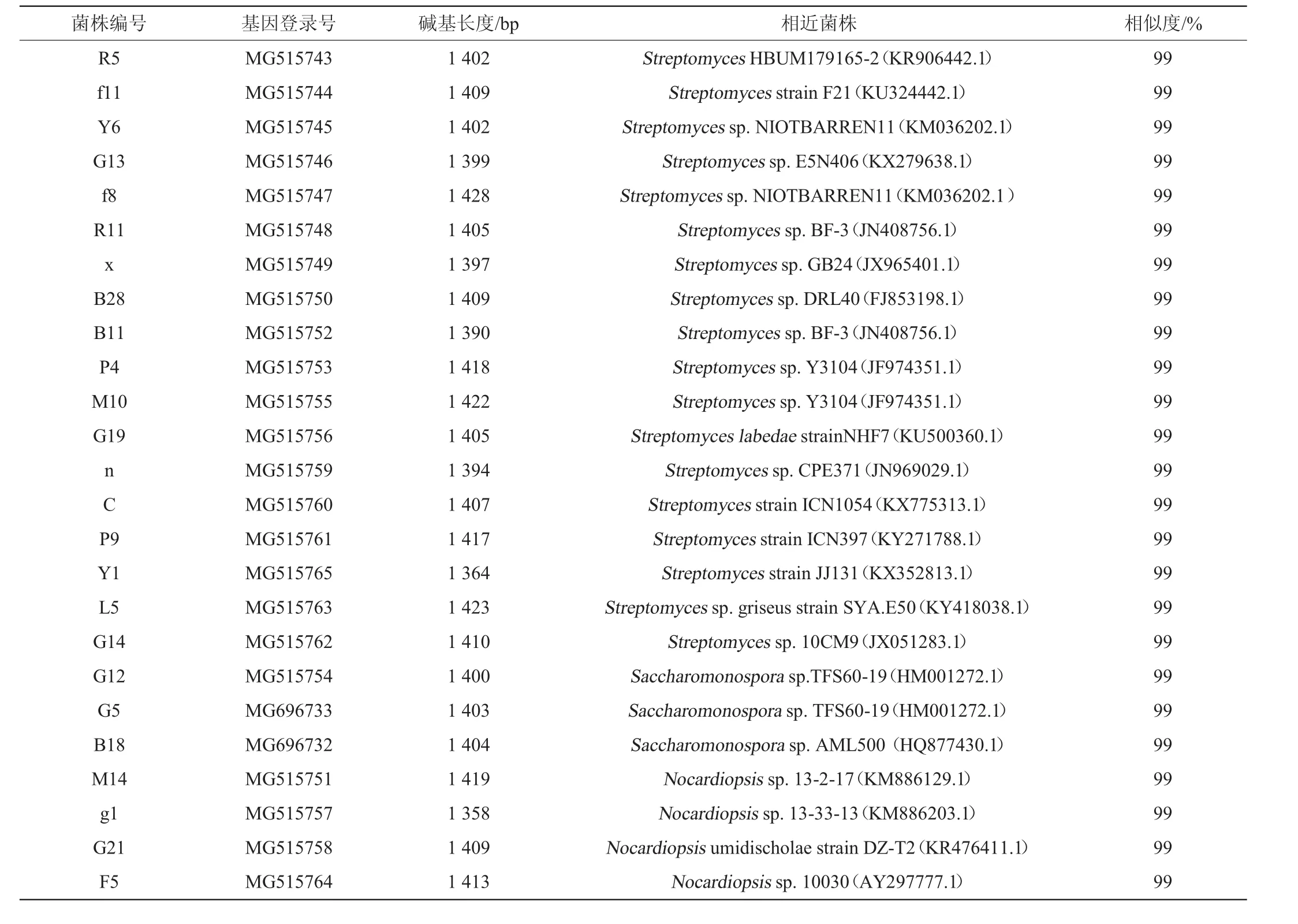
表5 25株放线菌菌株的GenBank登录号及其16S rRNA基因序列与其他菌株的相似性Table 5 GenBank accession number and similarity of 16S rRNA gene sequences of 25 Actinobacteria strains with other strains
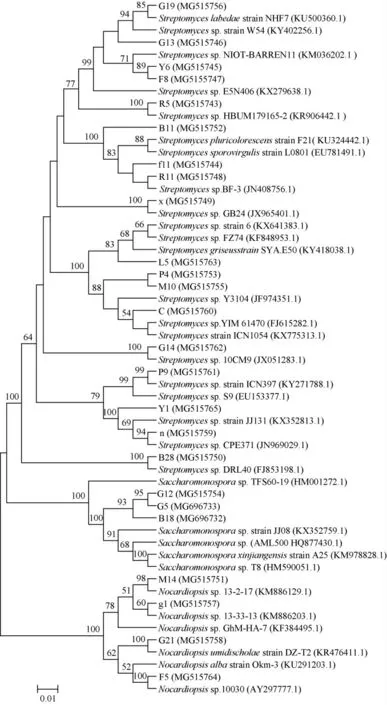
图4 25株放线菌菌株基于16S rRNA基因序列的系统进化树Fig.4 Phylogenetic tree of 25 Actinobacteria strains based on 16S rRNA gene sequences
3 结论
本研究从日照海岸线不同地区样品中共分离到208株放线菌,其中91株具有抑菌活性。35株对产气杆菌有抑制作用,25株对变形杆菌有抑制作用,17株对金黄色葡萄球菌有抑制作用,9株对大肠杆菌有抑制作用,2株对铜绿假单胞菌有抑制作用,3株对黄曲霉有抑制作用。25株抗菌活性较好的菌株经分子生物学鉴定,分为22个种,3个不同的属:链霉菌属(Streptomyces sp.)18株,拟诺卡氏菌属(Nocardiopsis sp.)4株和糖单孢菌属(Saccharomonospora sp.)3株。结果表明,日照海岸线具有丰富的放线菌资源,链霉菌属为优势菌属,为今后该地区放线菌资源及新型海洋药物的开发奠定了基础。
