面向食源性病原菌检测的微流控阻抗传感器研究综述
2019-02-14郭黎明厉志安陈永良
李 琛,郭黎明,厉志安,陈永良
(中国计量大学 质量与安全工程学院,中国 杭州 310018)
近年来,食源性病原菌引起的疾病构成了公众健康和食品安全的严重威胁,对全球社会经济发展构成重大阻碍[1-2]。经研究,细菌是最常见的食源性病原菌[3],在这些细菌中,沙门氏菌、李斯特菌、大肠杆菌O157∶H7、金黄色葡萄球菌和蜡状芽孢杆菌是主要的食源性病原菌[4]。因此,食源性病原菌快速检测装置与检测技术的开发具有重要意义。
在过去几十年中,人们在快速检测食源性病原菌方面作出了巨大努力,研究了多种检测技术。除了常规的细菌培养计数法之外,还有多种其他方法,例如基于核酸的、基于免疫学的和生物传感器(例如光学、电化学和基于质谱的生物传感器)用于快速检测食源性病原菌[5-6]。目前,酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA)和聚合酶链式反应(Polymerase Chain Reaction,PCR)可以将测定时间缩短至4~6 h,并且已经实现101~106CFU/mL的检测范围,广泛应用于生物检测及其它领域[7]。阻抗生物传感器凭借其便携性、快速性、高灵敏度并且适于现场检测的优势,成为基于生物传感器的食源性病原菌检测的有效方式之一[8-10]。近来微流控技术受到广泛关注[11],该技术可以将富集、捕获、检测、分析等过程集成到芯片中来进行以提高检测性能[12],它与生物传感的结合提供了高通量分析和集成微量化的优势,从而在细菌检测方面实现智能即时诊断[13-15]。微流控技术与阻抗型生物传感器的结合为病原菌的检测提供了更广阔的前景,特别是在生物传感器这一领域中,新技术(如纳米技术等)的研发为促进病原菌富集过程和改善阻抗信号提供强有力的技术支持,提高了检测灵敏度。本文简单介绍微流控阻抗检测原理,回顾了基于微流控技术的阻抗传感器在食源性病原菌检测方面的进展和应用,特别是近期的发展,最后讨论了对于当前微流控阻抗传感器面临的问题挑战和发展趋势。
1 微流控阻抗传感器及检测原理
微流控阻抗传感器是一种基于微流控系统,将生物浓度转换为电化学阻抗信号进行鉴定检测的仪器。微流控阻抗生物传感器在病原菌检测方面具有响应时间快、试剂消耗少、无标记检测、操作简便和易于微型化及自动化的仪器设备开发的特点,是现场检测较有前途的分析工具。微流控阻抗传感器的阻抗检测原理是以微流控芯片系统为平台,将生物识别分子及对应的检测物注入到微通道内,随后固定在导电(或半导体)换能器表面,通过检测物与换能器表面处的生物识别分子形成特异性复合物,直接或间接地改变识别表面的阻抗信号,建立阻抗信号的变化情况与检测物浓度之间的关系以达到检测的目的。
在微流控阻抗检测系统中,电化学阻抗通常以很小的正弦波电位激发信号测得。电阻抗(Z)定义为电压增量变化与电流变化的比值V(t)/I(t)。根据该定义,阻抗Z是电压-时间函数V(t)与所得到的电流-时间函数I(t)的商:
(1)
其中V0和I0是最大电压和电流信号,f是频率,t是时间,φ是电压时间和电流时间函数之间的相移[16]。同时阻抗是复数值,可表示为实部ZRe和虚部ZIm两部分:
Z=ZRe-jZIm。
(2)
所以,阻抗测量的结果可用两种不同形式的电化学阻抗谱EIS来描述:一种是以实部为X轴,虚部为Y轴的Nyquist图。Nyquist图的每一点对应阻抗中的一个频率,低频率在右,高频率在左;另一种是以频率对数为X轴,阻抗绝对值和相角为Y轴的Bode图,Bode图可显示频率与阻抗值、相角的关系。
为了表达固定生物分子和细菌结合后的表面、层或膜的表征,分析电解质和电极上介质的阻抗变化,从而确定系统阻抗变化的主要因素,通常使用等效电路分析EIS[17]。等效电路模型由电阻、电容等元件组成,常用电学元件一般包括电解质溶液电阻、双电层电容、电子转移电阻、Warburg阻抗等,每个元件代表一种或几种电极过程和电化学性质[8]。

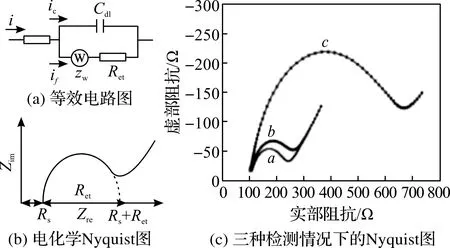
图1 等效电路图及电化学Nyquist图[19-21]
VARSHNEY等[22]用微流控阻抗法检测大肠杆菌O157∶H7过程中,用等效电路拟合电化学阻抗Bode图分析阻抗变化机理。如图2(a),等效电路模型中,两个双层电容Cdl和电解质电阻Rs串联,并与介质电容Cdi并联。双电层电容Cdl表示离子种类对电极表面电容的影响;电解质电阻Rs表示电解质溶液的导电率变化;Cdi表示电解质溶液的介质电容。检测结果如图2(b),在低频段(10 Hz~1 kHz),阻抗信号变化由双电层电容Cdl主导;在中频段(1 kHz~50 kHz),阻抗信号由电解质电阻Rs主导;在高频段(50 kHz~1 MHz),阻抗信号由介质电容Cdi主导。由图2(c)还可得出,在检测范围内,阻抗随着大肠杆菌数的增加而增加,大肠杆菌吸附在电极上时电解质电阻Rs增加,Rs增加成为阻抗变化的主要原因。

图2 等效电路图及电化学阻抗Bode图[22]
2 微流控阻抗检测技术
生物识别配体捕获靶细菌的特异性和有效性、换能器材料表面的阻抗信号水平和辅助富集能力都是决定微流控阻抗传感器灵敏度的重要因素。实际样品中的各种污染物可能会起到抑制作用,导致产生假阴性结果。因此,合适的换能器和检测前的富集步骤可以帮助提高检测的灵敏度[23]。大量研究文献显示,采用基于叉指阵列微电极的检测技术、介电泳技术和纳米技术可以提升病菌的捕获率和提高阻抗信号水平,以提高微流控阻抗传感器的检测灵敏度。
2.1 基于叉指阵列微电极检测技术
叉指阵列微电极(Interdigitated array microelectrodes,IDAM)包含一对微带电极阵列,每个阵列由多个宽度和间距为微米级的指电极并联组合而成,电极之间相互啮合形成叉指状电极阵列[24]。IDAM具有较高的灵敏度,可以缩短检测时间、提高信噪比,并且可直接检测电极间介质的阻抗变化。据RUAN等[25]实验得出的结论,氧化烟锡(Indium tin oxide,ITO)涂覆的普通玻璃电极表面上大肠杆菌抗体对于大肠杆菌O157∶H7仅显示16%的捕获效率,相比之下,IDAM由于检测区域中每单位体积的靶细胞数目增加,可将捕获效率提升至35%[26]。GHOSH等[27]研究表示,基于IDAM检测技术,结合微流控技术更能进一步将阻抗响应信号提高3倍,将检测灵敏度提升10倍。
GOMEZ等[28]制造了首个集成白金IDAM的硅基微流控芯片,以阻抗法检测微生物的代谢活性。VARSHNEY[22]将微流体流通池与嵌入式金IDAM整合到一个阻抗生物传感器中,快速检测碎牛肉样品中的致病菌。他们将IDAM芯片结合在PDMS制作的微通道上,整个流通池由检测微型腔室、入口、出口和微通道组成。使用尺寸为6 mm×0.5 mm×0.02 mm即体积为60 nL的检测微型腔室来收集微电极上方活性层中的细菌细胞。结合免疫磁分离技术分离和浓缩靶细菌,该装置在纯培养物和牛肉样品中检测大肠杆菌O157∶H7,检测限分别低至1.6×102和1.2×103CFU/mL,检测时间低于30 min。
微流控阻抗传感器中,使用IDAM作为换能器材料的检测技术最为普遍,IDAM的制作材料也很多,如金、ITO、Pt、Ti、Rh等材料,例如GHOSH[27]在微流控芯片中利用金叉指阵列微电极固定抗体检测鼠伤寒沙门氏菌,中国农业大学的陈奇等人[29]基于ITO叉指阵列微电极的微流控阻抗检测李斯特菌。不同IDAM材料的微流控阻抗传感器检测病原菌实例见表1。

表1 不同IDAM材料的微流控阻抗传感器实例表
注:“-”文中没有提到
IDAM研究前景广阔,但IDAM仍存在一些缺陷,由于IDAM芯片可重复检测次数少,从而使检测成本提高,若能实现多次检测,则能降低成本,这需要在今后的研究中改善IDAM制作工艺和完善生物分子的固定化技术和方法。此外,裸IDAM的病菌捕获效率仍较低,近来的研究中通过采用富集技术提高病菌捕获率,如介电泳技术、免疫磁分离技术和纳米材料等,但也变相地复杂化了传感器的制作过程。此外,将IDAM有效地集成在微流控芯片上也面临着挑战,亟待采用更先进的加工技术和先进的材料使得IDAM微流控阻抗传感器的制作得到进一步发展,性能得到进一步提高。
2.2 介电泳技术
介电泳(Dielectrophoresis,DEP)是介电极化材料在非均匀电场中的电动运动,用于阻抗测量的介电泳称为介电泳阻抗技术。在微流控芯片上使用DEP能够高效地富集靶细胞,具有低检测限和高通量检测的优势,因此介电泳技术成为微流控阻抗检测病原菌的有效技术之一[37-38]。
GOMEZ等[30]开发了基于DEP技术的微流控阻抗传感装置。设计理念是使用DEP将细菌细胞从主通道转移到一个小通道中,含细菌的低通量微流体进入体积为400 μL的测量室,不含细菌的高通量微流体由出口排出,如图3所示。将采用DEP技术和未采用DEP得出的李斯特菌细胞的阻抗增长曲线进行了比较,DEP作用时阻抗代谢信号在大约1 h处呈指数生长,而含有相似含量的无DEP作用的细胞的样品需要大约7.5 h才产生可检测的阻抗信号,检测时间有了明显减少,2 h内可检测8.0×104CFU/mL的李斯特菌。
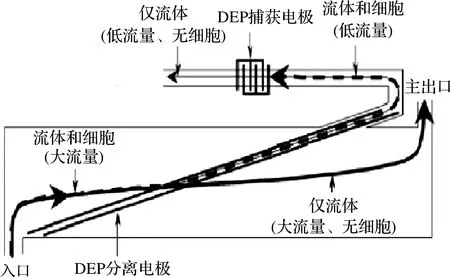
图3 介电泳技术捕获细菌的操作原理图[30]
DASTIDER等[33]使用了两组IDAM检测大肠杆菌O157∶H7。如图4,大肠杆菌O157∶H7从抗原入口注入,第一组IDAM通过正介电泳(pDEP)将大肠杆菌集中到微通道的中心,第二组IDAM作为阻抗检测区域,该检测区域的体积显著小于流动通道的体积,并且大肠杆菌抗体由抗体入口注入,随后固定到检测电极上以捕获大肠杆菌O157∶H7。阻抗结果显示,大肠杆菌O157∶H7的检测限为3×102CFU/mL。KIM[34]使用高pDEP力聚集大肠杆菌并通过感应电极,被捕获的细菌在电极间隙上形成桥。检测后,则通过关闭DEP力释放大肠杆菌细胞。该方法可以1 min内检测大肠杆菌,检测限为3×102CFU/mL。
PAEZAVILES等[39]报道了很多微流控芯片上介电泳技术和阻抗法结合检测病原菌的研究。DEP技术能将病原菌从微流体中有效分离,且检测快速性优势显著。但高DEP收集效率只能在低样本流量下获得,因此仍需要使用过滤或免疫磁分离方法的预分选步骤将样品通量提高,或者近来研究采用磁电泳和声电泳技术进行病原菌高通量高浓度的浓缩[40-42]。

图4 基于DEP的双组IDAM微流控芯片示意图[33]
2.3 纳米技术
纳米材料在微流控阻抗传感器的应用主要有两个目的:改善换能器的响应特性和生物受体的固定基质[43]。纳米材料由于具有高比表面积,良好的电子性质和电催化活性,以及由纳米尺寸和特定物理化学特性引起的良好的生物相容性和吸附性,已被用于提高病菌富集捕获效率和放大检测信号,以提高检测灵敏度,降低检测限[44-45]。目前被应用于微流控阻抗传感器的纳米材料有纳米粒子、纳米孔膜和纳米二维材料等。
2.3.1 纳米粒子
部分纳米粒子(如金纳米粒子)因为优异的导电性和超高表面积,用于增强电子的转移、捕获更多电极表面上的载荷,以改善阻抗信号水平。如KANG等[46]利用双层金纳米粒子和壳聚糖制备了一种微流控阻抗传感器用于检测蜡状芽孢杆菌,双层金纳米粒子的作用是增加抗体固定量和保持抗体活性。该装置检测范围为5.0×101~5.0×104CFU/mL,检测限为10.0 CFU/mL,并且在一定时间内仍保持稳定的阻抗响应。MICHAEL等[47]开发了基于多孔体积微流体检测元件和银增强的金纳米颗粒探针的阻抗免疫传感器,多孔方式用以提升病菌捕获率,银颗粒用以加强阻抗响应,该装置检测限为10 CFU/mL。
纳米粒子除了当做标记物和改善阻抗信号水平之外,磁性纳米粒子可以与目标抗体形成免疫磁珠,免疫磁珠与目标细菌结合形成珠状细菌复合物,这种复合物在外加磁场作用力下做定向移动,最终被吸附和滞留在磁场中,如此可以很容易地从食物基质和样品背景中将目标细菌分离出来,该方法称为免疫磁分离技术。免疫磁分离技术能够有效排除分析样品中的背景干扰,实现样品的纯化和富集,达到缩短检测时间,提高灵敏度的目的[48]。DAMIRA等[49]使用直径为30 nm的磁性纳米颗粒(Magnetic nanoparticles,MNPs)结合功能化的单核细胞增生李斯特菌抗体,成为免疫磁性纳米颗粒。阻抗测量结果表明,在莴苣、牛奶和碎牛肉的样品中可检测到104和105CFU/mL单核细胞增生李斯特菌。近来,借鉴于陈奇[29]和王磊[50]利用纳米颗粒免疫磁分离技术和脲酶放大信号的经验,中国农业大学的姚岚等人[37]巧妙地将用于细菌分离的MNPs、用于生物信号放大的脲酶和用于阻抗测量的微流体芯片结合,实现快速、灵敏和连续流动检测大肠杆菌O157∶H7。
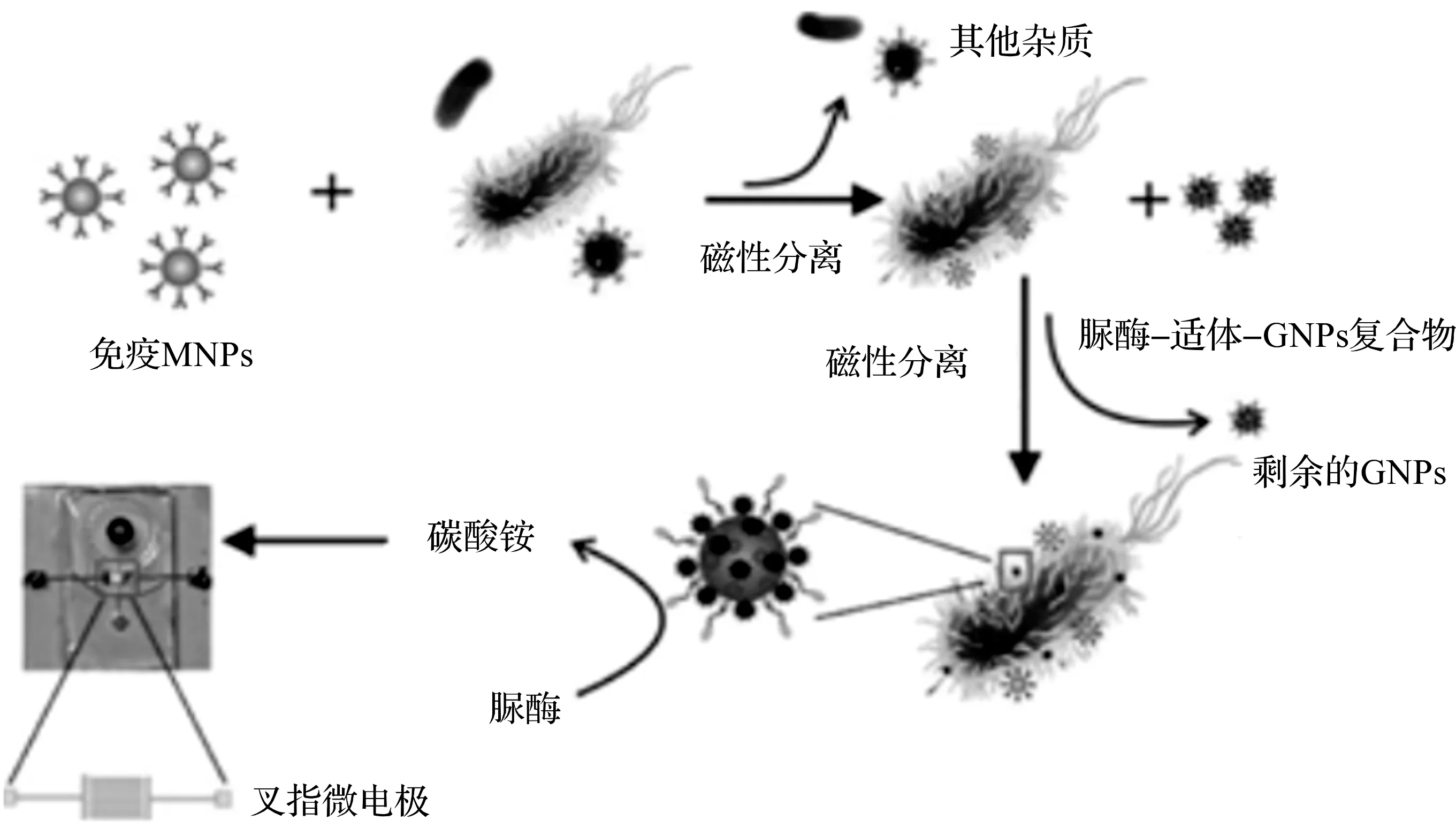
图5 基于免疫磁分离和尿素酶催化的微流体阻抗传感器原理图[37]
如图5,链霉抗生物素蛋白修饰的MNPs与生物素化多克隆抗体结合形成免疫MNPs后,目标细菌首先被MNPs从背景中分离出来,形成MNP-细菌复合物。然后,用脲酶和适配体探针对金纳米颗粒(Gold nanoparticles,GNPs)修饰的大肠杆菌O157∶H7与MNP-细菌进行缀合,最终形成MNP-细菌-GNP-脲酶复合物。最后,配合物被催化尿素水解成碳酸铵,导致阻抗降低。通过该生物传感器在线测量阻抗并使用阻抗归一化分析,获得了阻抗相对变化率与细菌浓度之间的线性关系,确定大肠杆菌O157∶H7的检测限浓度为12 CFU/mL。
磁性纳米粒子在微生物检测领域的应用已经比较成熟,磁性纳米粒子捕获病原菌的效率也可达60%~100%。尤其在磁性纳米粒子、生物配体及官能修饰物的复合作用下,微流控阻抗检出限可以达到更低,但是需要注意多余的磁性颗粒或者磁性颗粒过于密集对于阻抗响应结果带来的干扰。
2.3.2 纳米孔膜
纳米孔氧化铝膜因其优异的生物相容性、高表面积、强化固液界面的电子转移等特点被应用于微流控阻抗传感器中,显著提高了传感器的检测灵敏度。JIANG等[51]以智能手机的传感系统为平台,基于微流体实现细菌预浓缩和电阻抗谱方法实现对水中大肠杆菌的高灵敏度和快速现场检测。该装置通过大量直径为16 μm的纳米氧化铝孔膜过滤掉其他颗粒,被检测细菌则通过过滤膜留在微流体检测室中,通过孔膜的过程相当于细菌被预浓缩处理。随后,分布在叉指电极周围的预浓缩细菌细胞受到阻抗感测。该智能手机传感平台通过扫描频率2~100 kHz获得阻抗谱,大肠杆菌数可由手机程序将测量结果拟合到校准曲线和相应的公式中得出。该装置细菌检测的检出限是10 CFU/mL,检测范围10~103CFU/mL。
TAN等[52]使用纳米多孔氧化铝膜固定抗体,有效检测金黄色葡萄球菌和大肠杆菌O157∶H7。使用三甲氧基硅烷将抗体共价固定在纳米多孔氧化铝膜上,该膜具有13 mm的直径和60 μm的厚度.在纳米多孔氧化铝膜上固定的抗体能够捕获病原菌,并因此导致阻抗增加。该微流体免疫传感器装置可在2 h内快速检测细菌,检测限为102CFU/mL,与传统基于微电极的阻抗传感器相比显示出更理想的灵敏度。TIAN等[53]对上述装置稍作改进,设置了两个纳米多孔膜,可同时检测102CFU/mL的大肠杆菌O157∶H7和金黄色葡萄球菌。
纳米孔膜的应用具有高灵敏度和快速现场检测的优势,但纳米孔膜的缺陷在于其本身制备过程复杂,且生成纳米多孔层的成功率较低,影响传感器的稳定性。总体而言,微流体系统中利用纳米孔膜辅助样品富集仍处于初期状态,因此需要通过改善制造工艺等额外努力来研究这种小型化传感装置的实际应用。
2.3.3 纳米二维材料
石墨烯和二硫化钼(MoS2)是新型的纳米二维材料,它们在设计电化学生物传感器方面引起了研究者的重大兴趣。纳米二维材料无论作为电极材料还是化学修饰作用,都为微流控阻抗传感器带来了更高的灵敏度。
对于石墨烯来说,由于在石墨烯层中所有的碳原子都位于表面,所以分子间的相互作用和电子转移是非常有利的,这些性质使石墨烯成为具有高电导率、良好的电化学反应催化活性和高比表面积的材料[54]。例如PANDEY等[55]就利用了石墨烯优异的电子转移和细菌捕获能力特异性检测大肠杆菌,石墨烯纳米结构直接结合在叉指微电极上捕获细菌并放大阻抗信号,得到10 CFU/mL的检测限。CHANDRA等[56]基于石墨烯包裹氧化铜-半胱氨酸检测大肠杆菌,40 d后,传感器的阻抗响应仍保持初始值的90.2%,证明了石墨烯材料的电催化活性和稳定性。
最近,基于石墨烯和其他纳米材料的协同效应被广泛研究,研究发现石墨烯和其他纳米结构材料复合会进一步提高电子转移和细菌捕获效率。国内学者马小元等[57]提出了一种使用氧化石墨烯和金纳米粒子修饰的玻碳电极作为沙门氏菌检测的阻抗生物传感器,检测限达到3 CFU/mL,在含10~1000 CFU/mL细菌的猪肉样品中中,细菌回收率接近100%。另外,ROMANO等[58]报道,氧化石墨烯-碳纳米管纳米复合材料具有最大化电活性表面积,且可控制孔隙率,可以为固定生物分子提供更大的表面。碳纳米管本身就因具有高表面积和强导电性用于电化学免疫传感器开发检测病原菌,达到了13 CFU/mL的优异检测灵敏度[59]。近来,CHANDAN等[60]用氧化石墨烯纳米片包裹多壁碳纳米管修饰ITO微电极无标记检测鼠伤寒沙门氏菌,测量的阻抗信号相比仅基于多壁碳纳米管/ITO和氧化石墨烯纳米片/ITO修饰的微流控芯片都要高得多。综上,在微流控阻抗器件中应用二维石墨烯基纳米材料的研究取得了很大进展,极大提高了病菌检测的灵敏度,特别是石墨烯和其纳米材料联用产生的协同效应使得纳米技术在高效捕获病菌和放大阻抗信号方面的优势更为显著,但该领域目前的最新技术还不能用于现场或使用点应用。
MoS2具有比石墨烯更高的表面积,并且MoS2存在带隙,能更好地提高检测灵敏度。CHANDAN等[61]描述了一种有效的微流控芯片,用于检测鼠伤寒沙门氏菌,检测限1.56 CFU/mL,检测范围10~107CFU/mL。他们使用MoS2纳米片作为换能器材料,通过静电作用在ITO电极表面成膜,捕捉到目标细菌从而改变阻抗信号。
总之,在纳米二维材料的帮助下,阻抗生物传感器的传统优势,如快速性和现场适用性可进一步提高。此外,纳米材料与微流控芯片同属微型技术,赋予电化学生物传感器装置小型化、高灵敏度和特异性,使其具有评估现场食品安全性的巨大潜力。但是纳米二维材料量产技术不成熟且成本较高,是应用到微流控阻抗传感器制造中所需要面对的问题。
3 总结与展望
在微流控阻抗领域,人们发现了现场快速检测食源性病原菌的巨大潜力。研究人员致力于探索更佳的生物识别配体、开发改善阻抗信号水平和捕获细菌能力的检测技术,亟待于提升检测灵敏度和适于快捷经济的现场应用。对微流控阻抗传感器检测食源性病原菌得出以下总结和展望。
1)微流控技术和阻抗免疫传感器的结合将病原菌样品从进样、混合、检测到测量的整个过程都集中在微流控芯片上,减少检测时间、节约检测成本、提高分析效率,实现检测设备的微型化、自动化。基于IDAM检测技术可同时发挥IDAM灵敏度高、阻抗测量快速的优势,但需要解决IDAM可重复检测次数少的问题;DEP技术可在低通量下实现病原菌高效分离和捕获,从而提高检测灵敏度,但高通量下病原菌捕获率有待提高;纳米技术和多种技术联用可将食源性病菌检测限下降至个位数,但是仍存在缺陷:如纳米粒子过于密集会影响结果、纳米孔膜制作成功率低、纳米二维材料量产技术不成熟且成本高等,这些缺陷在一定程度上限制了微流控阻抗传感器的现场应用。
2)目前,微流控阻抗传感器的构建仍处于不断探索的阶段中,往后的研究中需要不断借鉴基于光学和其他电化学的方法技术,更需要依靠适用于阻抗检测的最新纳米材料和技术的发展,使之可用于现场实时快速检测食源性病原菌。此外,为了满足微流控设备对病原菌检测的低价格要求,今后的研究可从高度复杂的制造技术转向可满足最终用户要求的聚合物或纸质设备,例如聚合物和纸基芯片代替硅基和玻璃;丝网印刷电极或者半导体纳米材料代替金属电极。
