基于靶向二代测序技术检测肝细胞癌线粒体DNA突变
2019-02-12刘洋郭姗姗刘曼玲李艺杰贾永峰郭旭
刘洋 郭姗姗刘曼玲 李艺杰 贾永峰 郭旭
线粒体是几乎存在于所有真核细胞中的重要细胞器,每个细胞都包含多个拷贝的线粒体基因组。有研究报道线粒体DNA(mitochondrial DNA,mtDNA)突变引起的线粒体功能障碍与肿瘤发展和转移关系密切[1-2]。对肝癌患者全外显子测序(whole exosome sequencing,WES)数据中的mtDNA测序数据进行分析,发现了92个体细胞突变[3]。因线粒体占据了肝细胞胞质体积的20%[4],且在肝代谢中起重要作用,因此推测肝细胞癌(hepatocellular carcinoma,HCC)的发生可能与mtDNA突变密切相关。目前传统测序技术已被广泛用于检测癌症的体细胞mtDNA突变[5-10],但操作复杂,检测灵敏度低,临床应用受限。本研究利用全基因组测序(whole genome sequencing,WGS)技术检测mtDNA拷贝数,并基于靶向二代测序(next generation sequencing,NGS)技术,在匹配的 HCC 癌组织、癌旁组织、外周血细胞与血浆样本中进行了深覆盖度的mtDNA测序并分析mtDNA突变的一致性与差异性,以进一步阐明血浆中mtDNA的突变情况,以及可能在HCC早期诊断、预后评估中的作用。
1 材料与方法
1.1 标本来源
收集2017年9月23日至2017年12月18日在空军军医大学第一附属医院经病理确诊的HCC患者癌组织及癌旁组织(距癌组织≤3 cm)、外周血细胞及血浆样本,其中癌组织及癌旁组织为多点取材。样本筛选标准:癌组织中肿瘤细胞比例>90%且没有坏死,癌旁组织中肿瘤细胞比例<5%;所有样本提取的DNA均于-20℃下保存。本研究最终共纳入5例HCC患者,所有病例术前未经放疗、化疗。5例HCC患者的临床特征见表1。
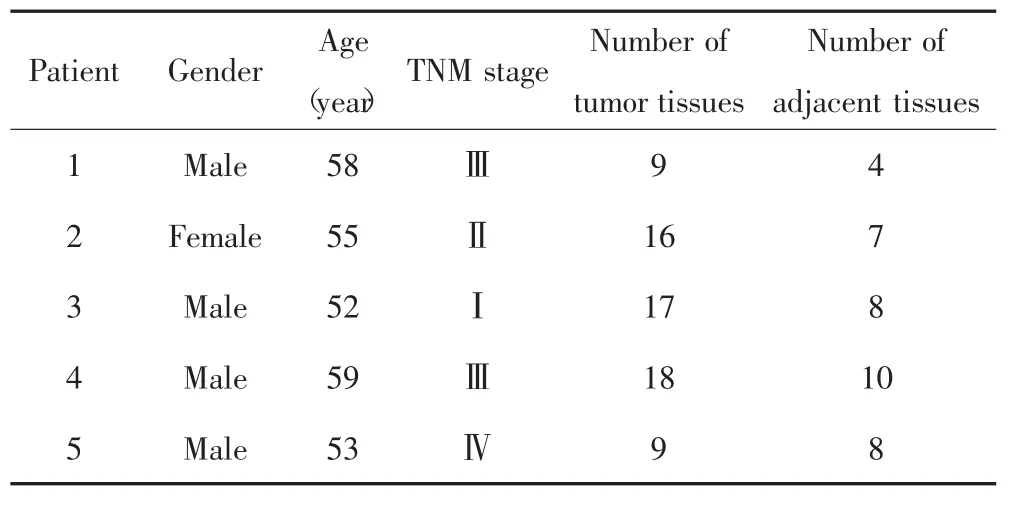
表1 5例肝细胞癌患者的临床病理特征Tab.1 Clinicopathological characteristics of five HCC patients
1.2 主要试剂与仪器
E.N.Z.A组织DNA提取试剂盒和E.N.Z.A血液DNA 提取试剂盒购自 Omega(New York,USA),QIAamp Circulating Nucleic Acid Kit购自 Qiagen(Dusseldorf,Germany),NEB Ultra v2 Kit购自 New England Biolabs(Ipswich,US),Dynabeads 购 自 Life(Massachusetts,USA)。Illumina HiSeq×Ten,Qubit 3.0 荧光定量仪和Nonodrop分光光度计购自Thermo Fisher Scientific(Massachusetts,USA),Agilent 2100 bioanalyzer system购自Agilent(California,USA)。
1.3 DNA的提取和定量
按照E.N.Z.A组织和血液DNA提取试剂盒说明书分别提取HCC患者癌组织、癌旁组织和相应外周血细胞中的DNA,并用Nonodrop分光光度计检测DNA的浓度和质量。采用QIAamp Circulating Nucleic Acid Kit提取HCC患者血浆中的游离DNA(cell free,cfDNA),并用Qubit 3.0荧光定量仪检测cfDNA的浓度和质量。
1.4 DNA测序文库构建
从HCC癌组织、癌旁组织及外周血细胞样本中分别取5 μg DNA,按照超声打断、末端修复、加A尾、接头连接、扩增顺序进行文库构建;同时取1 μg血浆cfDNA,根据NEB Ultra v2 Kit试剂盒说明书进行文库构建。将构建的全基因组文库置于Illumina HiSeq×Ten平台进行双端150 bp测序。
1.5 靶向捕获测序
将自制生物素标记的mtDNA探针[11]与DNA文库进行杂交。根据链霉亲和素磁珠与生物素特异性结合的原理,用mtDNA探针结合目标片段,经磁珠纯化后获得特异性产物。将捕获的特异性产物置于Illumina HiSeq×Ten平台进行双端150 bp测序。
1.6 测序数据分析
对测序数据进行质量控制,条件包括:⑴去除接头污染的Reads;⑵去除低质量的Reads;⑶去除含N碱基比例>5%的Reads。将质控后的数据通过BWA-mem软件比对至人类参考基因组hg19,提取比对至线粒体参考基因组(the revised cambridge reference sequence,rCRS)的数据,计算mtDNA拷贝数和片段分布并进行突变位点分析。mtDNA拷贝数=2×mtDNA depth/nuclear depth。mtDNA异质性突变频率=含突变位点的Reads/总 Reads。异质性突变分析的过滤条件包括:⑴两条链上的次等位基因频率(minor allele frequency,MAF)≥2%;⑵每条链上携带突变的Reads≥3;⑶总测序深度≥100×。将MAF≥98%的突变定义为同质性突变。本研究将癌组织和癌旁组织的多点取材数据分别合并进行突变分析。
1.7 统计学分析
使用Graphpad prism 5.0对数据进行统计分析。采用配对的Wilcoxon秩和检验分析癌组织和血浆样本中拷贝数和突变频率的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 HCC患者癌组织与血浆样本mtDNA拷贝数的比较
全基因组测序结果显示,血浆样本中mtDNA拷贝数平均值为 4.30,中位值为 2.87(1.92~7.84);癌组织中mtDNA拷贝数平均值为868.60,中位值为887.56(517.71~1 086.00)。HCC患者血浆中的mtDNA拷贝数较癌组织明显降低(Z=-2.023,P=0.008),见图 1。
2.2 HCC患者癌组织、癌旁组织、外周血细胞与血浆样本中的突变位点。
对5例HCC患者癌组织、癌旁组织、外周血细胞、血浆样本进行靶向捕获测序,平均测序深度分别为 4 683×、5 447×、4 223×、3 335×,见表 2。靶向捕获测序结果显示,癌组织、癌旁组织、外周血细胞和血浆样本可分别鉴定出181、180、181、179个同质性突变和 33、42、3、78 个异质性突变,见表 3。其中,4 种类型样本可检测到相同的同质性突变位点;癌组织与血浆样本中可检测到相同的异质性突变位点,平均突变个数为4.2;但癌旁组织与血浆样本中检测不到相同的异质性突变位点,见图2。癌组织、癌旁组织、血浆中可分别检测到10、39、56个特异性突变位点。
2.3 HCC患者癌组织与血浆样本中突变频率的比较
根据上述5例HCC患者癌组织及血浆样本的突变结果分析其异质性突变频率,结果显示,癌组织平均异质性突变频率为0.0888,中位值为0.0837(0.0420~0.1563);血浆样本平均异质性突变频率为0.0679,中位值为 0.0596(0.0351~0.1055),两者比较差异无统计学意义(Z=-1.367,P=0.219),见图 3。
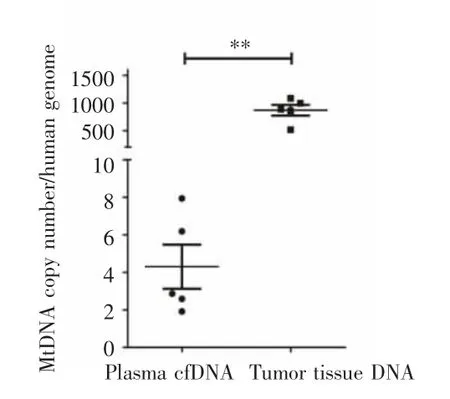
图1 血浆及肿瘤组织中mtDNA拷贝数的比较Fig.1 Comparison of mtDNA copy numbers in plasma and tumor tissues
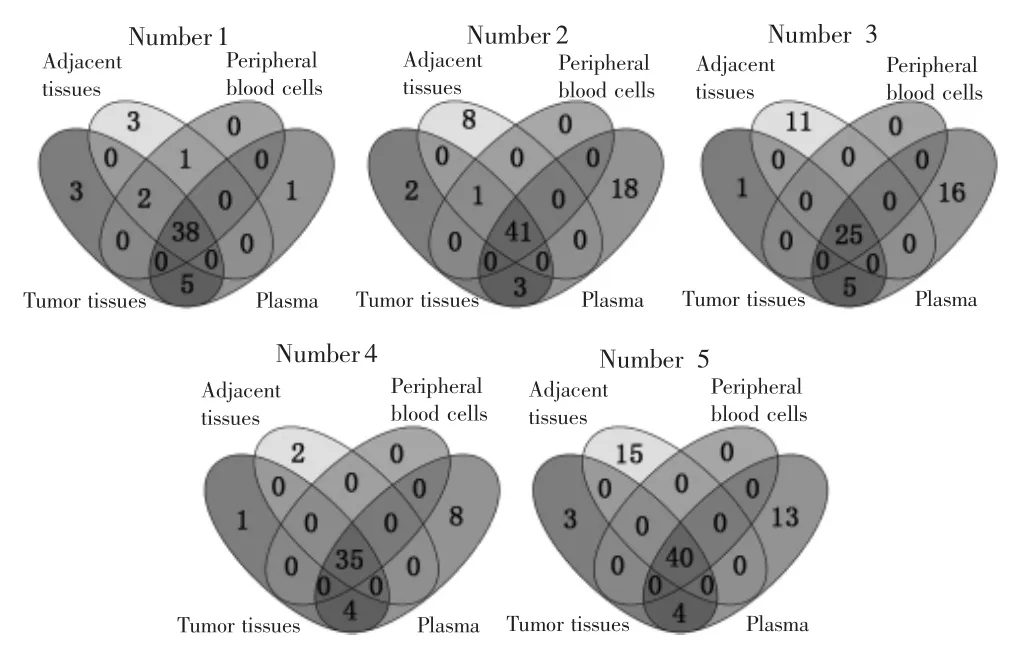
图2 癌组织、癌旁组织、外周血细胞和血浆样本中的突变位点数量Fig.2 The number of mutation sites in tumor tissues,adjacent tissues,peripheral blood cells and plasma
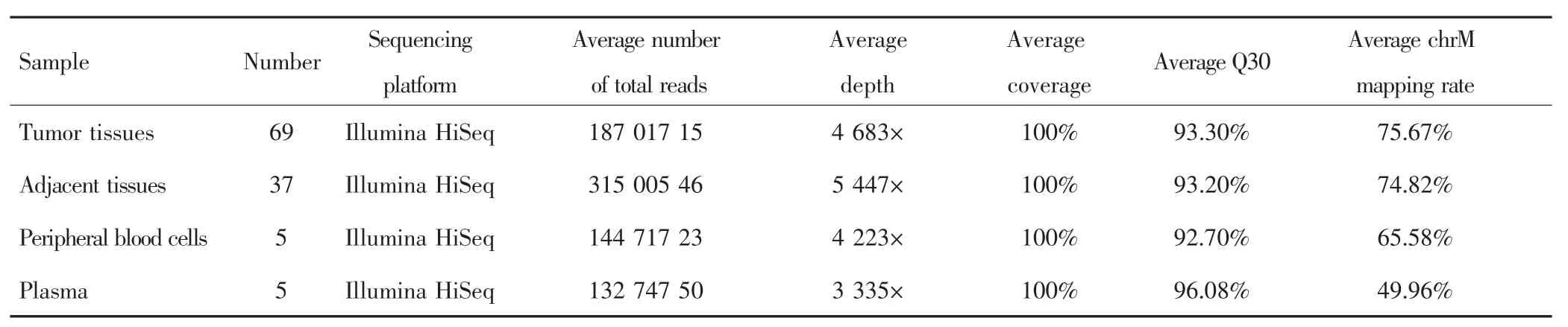
表2 mtDNA测序数据概况Tab.2 Summary of mtDNA sequencing data
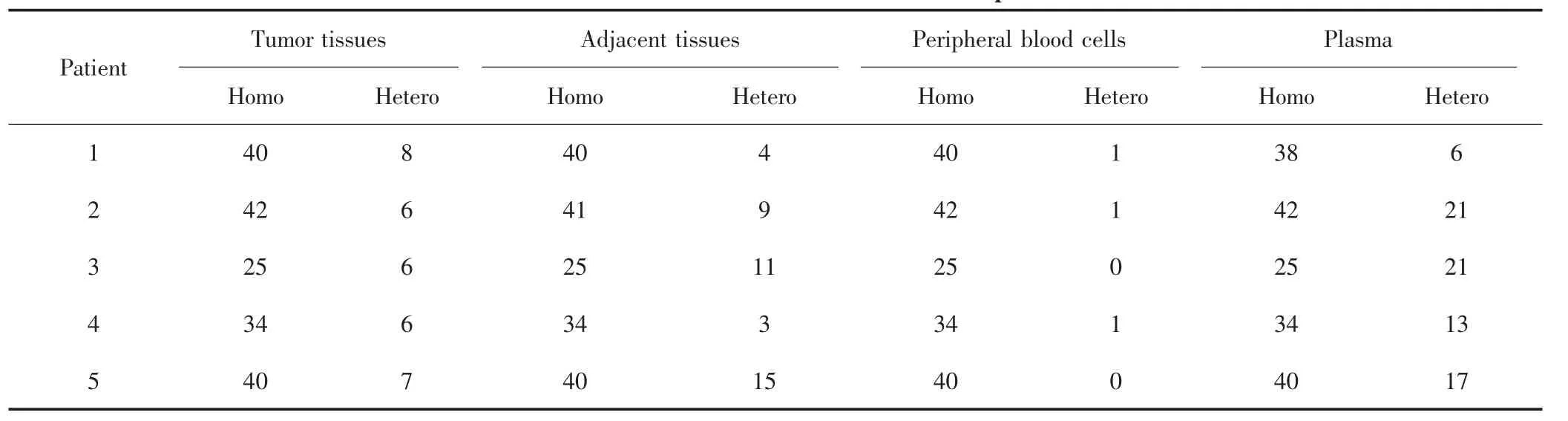
表3 5例肝细胞癌患者的突变位点数量Tab.3 The number of variants for five HCC patients
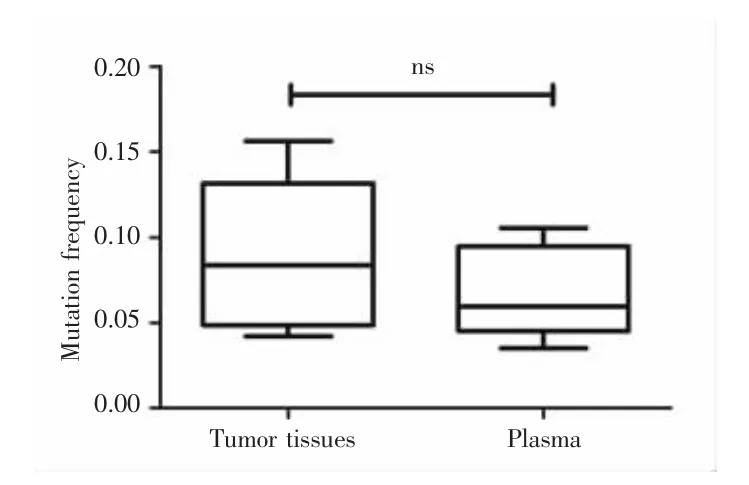
图3 癌组织与血浆样本中的突变频率Fig.3 The mutation frequency between tumor tissues and plasma
3 讨论
mtDNA突变在肿瘤发生发展过程中起重要作用[12]。mtDNA是一段双链闭合环状结构,包括编码区和非编码区。与核DNA相比,检测mtDNA突变及拷贝数变异有以下独特优势[13-14]:⑴线粒体DNA全长仅有16 569 bp,测序产生的数据量小,检测快速、成本低;⑵mtDNA拷贝数高,一个细胞中可含几百至几千个mtDNA的拷贝;⑶肿瘤细胞中mtDNA常存在于高水平活性氧环境下,且缺少组蛋白保护和有效的DNA修复系统,突变频率较核基因组高10倍左右。目前传统测序技术如Sanger测序已被广泛应用于检测癌症的体细胞mtDNA突变[8-10],但操作复杂,检测灵敏度低,临床应用受限。NGS技术为系统检测多种类型癌症中的mtDNA异质性突变提供了便利,已越来越多地应用于mtDNA突变检测中。由于线粒体基因组小,在测序之前,应从包括基因组DNA和mtDNA在内的总细胞DNA中分离mtDNA,以降低测序成本并简化数据分析流程。富集mtDNA包括两种主要策略:一种是首先通过密度梯度离心从细胞中分离线粒体,然后通过DNA提取试剂盒从分离的线粒体中提取DNA,但该方法不适用于血浆样本;另一种是从细胞中提取总DNA,然后通过基于靶向扩增或靶向捕获的方法获得mtDNA。本研究基于靶向NGS技术系统全面分析了HCC患者癌组织、癌旁组织、外周血细胞及血浆中的mtDNA突变。测序结果发现,该方法不仅实现了100%的覆盖度,测序质量Q30高于90%,且mtDNA的富集效率即mtDNA比对率>50%,同时可以准确地检测突变频率低至2%的mtDNA突变。此外,还通过4种配对样本的数据准确识别了与HCC相关的mtDNA突变,说明该方法有效、可行,且能够准确地检测血浆中的低频突变。
目前大多研究集中于检测HCC患者组织样本或外周血细胞中的mtDNA突变[14],鲜见检测cf-mtDNA突变的研究。有研究使用单分子实时(single-molecule real-time,SMRT)测序技术对来自8例癌症患者的19例组织样本和9例血浆样本的mtDNA进行了突变分析,结果在血浆中几乎检测不到肿瘤特异性mtDNA突变[15]。本研究在血浆中检测到了较癌组织中明显增多的mtDNA突变,说明血浆样本能够克服肿瘤组织异质性。此外,在血浆中观察到的mtDNA突变频率与癌组织中的mtDNA突变频率无明显差异,提示血浆样本很大程度上可反映肿瘤细胞中的mtDNA突变特征,可代替癌组织样本进行mtDNA突变分析。在HCC患者癌组织与血浆样本中还观察到mtDNA拷贝数存在显著性差异,为后续的实验及数据分析提供了重要的理论依据。值得注意的是,在实验和数据分析过程中,要根据不同的样本类型设置不同参数,例如探针的使用量、探针的长度、扩增次数,数据质控条件等。
综上所述,本研究使用基于靶向NGS技术在HCC患者血浆中检测到肿瘤来源的mtDNA突变,同时还准确地检测出血浆样本中的低频突变;血浆中的mtDNA有望成为HCC的潜在诊断或预后评估生物标志物,可作为组织活检的有力补充。但本研究样本量较小且未分析血浆中mtDNA突变与HCC生存的关系。因此,该法的临床实用性有待在大型HCC患者队列中进一步评估。
