Box-Behnken响应面法优化野菊花多糖的提取工艺及其抗氧化活性研究△
2019-02-10梁艳妮李欢欢唐志书张东博雷莉妍王征
梁艳妮,李欢欢,唐志书,张东博,雷莉妍,王征
陕西中医药大学 陕西省中药资源产业化协同创新中心/陕西省中药基础与新药研究重点实验室,陕西 咸阳 712083
野菊花为菊科植物野菊GhrysanthemumindicumL.的干燥头状花序,清热解毒、泻火平肝,临床用于疔疮痈肿、目赤肿痛、头痛眩晕[1]。野菊花含萜类成分较多,主要存在于挥发油中;黄酮类化合物是其重要的药效成分[2-3],具有广谱抗菌、抗病毒、降压、增加冠脉血流量、抑制血小板聚集、抗炎、抗氧化等作用[4]。中药多糖具有抗氧化、抗肿瘤、促进免疫等药理活性[4-5]。目前国内对野菊花、野菊茎叶多糖的提取分离纯化工艺[6-9]、含量测定[10]、脱色工艺、结构鉴定及活性[11]均有研究。李厚兵等[8]优化了野菊花多糖的大孔吸附树脂纯化工艺,陆颖等[9]采用大孔吸附树脂LSA-21脱色处理,再经DEAE-52 纤维素柱和Sephadex G75 凝胶色谱分离纯化得3个均一野菊花多糖。膜分离技术以选择性透过膜为分离介质,以电位差、浓度差或压差为推动力,从而实现对特定组分的分离、提纯和浓缩。膜分离技术以其高效、节能、无二次污染、低成本、高选择性等优点被广泛应用于各个领域,可用于中药提取液的除杂、分离纯化、浓缩等方面[12-15]。目前已经应用膜分离技术对枸杞多糖[16]、六味地黄糖类[17]、沙枣多糖[18]、马尾藻多糖[19]等多糖类成分进行了分离纯化,效果良好。与均匀设计与正交设计相比,Box-Behnken响应面法采用多元二次回归方程拟合各因素与响应值之间的函数关系,具有试验次数少,精度高,预测性好的优点[20-22]。本文采用水提醇沉法,选取料液比、提取时间及提取温度3个因素,在单因素试验基础上,采用Box-Behnken Design(BBD)优化野菊花多糖的提取工艺,采用膜分离纯化后评价野菊花多糖的体外抗氧化活性,为野菊花多糖开发利用提供参考。
1 材料
1.1仪器
HH-2恒温水浴锅(北京科伟永兴仪器有限公司);KQ-300DE数控超声波清洗仪(昆山市超声仪器有限公司);GB204 电子天平(梅特勒-托利多仪器有限公司);FA2004B万分之一电子天平(上海佑科仪器仪表有限公司);VaCo5低温冷冻干燥仪(智拓科技控股有限公司);FE-1000AD固体粉碎机(天津鑫博得仪器有限公司);UV-2600紫外分光光度计(日本岛津制作所);LNG-CM-101膜分离设备(上海朗级膜分离设备工程有限公司)。
1.2 试药
无水D-葡萄糖对照品(批号:110833-201205,纯度:95%~98%),购自中国食品药品检定研究院;所用试剂均为分析纯。
野菊花(批号:110801,产地陕西)为菊科植物野菊GhrysanthemumindicumL.的干燥头状花序,购自陕西兴盛德药业,由陕西中医药大学王继涛高级实验师鉴定。
2 方法与结果
2.1 多糖的测定
参照邓寒霜等[20]的多糖含量测定方法,采用苯酚-硫酸法测定野菊花中多糖的含量。精密称取无水葡萄糖对照品适量于100 mL容量瓶中,加蒸馏水定容制得200 μg mL-1的葡萄糖对照品溶液。依次精密量取此对照品溶液1、2、3、4、5、6 mL于10 mL容量瓶中,加水定容。分别精密量取各质量浓度对照品溶液0.6 mL,加入5%苯酚溶液1.2 mL,并迅速加入4 mL浓硫酸,摇匀后置于沸水浴中保温30 min,取出后冷却至室温,以蒸馏水为空白对照,测定490 nm处吸光度。以多糖浓度为横坐标(X),吸光度值为纵坐标(Y)制作标准曲线,得线性方程Y=6.43X+0.035 7(r=0.998 7),线性范围为20~120 μg mL-1。
2.2 多糖的提取
2.2.1 工艺流程 将野菊花干品粉碎成粗粉,用10倍体积石油醚回流脱脂3次,每次1.5 h,常温干燥。称取10 g脱脂野菊花置于圆底烧瓶中,按一定料液比,浸提温度和浸提时间热水提取2次,冷却滤过,合并上清并浓缩后加入4倍量80%乙醇静置过夜,所得沉淀依次用无水乙醇、丙酮洗涤后加适量蒸馏水复溶,冷冻干燥得野菊花多糖。
2.2.2 多糖提取率的计算 将水提醇沉得到的多糖冷冻干燥,精确称取样品多糖 10 mg,定容至100 mL,摇匀,即得样品供试液;精确吸取供试液 1 mL置于10 mL试管中,根据2.1项下操作于490 nm 处测定 A 值,通过回归方程计算样品中多糖浓度。按式(1)计算多糖提取率。
提取率=[(多糖浓度×样品体积×定容体积)]/原料干质量×100%
(1)
2.3 单因素试验
参照2.2.1项工艺流程,每次称取10 g脱脂野菊花干燥粉末,进行单因素试验,分别考察料液比(1∶16、1∶20、1∶24、1∶28、1∶32 g mL-1)、提取时间(1.0、1.5、2.0、2.5、3.0 h)和提取温度(60、70、80、90、100 ℃)对野菊花多糖提取率的影响。
2.3.1 料液比对野菊花多糖提取率的影响 在固定提取温度90 ℃,提取时间3.0 h时,考察不同料液比1∶16、1∶20、1∶24、1∶28、1∶32 g mL-1对野菊花多糖提取率的影响,结果见图1。从图1可以看出,野菊花多糖提取率呈先升高后降低的趋势,当料液比为1∶24时,野菊花多糖提取率最大,此时野菊花多糖提取率为2.91%,在溶剂量较小时多糖溶解不完全,而在溶剂量较大时会导致其他杂质的溶解。因此将料液比为1∶20、1∶24、1∶28 g mL-1作为响应面优化试验的水平。
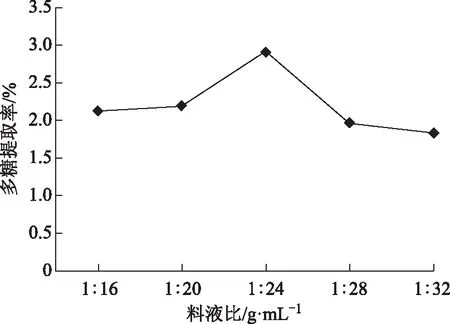
图1 料液比对多糖提取率的影响
2.3.2 提取时间对野菊花多糖提取率的影响 在固定提取温度90 ℃,料液比1∶24 g mL-1时,分别考察提取1.0、1.5、2.0、2.5、3.0 h对野菊花多糖提取率的影响(见图2)。图2中野菊花多糖提取率呈先升高后降低的趋势,当提取时间为2.5 h时,野菊花多糖提取率最大,此时野菊花多糖提取率为3.01%,提取时间较短时多糖溶解可能不完全,而在提取时间较长时多糖的结构被破坏。因此提取时间为2.0、2.5、3.0 h作为响应面优化试验的水平。
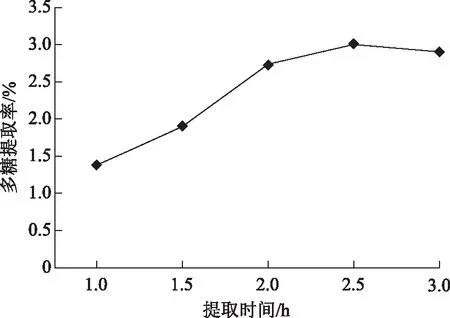
图2 提取时间对多糖提取率的影响
2.3.3 提取温度对野菊花多糖提取率的影响 在固定料液比1∶24 g mL-1,提取时间2.5 h时,分别考察60、70、80、90、100 ℃对野菊花多糖得率的影响(见图3)。图3中野菊花多糖提取率呈先升高后降低的趋势,当提取温度为90 ℃时,野菊花多糖提取率最大,此时野菊花多糖提取率为3.01%,在提取温度的过低时可能导致多糖溶解不完全,而在提取温度较高时导致多糖的结构被破坏和部分多糖被水解。因此提取温度为80、90、100 ℃作为响应面优化试验的水平。
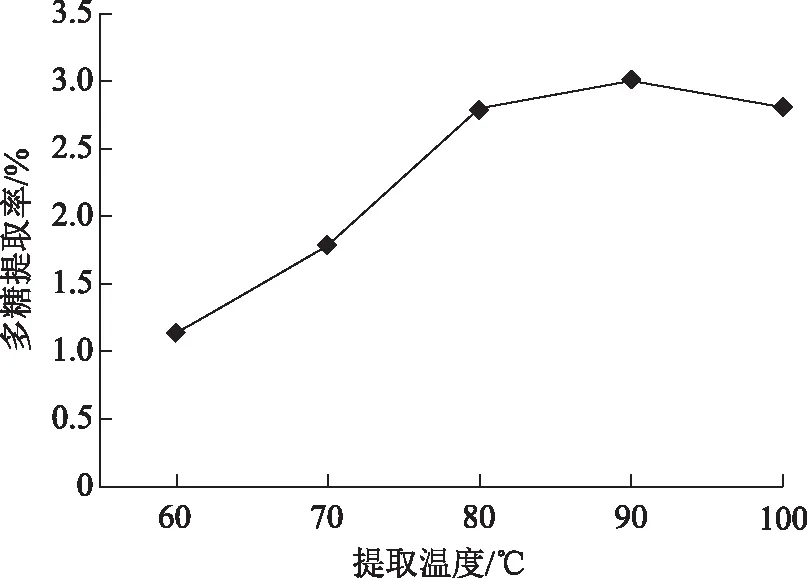
图3 提取温度对多糖提取率的影响
2.4 响应面优化试验
2.4.1 Box-Behnken设计与分析 根据单因素试验结果分别以料液比(A)、提取时间(B)、提取温度(C)为自变量,以多糖提取率为响应值,利用Design-Expert.V8.0.6中Box-Behnken模型设计试验组作响应面分析。Box-Behnken试验设计因素水平表见表1,试验设计与结果见表2,方差分析见表3。
通过Design-Expert.V8.0.6得到3个因素:料液比、提取温度和提取时间对野菊花多糖得率影响的二次多项回归方程为Y=3.22+0.12A+0.064B+0.31C-0.21AB-0.40AC+0.074BC-0.29A2-0.79B2-0.68C2。表3中该回归模型P=0.003 8<0.01差异有统计学意义,失拟项P=0.906 1>0.05,差异无统计学意义,表明该模型拟合度好,试验误差小,能够准确反映3个因素对野菊花多糖提取率的影响。表3中一次项C和交互项AC的P<0.05,表明提取温度和料液比的交互作用对多糖得率的影响差异有统计学意义;二次项B2和C2的P<0.01,表明提取温度和提取时间的平方项对多糖得率的影响差异有统计学意义。比较各项F值可知各因素对响应值的影响大小为C>A>B,即提取温度>料液比>提取时间。
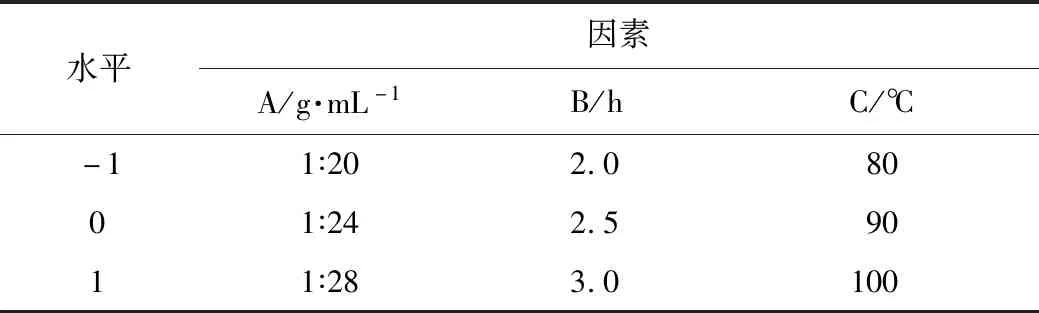
表1 Box-Behnken试验设计因素水平表
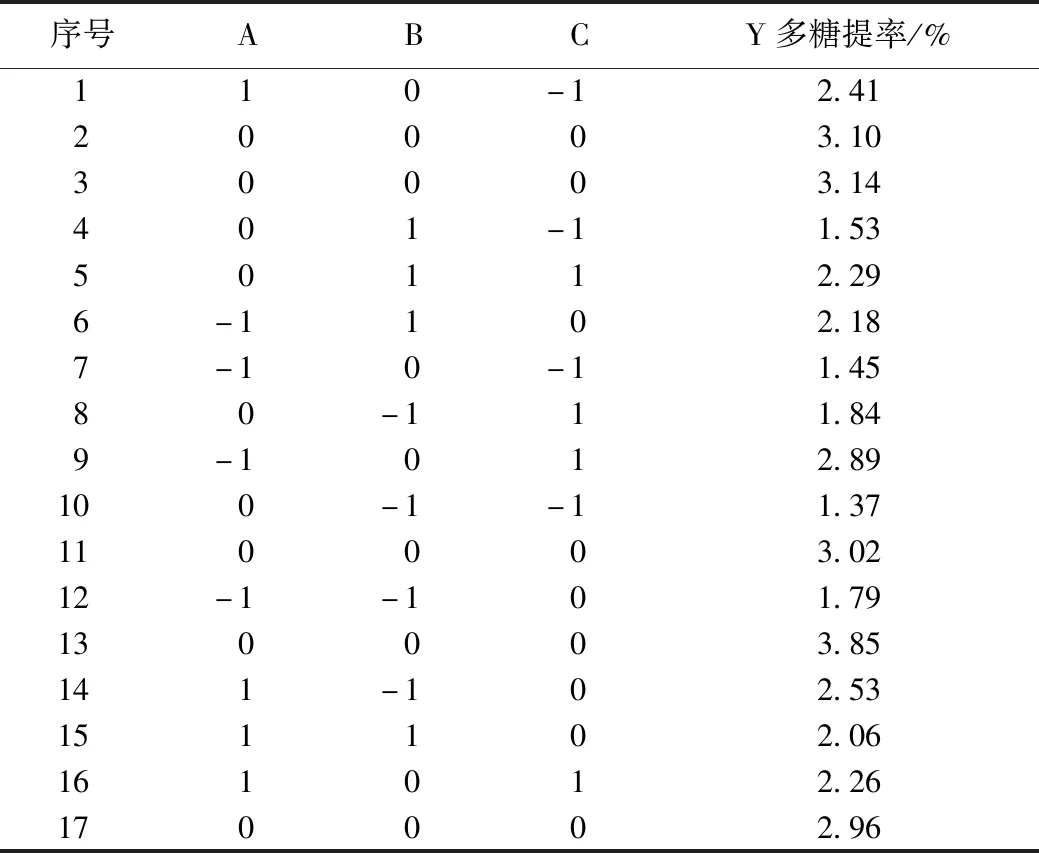
表2 Box-Behnken试验设计与结果
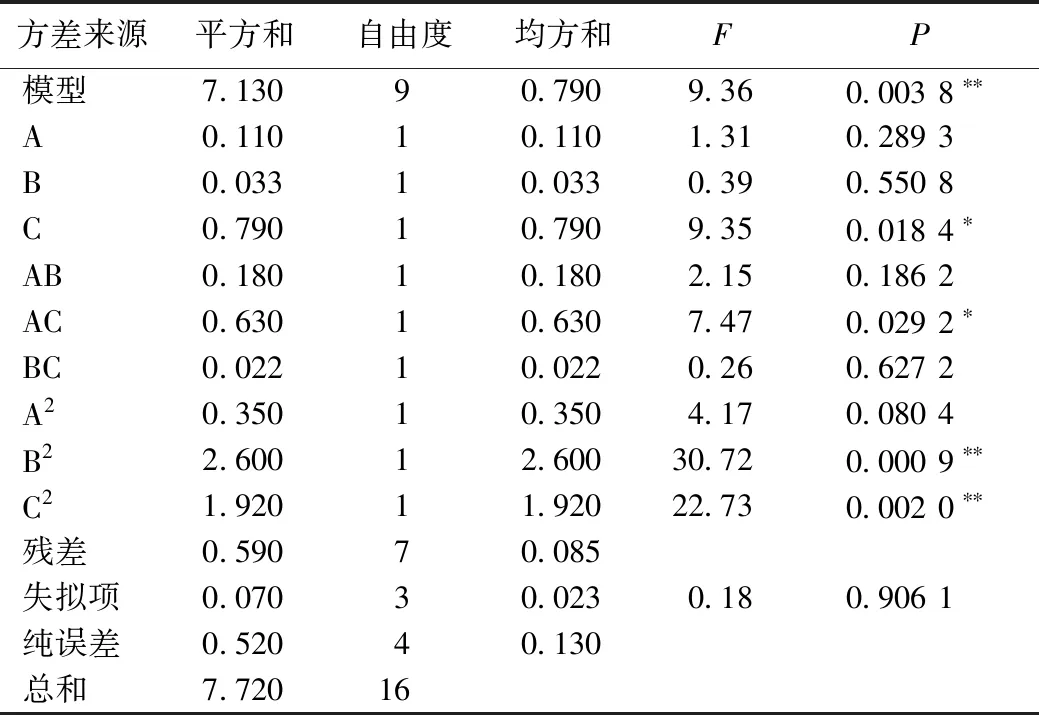
表3 响应面回归模型方差分析
注:**P<0.01;*P<0.05。
2.4.2 响应面图分析与优化 通过多元回归方程作三维效应曲面图和二维平面等高线图,从图4~6可以直观分析3个因素之间的交互作用以及对多糖提取率的影响。由等高线可知,AB、AC交互作用显著(等高线椭圆状),BC交互作用不显著(等高线圆形)。由响应面可看出,提取温度对多糖的提取率的影响显著,响应面陡峭;而料液比与提取时间对多糖的提取率的影响不显著,响应面较平缓。
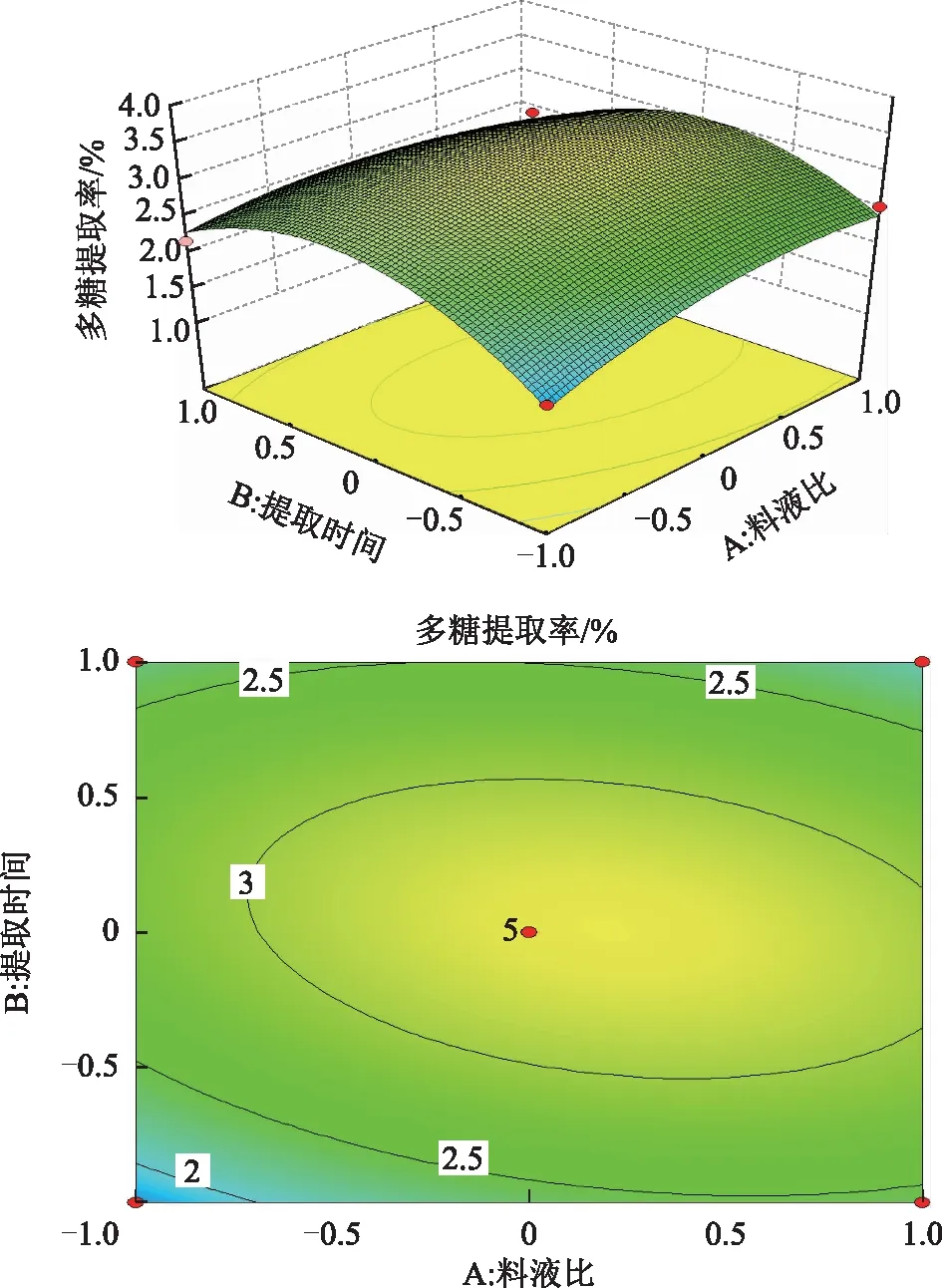
图4 料液比与提取时间对野菊花多糖提取率的交互影响
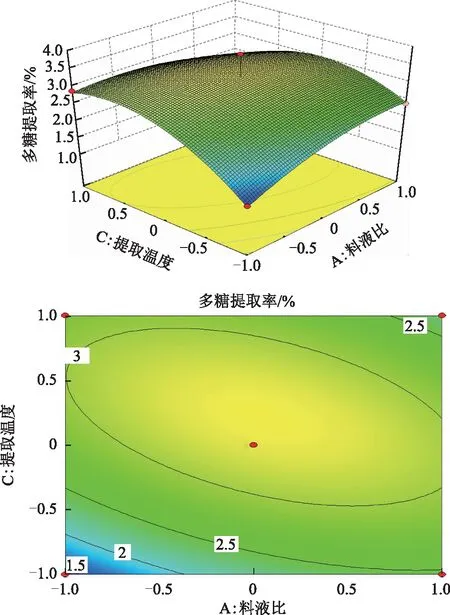
图5 料液比与提取温度对野菊花多糖提取率的交互影响
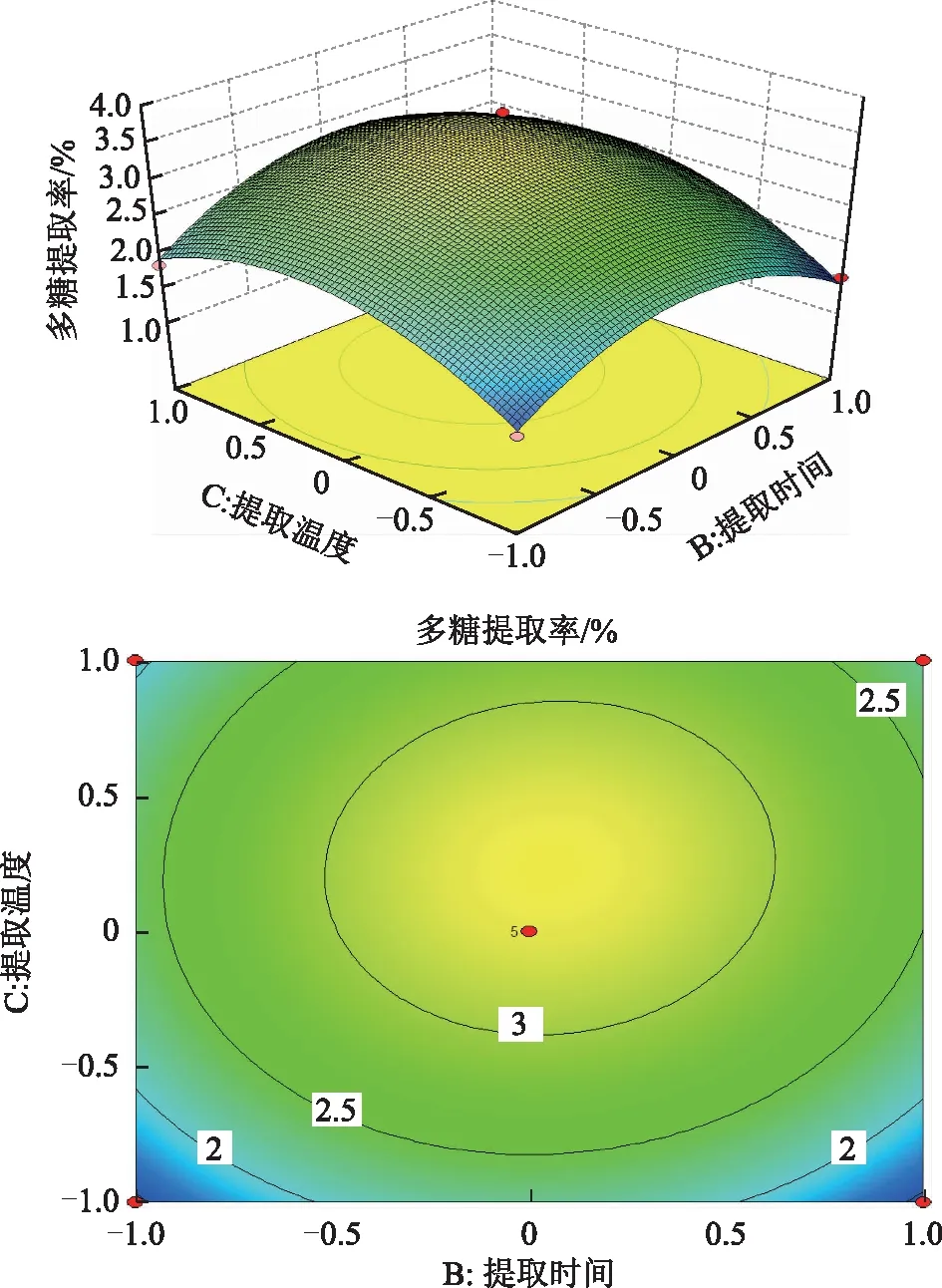
图6 提取时间与提取温度对野菊花多糖提取率的交互影响
2.4.3 验证实验 根据响应面分析优选得到水提醇沉野菊花多糖的最佳工艺:料液比为1∶25 g mL-1,92.3 ℃下提取2.5 h,野菊花多糖的理论提取率为3.25%。验证上述工艺条件得到野菊花多糖提取率为(3.18±0.07)%,n=3,表明本文优化得到的野菊花多糖最佳提取条件稳定,工艺可靠。
2.5 野菊花多糖的分离纯化
2.5.1 Sevage法脱蛋白试验 取1 g多糖粗粉,溶解成100 mL多糖溶液,在多糖溶液中加入三氯甲烷20 mL,然后加入正丁醇4 mL,置于水浴恒温振荡器,37 ℃,240 r min-1剧烈振摇20 min,离心,取上清液。醇沉,抽滤,冷冻干燥得野菊花多糖。
采用考马斯亮蓝G-250法测定蛋白质含量:精密称取牛血清蛋白10 mg,用水定容至10 mL容量瓶中,即为对照品溶液。精密移取0、0.1、0.2、0.3、0.4、0.5、0.6、0.8 mL的蛋白质对照品溶液于8只试管中,加水补至1 mL,摇匀。然后各取0.1 mL溶液于10 mL容量瓶中,再分别加入5 mL考马斯亮蓝显色液,摇匀,放置2 min,测定595 nm下吸光度。以浓度为横坐标(X),吸光度为纵坐标(Y)拟合得到线性方程:Y=0.004 6X+0.005 6(r=0.999 5),线性范围为10~80 μg mL-1。取0.5 mL的多糖稀释液,同法显色后测吸光度值A,代入线性方程计算脱蛋白前后多糖中的蛋白质量浓度,按公式(2)计算蛋白质脱除率,公式(3)计算多糖保留率:Sevage法蛋白质脱除率为23.58%,多糖保留率为63.97%,多糖损失较小。
蛋白质去除率=(c1-c2)/c1×100%
(2)
式中c1、c2分别为脱蛋白前后蛋白质的质量浓度,c1=71.7 μg mL-1,c2= 54.8 μg mL-1。
多糖保留率=mj/mi×100%
(3)
式中mi、mj分别为脱蛋白前后多糖的质量浓度,mj=639.7 mg mL-1,mi=10 mg mL-1。
2.5.2 过氧化氢法脱色素试验 取1 g多糖粗粉,溶解成100 mL多糖溶液,加入30%H2O2溶液10 mL,10%NaOH溶液调节pH值至7.0后,55 ℃水浴不断搅拌1 h,加热除去H2O2,冷却至室温,醇沉,抽滤,冷冻干燥得野菊花多糖。通过公式(4)计算多糖脱色率,公式(5)计算多糖保留率。
脱色率=(Ai- Aj)/Ai×100%
(4)
式中Ai、Aj分别为脱色前后的吸光度,Ai= 0.778,Aj= 0.302。
多糖保留率=mj/mi×100%
(5)
式中mi、mj分别为脱色前后多糖的质量浓度,mj=296.5 mg mL-1,mi=10 mg mL-1。
比较脱色前后吸光度得过氧化氢法脱色率为61.18%,多糖保留率为29.65%。过氧化氢法脱色素效果明显,但多糖损失较多。
2.5.3 膜分离纯化试验 将野菊花粗多糖配制成10 mg mL-1的多糖水溶液,压力恒定,分别过0.8、0.2 μm陶瓷膜得截留液和渗透液,测试膜分离所得截留液和渗透液的多糖含量及多糖纯度。当膜孔径由0.8 μm变为0.2 μm时,野菊花多糖损失率至少为70%,按公式(6)计算;野菊花多糖溶液的颜色由黄褐色变成浅黄色;渗透液颜色浅于截留液颜色,且截留液野菊花多糖含量比渗透液多糖含糖量高;0.8 μm渗透液中野菊花多糖回收率与纯度均高于0.2 μm渗透液,表明野菊花中多糖分子直径多大于0.2 μm。
多糖损失率=(mi-mj)/mi×100%
(6)
式中mi、mj分别为过膜前后多糖的质量浓度,mi=10 mg mL-1,mj(0.8 μm)=6.32 mg mL-1,mj(0.2 μm)=2.19 mg mL-1。
2.6 抗氧化活性测定
将0.8 μm陶瓷膜纯化后的野菊花多糖作抗氧化活性测定。
2.6.1 DPPH 清除活性 按照陈智坤等[23]清除DPPH 的方法,向6支试管中分别加入 2 mL 6 mmol L-1的 DPPH 乙醇溶液和2 mL质量浓度分别为1、2、4、6、8、10 mg mL-1的野菊花多糖溶液,充分混合,室温避光反应 30 min后在 517 nm 测吸光度Ax;将多糖溶液换以等体积的无水乙醇同上测定吸光度A0;将DPPH 乙醇溶液换以等体积的无水乙醇,加入不同浓度的野菊花多糖溶液,同上测定吸光度Ay。以上测定均作3组重复样取平均值,清除率按计算公式(7)计算。
清除率=[1-(Ax-Ay)/A0]×100%
(7)
从图7可看出野菊花多糖对DPPH 的清除率随着浓度增大而增强,在1~10 mg mL-1有量效关系,多糖浓度为10 mg mL-1时清除率达90.15%。
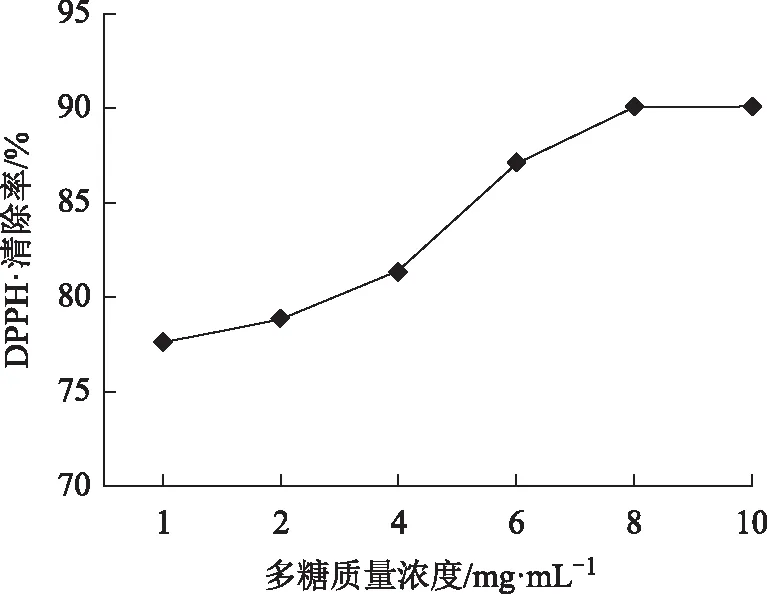
图7 不同浓度野菊花多糖对DPPH· 的清除作用
2.6.2 · OH清除活性 以水杨酸法测定对 · OH[14]的清除能力,在试管中分别依次加入 6 mmol L-1FeSO4溶液2 mL,质量浓度分别为1、2、4、6、8、10 mg mL-1的野菊花多糖溶液2 mL,6 mmol L-1H2O2溶液2 mL,混匀反应10 min,分别加入6 mmol L-1水杨酸溶液2 mL,混匀37 ℃反应20 min后测定510 nm下吸光度Ax;将水杨酸乙醇溶液换以水测定吸光度 Ay,将多糖溶液换以水测定吸光度A0,以上样品均重复3次取平均值,清除率计算公式为:
· OH清除率=[1-(Ax-Ay)/A0]×100%
(8)
从图8可看出野菊花多糖对 · OH的清除率随着浓度增大而增强,在1~10 mg mL-1有量效关系,多糖质量浓度为10 mg mL-1时清除率达78.26%。
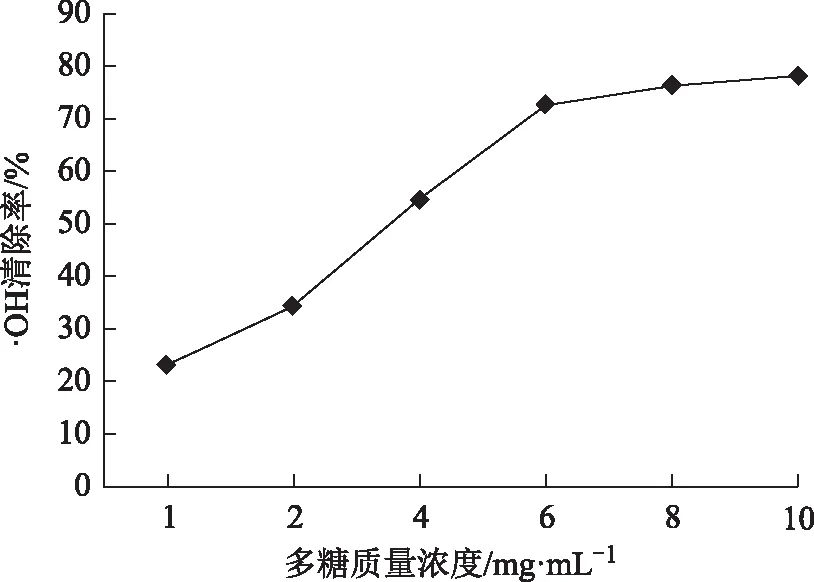
图8 不同浓度野菊花多糖对· OH的清除作用
3 讨论
响应面法通过合理的试验设计进行有限次试验,利用所得结果采用多元二次回归方程拟合多因素与响应值的函数关系,可以快速确定最优工艺参数[24-25]。本文首先通过单因素试验确定因素水平,采用Box-Behnken法设计试验优化野菊花多糖的水提醇沉前处理条件,建立的二次回归方程拟合度好,能够合理反映水提取料液比、提取温度和时间对野菊花多糖得率的影响。利用此模型得到的野菊花多糖的最佳提取工艺为料液比1∶25 g mL-1,92.3 ℃提取2.5 h,多糖提取率为3.25%。由验证实验可知,理论预测值与试验值接近,结果可靠。黄家利等[26]采用正交设计法优化得到的最佳工艺条件为提取温度90 ℃,料液比1∶20 g mL-1,提取时间4 h,多糖得率为3.32%。本文所得最佳工艺更经济,效应面法三维图使多因素对考察指标的影响更为直观。
对野菊花粗多糖的纯化处理表明:Sevage 法脱蛋白的脱除率为23.58%,过氧化氢法除色素的脱色率为61.18%,0.8 μm陶瓷膜对多糖除杂效果明显。膜分离纯化后的野菊花多糖对DPPH 和 · OH的清除具有浓度依赖性,多糖质量浓度在10 mg mL-1时对DPPH 的清除率可达90%,对 · OH的清除率可达78%,野菊花多糖的强抗氧化性为其进一步的开发提供了理论依据。
