液态食品中聚阳离子对外源DNA 稳定性的影响
2019-02-06王春婷梁兴国
安 然,王春婷,董 平,李 敬,梁兴国
(中国海洋大学 食品科学与工程学院,山东 青岛 266003)
近年来,由于食品市场的全球化发展及食品安全事件的频发,建立并完善食品产业的溯源体系成为确保食品安全的一个重要措施。由于标签或外包装防伪技术存在易损坏脱落或被伪造等缺陷[1-2],DNA 指纹[3-5]和DNA 条形码[6]等生物技术逐渐被用于食品原料的种质鉴定及产地溯源。然而这些方法对于白酒、橄榄油等自身DNA 含量极低或DNA 被严重破坏的深加工食品,提取其自身DNA 并进行鉴定也较为困难。因此,通过在食品中加入外源DNA 作为溯源内标物的新型技术逐渐受到重视[7-8]。
虽然相比于其他生物大分子,DNA 的理化性质较为稳定,但由于食品中存在多种核酸破坏因子(如核酸酶、自由基和酸等),DNA 在其中经长时间贮藏后会发生脱嘌呤、氧化或断裂等损伤,造成序列信息的丢失,最终导致检测的假阴性,这大大限制了其作为溯源标记物在食品中的应用。因此,目前亟需一种提高DNA 稳定性的方法来实现其在食品中的长期稳定存在。
众所周知,核酸具有聚阴离子的特性,其磷酸基上的负电荷可通过静电相互作用与聚阳离子化合物携带的正电荷结合,从而达到提高核酸稳定性的目的[8]。在细胞中,DNA 正是通过缠绕在带有多个正电荷的组蛋白上来提高DNA 稳定性。目前已有研究表明,碱性多肽和精胺、亚精胺和腐胺等多胺类聚阳离子化合物可降低由辐射产生的DNA 断裂损伤[9-11];壳聚糖-DNA 纳米粒子可抵抗DNase I[12-14]、DNase II[15]和Exonulease III[16]等核酸酶的降解;壳聚糖[17-19]和多胺类物质[20]还可提高核酸对氧化和辐射的耐受性。此外,根据脱嘌呤的质子化机理[21],聚阳离子可通过中和磷酸基上的负电荷来抑制核酸在酸性条件下的脱嘌呤反应。而且,由于具有聚阳离子性质的壳聚糖是一种天然的无毒无害的食品添加剂,很适合作为核酸保护剂应用于食品领域。
因此,本文作者选用了壳聚糖、壳寡糖和精胺3种分子量大小不同的聚阳离子化合物,探究了聚阳离子化合物对液态食品中DNA 的保护作用,并评估了DNA-聚阳离子复合物作为食品溯源标记物的可行性。不仅可为食品中核酸稳定性的提高提供一种新思路,还可扩大DNA 标记物在食品中的应用范围。此外,对于DNA-聚阳离子复合物稳定性的研究也可为壳聚糖-DNA 纳米营养体在液态食品中稳定性的研究提供一定的理论基础。
1 材料与方法
1.1 实验材料
1.1.1 实验所用试剂 pUC18质粒、λDNA、pfu DNA 聚合酶、DNase I 和SYBR Select Master Mix 购自Thermo Scientific 公司;引物订购自苏州金唯智生物科技有限公司,序列见表1;dNTPs(10 mmol/L)和精胺购自Sigma 公司;壳寡糖(分子量:6 500 Da;脱乙酰度:91.1%)购自山东省莱州市海力生物制品有限公司;壳聚糖(分子量:50~100 kDa)购自浙江澳兴生物科技有限公司;其他试剂均为国产分析纯试剂;Piko Real 实时荧光定量PCR 仪购自Thermo Scientific 公司。1.1.2 实验所用液态食品 本实验所使用的液态食品的保质期与pH 值列于表2 中。其中白酒品名为三井小刀,生产单位为河北三井酒业股份有限公司;葡萄酒品名为青岛华东干红葡萄酒,生产单位为青岛华东葡萄酿酒有限公司;牛奶品名为圣牧有机纯牛奶,生产单位为内蒙古圣牧高科奶业有限公司;乳酸菌饮料品名为伊利每益添低糖活性乳酸菌饮料,生产单位为内蒙古伊利实业集团股份有限公司;柠檬汁饮料品名为水溶c100 柠檬味复合果汁饮料,生产单位为农夫山泉(淳安茶园)有限公司;白醋品名为海天9 度纯酿米醋,生产单位为佛山市海天(高明)调味食品有限公司;苏打水品名为崂山苏打水,生产单位为青岛崂山矿泉水有限公司;虫草酒品名为茅台北冬虫夏草酒,生产单位为贵州茅台酒厂(集团)保健酒业有限公司。

表1 本研究中使用的引物序列Table 1 Sequence of primers used in this study
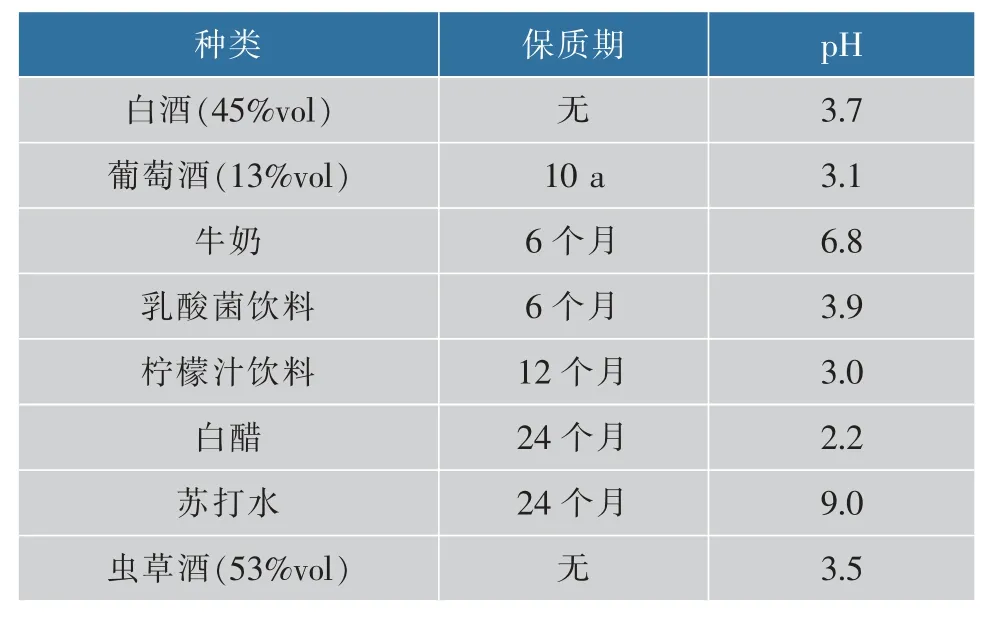
表2 本研究中使用的液态食品Table 2 Liquid foods used in this study
1.2 DNA-聚阳离子复合物的制备
PCR 产物的制备:以pUC18 质粒为模板(1010拷贝/μL),pUC18-364a/s(表1)为引物进行PCR 反应,目的产物长度为364 bp。50 μL PCR 反应体系中含1×pfu Buffer(20 mmol/L Tris-HCl,10 mmol/L(NH4)2SO4,10 mmol/L KCl,0.1 mg/mL BSA,1%(v/v)Triton X-100,2 mmol/L MgSO4,pH 8.8@25 ℃),0.4 μmol/L 引物,0.2 mmol/L dNTPs,2 U pfu DNA 聚合酶。PCR 参数为:72 ℃引物延伸5 min,94 ℃预变性3 min,94 ℃变性30 s,59 ℃退火30 s,72℃延伸90 s,35 个循环后72 ℃保温5 min。将得到的PCR 产物进行纯化并用NanoDrop2000 分光光度计(Thermo Scientific)测定浓度。
将λDNA、pUC18 质粒DNA(pDNA)或PCR 产物分别与壳寡糖、壳聚糖或精胺按照不同的氨基磷酸比混合后,于4 ℃放置12 h,使DNA 与聚阳离子化合物充分作用,通过静电相互作用形成复合物。
1.3 复合物对DNase I 的耐受性实验
将λDNA-壳寡糖复合物或λDNA-精胺复合物加入到含有DNase I 的体系中,20 μL 酶切体系中含600 ng λDNA,0.02 U DNase I 和1×DNase I Buffer(10 mmol/L Tris -HCl,2.5 mM MgCl2,0.1 mmol/L CaCl2,pH 7.5@25 ℃)。37 ℃反应10 min 后,在65 ℃下温浴10 min 将酶灭活。通过琼脂糖凝胶电泳对λDNA 的长度进行检测。
1.4 复合物在液态食品中的长期贮藏
取4 μL pDNA-聚阳离子复合物(氨基磷酸比为10∶1)加入到396 μL 不同的液态食品(表2)中,使pDNA 的终浓度达到290 pg/μL(~108拷贝/μL)混匀后分别置于4、20 ℃和37 ℃下贮藏10~30 d。取1 μL PCR 产物-聚阳离子复合物(氨基磷酸比为10∶1)加入到1 mL 虫草酒中,使PCR 产物的浓度达到约0.4 pg/μL(~106拷贝/μL),并置于室温下贮藏60~120 d。同时设置不添加聚阳离子化合物的对照组,即将质粒DNA 或PCR 产物直接加入到液态食品中,使DNA 的终浓度与复合物中DNA 的终浓度相同,其他贮藏条件完全相同。
1.5 荧光定量PCR 法测定DNA 含量
将含有质粒DNA 或PCR 产物的液态食品稀释100 倍后作为荧光定量PCR(qPCR)反应的模板。针对pUC18 质粒DNA 设计的特异性引物为pUC18-170s/a,目的产物长度为170 bp;针对PCR 产物设计的特异性引物为PCR-156s/a,目的产物长度为156 bp(表1)。10 μL qPCR 体系含5 μL 2×SYBR Select Master Mix,0.3 μM 特异性引物,1 μL 稀释后的液态食品。荧光定量PCR 参数为:95 ℃预变性2 min,95 ℃变性20 s,59 ℃退火20 s,72 ℃延伸20 s,40 个循环。
2 结果与分析
2.1 氨基磷酸比对λDNA-聚阳离子复合物稳定性的影响
氨基磷酸比(N/P)是复合物中聚阳离子化合物携带的氨基摩尔数与DNA 携带的磷酸基摩尔数之比,它代表DNA-聚阳离子复合物中正负电荷的比例,是影响聚阳离子化合物与DNA 静电相互作用的重要因素。
本实验制备了不同氨基磷酸比(1∶1~100∶1)的λDNA-壳寡糖和λDNA-精胺复合物,以DNase I 的水解程度为指标,探究了氨基磷酸比对DNA-聚阳离子复合物稳定性的影响。图1 中的结果显示,经DNase I 酶解10 min 后,大部分λDNA 都被水解为500 bp 以下的小片段;当N/P≥10 时,λDNA 的条带位置与标准品位置一致,几乎不会被DNase I 降解,说明壳寡糖对λDNA 的保护效果较好。精胺对DNA的保护效果稍差于壳寡糖,当氨基磷酸比达到10∶1时,有少部分λDNA 被DNase I 轻微降解,产生弥散条带。基于以上结果,后续实验中质粒DNA-聚阳离子复合物的制备选用的氨基磷酸比为10∶1。
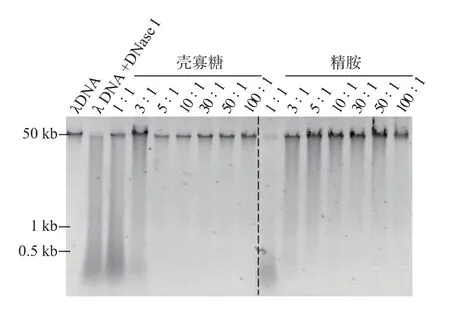
图1 不同氨基磷酸比的λDNA-聚阳离子复合物对DNase I 的耐受性Fig.1 λDNA -polycation complexes with various N/P hydrolyzed by DNase I
2.2 质粒DNA-聚阳离子复合物在液态食品中的稳定性
本实验选取了7 种不同的液态食品(表2),其中包括酒类饮品、乳制饮品、酸味液态食品和碱性饮品。这些液态食品的理化性质特殊,具有一定的代表性,且几乎可囊括大部分液态食品的主要成分,使用其探究DNA-聚阳离子复合物在其中的稳定性具有一定的普遍意义。
为确定液态食品的成分以及聚阳离子化合物对于qPCR 的影响,本实验将含有质粒DNA(pDNA)-聚阳离子复合物的液态食品分别稀释100和1 000 倍后进行qPCR 检测。结果显示,不同液态食品经100 倍稀释后Ct 值有较大差异,但经1 000倍稀释后Ct 值则没有显著性差异(数据未列出),说明食品成分和聚阳离子化合物在充分稀释后对qPCR 反应几乎无影响。因此,此方法可以于定量评价pDNA 在液态食品中的稳定性。
2.2.1 在酒类饮品中的稳定性 本实验中分别测定了单独pDNA 的对照组、pDNA-壳寡糖、pDNA-壳聚糖和pDNA-精胺复合物在白酒和葡萄酒中的稳定性(图2)。结果显示,pDNA 在酒类饮品中的稳定性较差,经37 ℃、10 d 的贮藏后,对照组中白酒和葡萄酒的pDNA 拷贝数由108拷贝/μL 降低至约105拷贝/μL,pDNA 含量仅分别为最初的0.07%和0.08%。降低贮藏温度后,pDNA 的稳定性明显提高,但在20 ℃时,DNA 的破坏程度仍然较大。
将pDNA-聚阳离子复合物加入酒类饮品中可明显提高pDNA 的稳定性,其中壳聚糖对pDNA 的保护效果较好,在20 ℃时经20 d 的贮藏后pDNA-壳聚糖复合物在白酒和葡萄酒中的含量几乎没有数量级的变化。壳寡糖和精胺对酒类中的外源DNA也具有一定的保护作用。
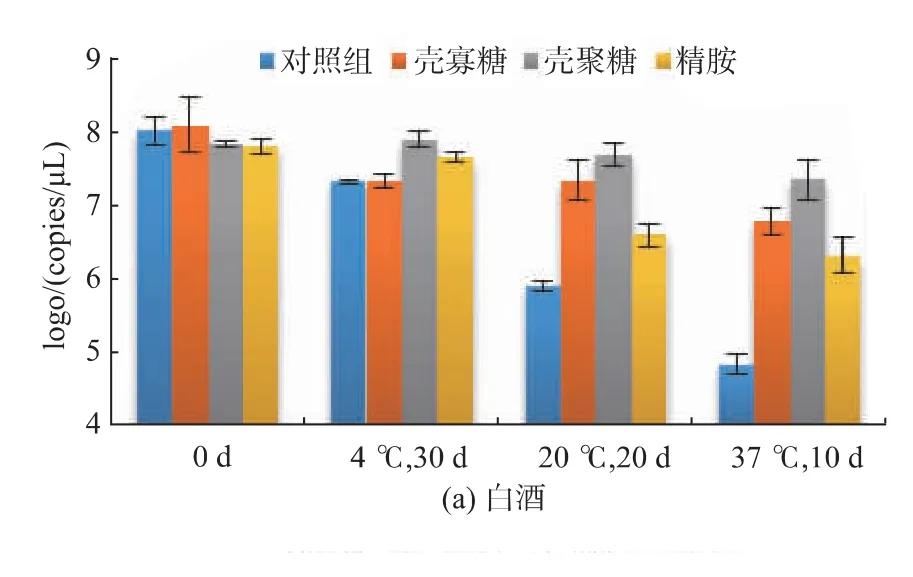
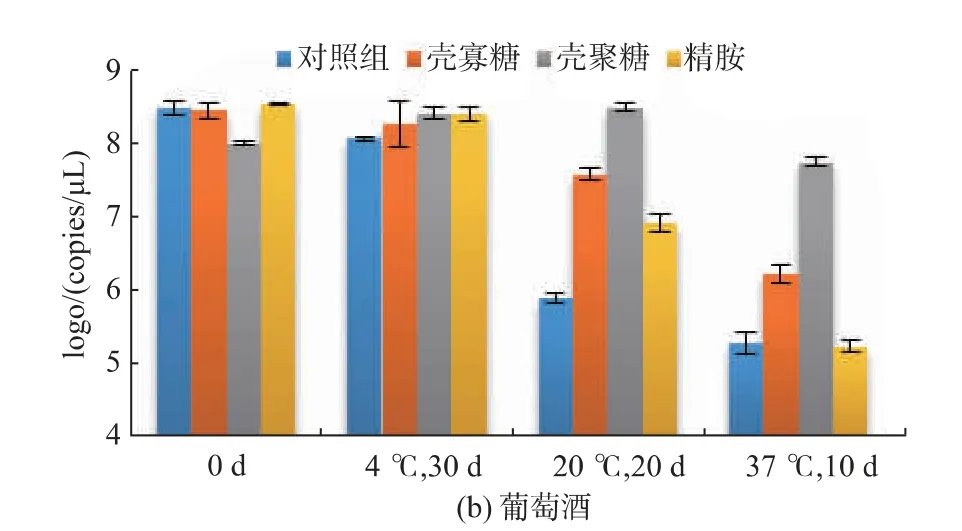
图2 p DNA-聚阳离子复合物在酒类饮品中的稳定性Fig.2 Stability of pDNA -polycation complexes in alcoholic drinks
2.2.2 在乳制饮品中的稳定性 本实验选取了牛奶和乳酸菌饮料为两种代表性的乳制饮品。结果显示,pDNA 在牛奶中的稳定性较低,经37 ℃贮藏10 d 后含量仅为最初的0.9%(图3(a))。在其中加入pDNA-壳寡糖复合物或pDNA-壳聚糖复合物后,pDNA的稳定性明显提高,20 ℃,20d贮藏后,pDNA 的含量几乎无数量级的变化。然而精胺在牛奶中对DNA 的保护作用不明显。
虽然乳酸饮品的pH 值较低(pH 3.9),但与牛奶不同的是,pDNA 在乳酸饮料中的稳定性较高,经不同温度下长时间贮藏后对照组和3 个实验组中的pDNA 含量都几乎无变化(图3(b))。
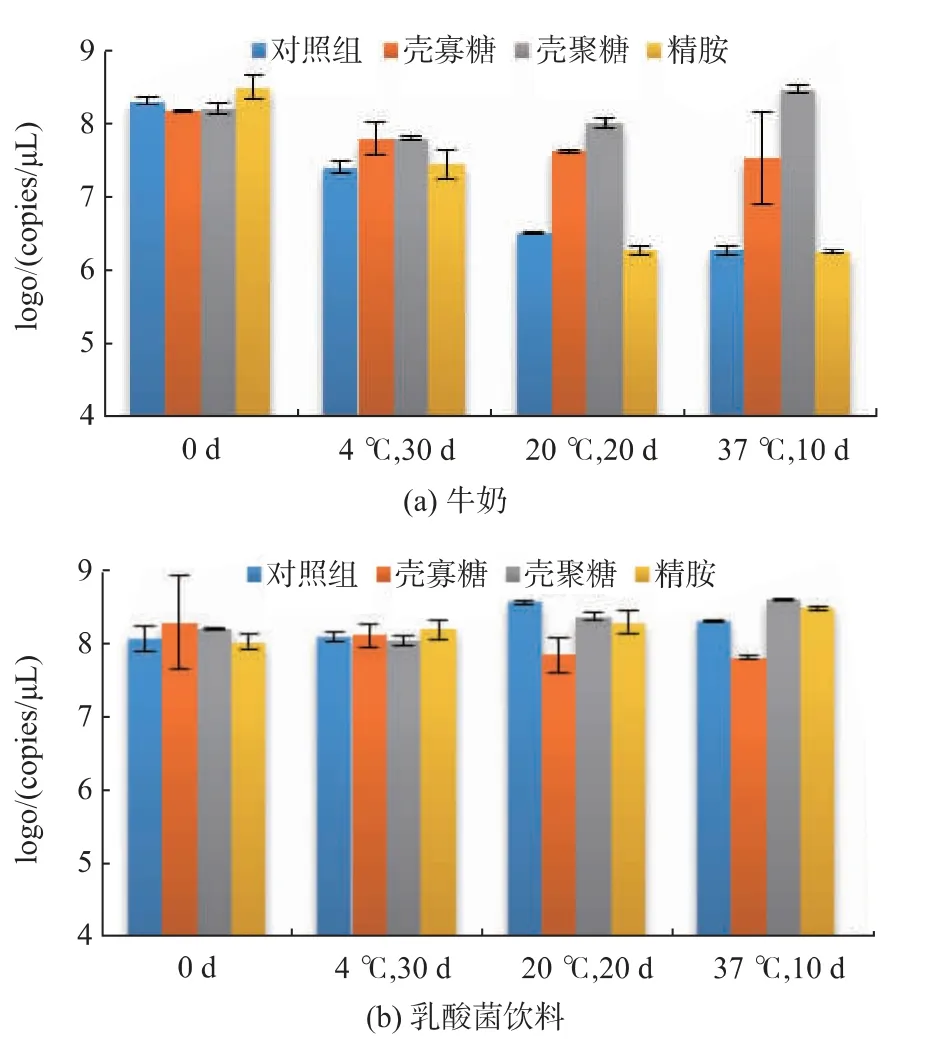
图3 p DNA-聚阳离子复合物在乳制饮品中的稳定性Fig.3 Stability of pDNA-polycation complexes in dairy drinks
2.2.3 在酸味液态食品中的稳定性 本实验选取了pH 值分别为3.0 和2.2 的柠檬汁饮料和白醋作为酸味液态食品的代表,探究pDNA-聚阳离子复合物在酸味液态食品中的稳定性。
pDNA 在柠檬汁和白醋中的稳定性极差,经37℃贮藏10 d 后,柠檬汁饮料和白醋中的pDNA 含量分别仅为最初的0.2%和0.09%(图4)。其中壳寡糖和壳聚糖对pDNA 在柠檬汁饮料中的保护效果较好,在4、20 ℃和37 ℃下贮藏若干天后,pDNA 的含量几乎无变化。然而,白醋对pDNA 的破坏性较强,在贮藏温度高于20 ℃时,壳寡糖和精胺对于DNA的保护作用微弱。白醋中,壳聚糖对于DNA 有一定的保护作用,但在37 ℃贮藏10 d 后,壳聚糖-DNA复合物中的DNA 仍有较明显的降解。
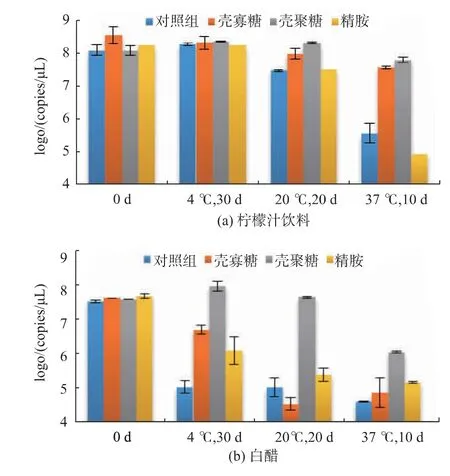
图4 p DNA-聚阳离子复合物在酸味饮品中的稳定性Fig.4 Stability of pDNA-polycation complexes in sour drinks
2.2.4 在碱性饮品中的稳定性 苏打水提供的环境为核酸最稳定的弱碱性条件,因此核酸在其中的稳定性极好,在4、20、37 ℃下长时间贮藏,外源pDNA 的含量都几乎无变化(图5)。
2.3 PCR 产物-壳聚糖复合物在名贵白酒中的稳定性
基于以上结果,壳聚糖对于DNA 在液态食品中的保护作用最强。因此本实验选取虫草酒作为代表性的名贵酒类饮品(表1),初步探究了成本较低且安全性较高的PCR 产物-壳聚糖复合物作为食品溯源内标物的应用可行性。图6 中将含有0.4 pg/μL PCR 产物的虫草酒在室温下贮藏120 d 后,PCR 产物的浓度始终维持在~106拷贝/μL,而未加入壳聚糖的对照组在贮藏90 d 后PCR 产物的含量已低于qPCR 的检测限,造成检测的假阴性。
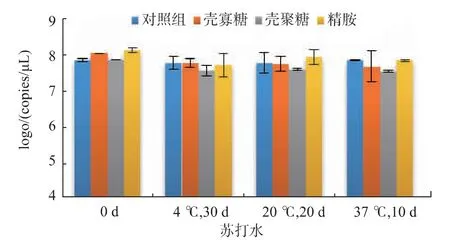
图5 pDNA-聚阳离子复合物在苏打水中的稳定性Fig.5 Stability of pDNA-polycation complexes in alkalic drinks
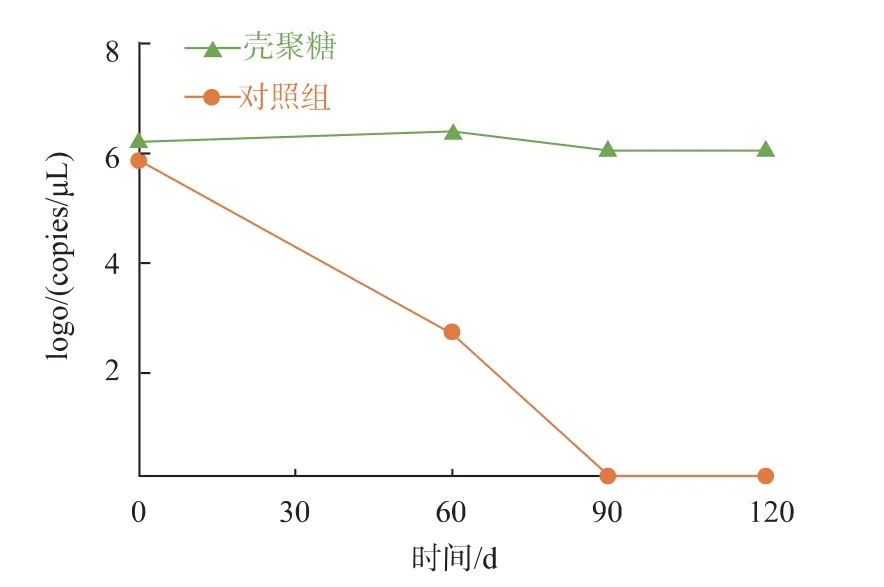
图6 PCR 产物-壳聚糖复合物在虫草酒中的稳定性Fig.6 Stability of PCR products-chitosan complex in cordyceps liqueur
3 讨论
实验表明:DNA 在大部分液态食品中的稳定性较差,尤其是在酒类饮品、牛奶和酸味液态食品中,经20 ℃贮藏20 d 后,DNA 的含量不足最初的1%。然而,聚阳离子化合物可在溶液中与DNA 相互缠绕结合为复合物,通过空间包裹或静电相互作用阻碍核酸酶、自由基和质子等破坏因子对DNA 的攻击,提高外源DNA 在液态食品中的稳定性。使用的3 种聚阳离子化合物中,壳聚糖对DNA 的保护效果最好,壳寡糖其次,精胺较差。这可能是由于壳聚糖的分子量较大,其较长的链状结构易于与DNA 链缠绕形成较为稳定的复合物,而壳寡糖和精胺的分子尺寸较小,与DNA 形成的复合物稳定性较差。
图7 为pDNA-壳聚糖复合物在不同pH 值的液态食品中20 ℃贮藏20 d 后的pDNA 拷贝数。酒类饮品的pH 值较低,白酒的pH 值为3.7,葡萄酒的pH 值为3.1(表2)。酸类物质为白酒中重要的呈味物质,白酒中含乳酸、乙酸、己酸和丁酸等20 多种有机酸,总酸度为0.6~1.5 g/L[22]。葡萄酒的总酸度为1.66~4.52 g/L,其中含酒石酸、苹果酸、乳酸和醋酸等[23]。研究表明,DNA 在相同pH 值的酸性乙醇和水中DNA 的脱嘌呤速率差别不大[24]。因此,外源DNA在白酒和葡萄酒中都会因脱嘌呤而发生较严重的降解,这可解释酸性液态食品中裸露DNA 稳定性较差的原因。根据脱嘌呤的质子化机理[21],聚阳离子化合物可与DNA 的磷酸基团发生静电相互作用,从而减慢嘌呤碱的质子化反应,抑制DNA 的脱嘌呤反应。因此,在酒类饮品中,聚阳离子化合物可能主要是通过抑制脱嘌呤反应来提高外源DNA 的稳定性。
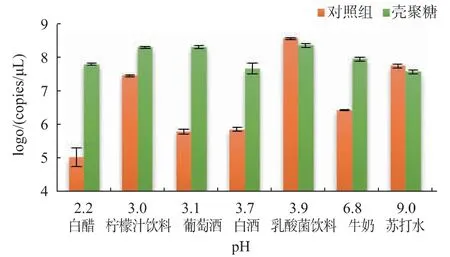
图7 不同pH 值对pDNA-壳聚糖复合物稳定性的影响Fig.7 Stability of pDNA-chitosan complex in drinks with various pH
与酒精类饮品类似的是柠檬汁饮料和白醋,它们的pH 值也较低,分别为2.2 和3.0,DNA 在其中极易发生脱嘌呤反应。研究表明,37℃的条件下,DNA 在pH 2.5 和3.0 的水溶液中的脱嘌呤速率常数分别为7.5×10-6s-1和2.3×10-6s-1[21]。通过计算可得,DNA 在相同条件下10 d 后的脱嘌呤百分比约为99%和86%,因此在这两种液态食品中外源DNA的破坏作用主要由脱嘌呤反应引起的。
牛奶的pH 值为6.8,属于中性饮品,但DNA 在其中的稳定性较差。这可能是由于在牛奶的灭菌过程后仍有部分核酸酶保持活性,从而对DNA 发生水解反应。壳聚糖和壳寡糖可有效抑制核酸酶的水解作用,从而大大提高牛奶中DNA 的稳定性。乳酸菌饮料中DNA 的稳定性较高,可能的原因是其中的牛乳蛋白大多已被水解为小片段的多肽,其中有些带有正电荷的多肽易于与DNA 结合,从而对DNA 起到与聚阳离子化合物相似的保护作用。
本研究选用对DNA 保护效果最好的壳聚糖与PCR 产物制成溯源内标物成功实现了其在虫草酒中的长期稳定存在。PCR 产物可通过对模板和引物的选择控制DNA 的序列和来源(比如,模板可选用其他天然食品来源的DNA),具有较高的安全性。壳聚糖无色无味,还具有调节脂类代谢、提高免疫力、抗菌抑菌及保护消化系统等多种生理作用[25]。因此,极少量的PCR 产物-壳聚糖内标物(<10 pM)不会影响食品的风味和口感,且安全可靠。此外,本方法无需对DNA 进行提取,可通过直接稀释食品对DNA 内标物进行检测,操作流程简便快捷,适用于食品溯源及防伪的快速检测。
4 结语
本研究的结果表明,外源DNA 在多数液态食品中的稳定性较差,在保质期之内就会降解完全。壳聚糖、壳寡糖和精胺等聚阳离子化合物可大大提高DNA 在液态食品中的稳定性,其中分子量最大的壳聚糖对DNA 的保护效果最好,可以维持室温下大部分液态食品中外源DNA 的含量长期保持不变。此外,由于壳聚糖为天然的多糖分子,无毒无害且具有多种生理功能,极其适合应用于食品当中。
DNA 可携带大量序列信息,在不同品牌、批次的产品中加入极少量不同序列的DNA 就可在不影响食品风味和品质的情况下建立信息完善的食品溯源体系。并且,由于实时荧光定量PCR 具有高特异性、高通量检测等特点,可快速同时进行大批量产品的检测。因此,通过将DNA-壳聚糖复合物加入到液态食品中作为食品溯源内标物具有十分广阔的应用前景。
