利用CRISPR/Cas9系统建立斑马鱼sonic hedgehog基因敲除模型及视网膜发育表型的初步鉴定
2019-01-25张昕姜悦张青宇郭锡熔池霞童梅玲
张昕,姜悦,张青宇,郭锡熔,池霞,童梅玲
(南京医科大学附属妇产医院/南京市妇幼保健院 儿童保健科,江苏 南京 210004)
sonic hedgehog(shh)是一类分泌性蛋白,其介导的shh信号通路与视网膜发育密切相关[1],它能影响视网膜祖细胞的分化,决定感光细胞的发育以及视网膜的分层结构等。然而,目前有关shh及其介导的信号通路调控视网膜发育机制的报道仍较少。
本研究采用CRISPR/Cas9对斑马鱼的shh基因进行编辑[2- 3],通过鉴定及筛选,初步建立shh基因敲除斑马鱼模型,并比较shh基因突变斑马鱼与野生型斑马鱼形态及相关眼发育的不同,研究shh基因对斑马鱼生长发育的影响。
1 材料与方法
1.1 斑马鱼饲养
实验动物为德国Tubingen品系,购于南京大学模式动物中心。喂养及产卵方法按照zebrafish Book常规进行,照明14 h、黑暗10 h交替,饲养在循环水中,水温保持在(26±2)℃。每天投喂3次丰年虾片。动物实验所有操作均得到南京医科大学实验动物管理与使用委员会批准。
1.2 sgRNA的制备及斑马鱼受精卵显微注射
分析得到斑马鱼shha蛋白质的保守结构功能域,将待敲除目标序列设计在编码114aa之后的基因组序列上。设计引物gRNA- 1和gRNA- 2。将sgRNA1、sgRNA2和Cas9 mRNA以一定量混合后,显微注入斑马鱼受精卵,待胚胎发育至受精后7 h(hours post- fertilization, hpf)时,随机取5枚胚胎进行鉴定,确定sgRNA的活性。
1.3 斑马鱼模型的构建和筛选
将得到的shha基因敲除的F0代斑马鱼,剪取尾鳍提取DNA,PCR扩增验证测序,鉴定出F0代突变基因型。获得F1,通过剪取尾鳍进行基因型鉴定。再以引物对shha F和shha R进行PCR扩增,并用shha F- 2(TAGAAACGTTAAACAACGGC)进行测序,通过阅读测序的色谱图,确定F1是否为携带shha等位基因突变的突变体。将shha突变体F1(♂)和野生型斑马鱼(♀)进行交配,收集胚胎(F2),饲养至2个月龄,对F2代进行基因型鉴定。
1.4 斑马鱼形态学观察及HE染色
收集受精后4 d(days post- fertilization, dpf)斑马鱼幼鱼各6条,置于4%多聚甲醛中,进行石蜡包埋切片,用二甲苯进行脱蜡,无水乙醇进行水化,行HE染色,在倒置显微镜下观察野生型及突变体斑马鱼胚胎的发育变化,并采用捷达病理图像分析系统软件进行拍照。
2 结 果
2.1 sgRNA识别点及鉴定
根据蛋白质保守功能结构域,将待敲除的目标序列(sgRNA识别序列)设计在编码114aa之后(HH- signal)的基因组序列上,设计序列为shha F(AATTTGGGAATTGTTTGGAGA)、shha R (GAGAGGGAGTGTGAAGCATTG)、shha- sgRNA1(GAAGAATCACTCCACTACGA【GGG】)、shha- sgRNA2(GACACTGTCTCGCCTAGCTG【TGG】)。结果表明至少sgRNA2具有活性,且活性大于7.1%。
2.2 F0代基因突变斑马鱼检测及F1代建立
结果表明,F0代shha基因敲除的初建者,基因组中突变基因型比例>5%,对109尾F1鱼进行基因型鉴定,发现有8尾携带突变的等位基因,其中7尾发生移码突变,根据基因分析结果,最终确定4号突变体为后续研究对象,如图1所示。
2.3 斑马鱼shha基因敲除杂交突变体体系的建立
根据突变体类型,分别设计鉴定野生型和突变体的引物,并对其进行验证,结果显示:引物shha- 4bp wt F2(GGACACTGTCTCGCCTAGCT)/shha R(GAGAGGGAGTGTGAAGCATTG)和shha- 4bp mut F1(GGACACTGTCTCGCCTGT)/shha R(GAGAGGGAGTGTGAAGCATTG)可以用于shha突变体的鉴定。F2代斑马鱼17尾中有10尾shha杂合突变。以2号和3号斑马鱼基因组为模板进行PCR扩增,并以F- shha- 3进行Sanger测序,对上述PCR结果进行验证。测序结果表明,建立的PCR法进行基因型鉴定是有效的,见图2A~B。
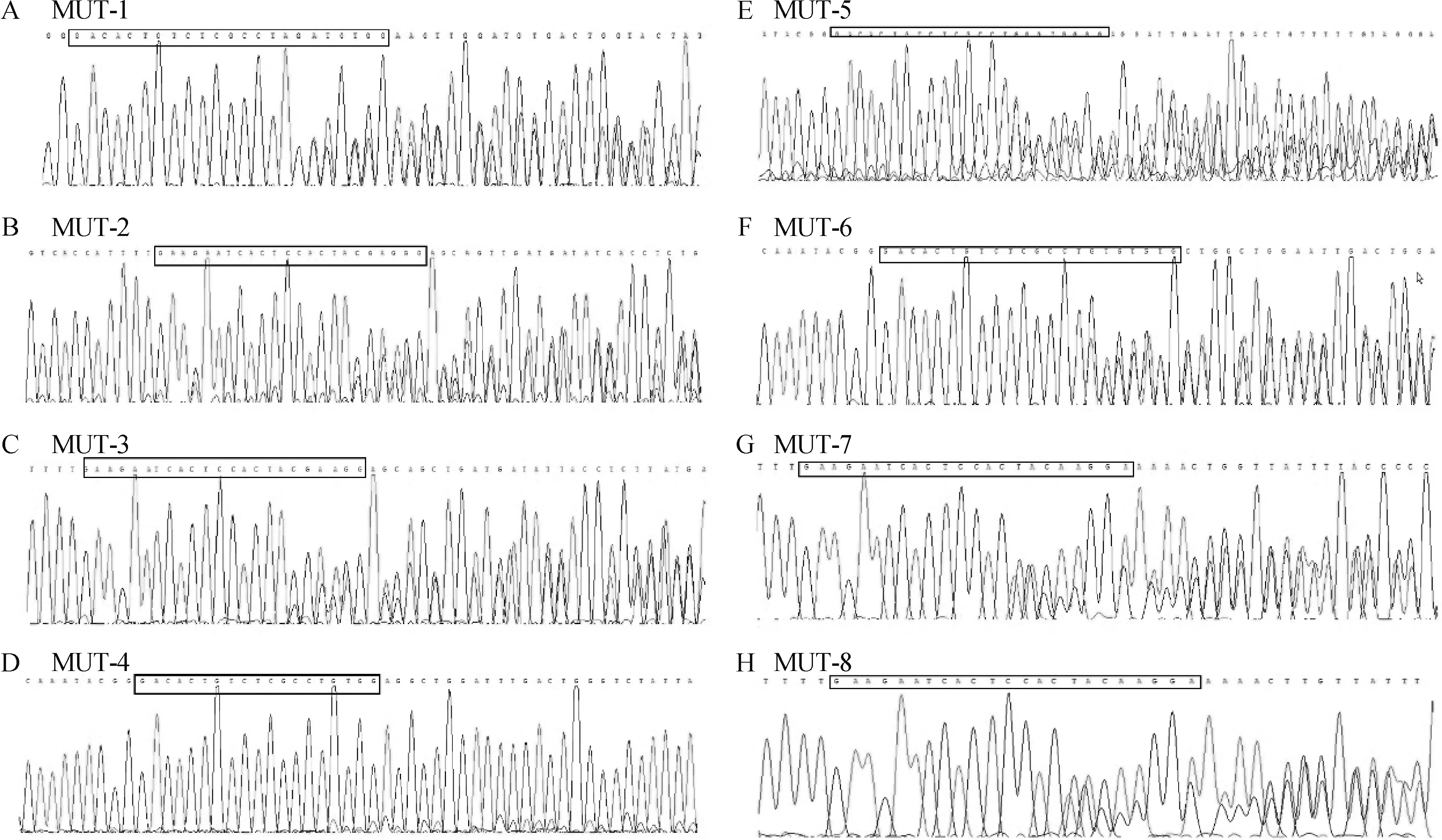
A~E方框处为sgRNA,除外B,部分序列已发生indel突变
图1F1代斑马鱼基因型鉴定
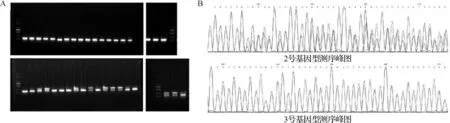
A.19尾斑马鱼扩增电泳图;B.测序验证结果图
图2F2代突变体引物设计验证
利用已建立的PCR法对116条F2代斑马鱼进行鉴定,发现共有shha杂合突变后代41尾;进一步PCR验证及测序,结果表明41尾斑马鱼尾携带shha移码突变的杂合突变体,见图3。
2.4 Shha+/-突变斑马鱼形态变化及HE染色
与野生型斑马鱼相比,shha+/-突变体胚胎及幼鱼多个系统的发育受到明显影响,出现鱼卵发育停滞、脊柱弯曲、心包水肿、眼球发育较小等异常。受精后96 h,HE染色可见:与同龄野生型斑马鱼相比,突变体视网膜细胞分层排列,但感光细胞及视神经细胞发育较差,细胞排列不规则,细胞数减少,细胞核增大,见图4。
3 讨 论
眼睛是大脑的延伸,是重要的感觉器官。胚胎发育期间,表面外胚层形成晶状体和角膜,与前神经板形成视网膜上皮层的虹膜和睫状体[4]。如果在这一时期出现发育干扰,就会出现各种眼病,如先天性白内障、青光眼和视网膜病,这些疾病发生均与视网膜感光细胞及神经节细胞受损相关。还有学者证实,实验性剥夺性近视是由于视网膜感光细胞形态学的改变所致。目前国内越来越多的儿童出现视力障碍[5],进一步对其机制进行研究很有必要。

A.87尾斑马鱼扩增电泳图;B.shha杂合突变后代41尾;C、D.41尾突变体测序鉴定图
图3F2代斑马鱼突变体鉴定
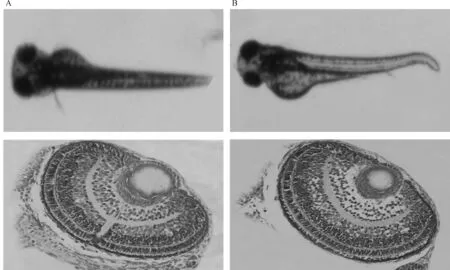
A.对照组;B.突变体
图4视网膜发育初步表型鉴定
斑马鱼作为一类具有高度视觉的物种,其通体透明,眼球占头部体积较大,视网膜与人类具有相似的生理学和形态学特点,使它成为研究眼球发育和功能基因控制的理想模型[6- 7]。斑马鱼的视网膜发育与其他脊椎动物一样,遵循两个原则:从中间到周边,从内到外。多能神经前体细胞在受精后27~28 hpf首先分化成视网膜神经节细胞(RGC),随后依次分化形成内丛状层、无轴突细胞层、外丛状层,于43 hpf出现感光细胞层,96 hpf时幼鱼孵化完全,其视网膜功能逐步成熟[8- 10]。因此,采用斑马鱼为模式动物可以更好地动态观察视网膜的发育。
脊椎动物的视网膜发育受许多因素调控,其中shh及其介导的信号通路与视网膜发育密切相关。细胞分泌shh蛋白后,由靶细胞膜上的patch和smo两种受体接收信号,再通过激活下游Gli分子发挥作用[11]。研究表明:shh参与视网膜神经节细胞及感光细胞的发育过程[12- 13];用shh氨基酸片段处理可使体外培养的小鼠视网膜感光细胞比例升高[14];抗shh抗体会影响鸡胚视网膜色素上皮细胞的生成[15]。由此可见,shh及其介导的信号通路在视网膜发育中承担着重要角色。
研究表明,在Cas9显微注射的斑马鱼受精卵中,平均约50%能够发育成为稳定的突变品系并向下传递[16]。本研究利用CRISPR/Cas9基因编辑技术,以斑马鱼作为模式动物,在shh第2个外显子上设计sgRNA靶点,引导Cas9 mRNA进行特异性剪切,建立shh移码突变斑马鱼敲除模型。对F2代斑马鱼进行鉴定时发现,其纯合子、杂合子、野生型比例不符合孟德尔定律,推测shh纯合子可能致死,具体机制仍需进一步研究。本研究结果发现,shha+/-突变体胚胎及幼鱼出现鱼卵发育停滞、脊柱弯曲、心包水肿、眼球发育较小等多种异常,推测shh在各个系统发育中均起到重要作用。96 hpf时,利用HE染色发现,shh+/- 斑马鱼视网膜分层排列,但感光细胞及神经节细胞发育差,细胞排列紊乱,细胞数减少,胞核变大,据此可以推断,shh可能通过影响视网膜感光细胞及神经节细胞的发育来参与相关眼病的发生。
在视网膜发育过程中,shh的作用不可或缺,但目前其具体的调控过程及敲除后造成的视网膜损伤机制仍不清楚,需要进一步探索。本次研究建立了shh突变斑马鱼模型,为后续研究提供良好的动物模型,为下一步研究致病机制及相关信号通路打下基础。
