羽衣甘蓝β-胡萝卜素羟化酶基因的克隆及表达分析
2019-01-24王玉书周明慧
王玉书,王 欢,郭 宇,周明慧,陈 璐,陈 阳
(1.齐齐哈尔大学 生命科学与农林学院,黑龙江省抗性基因工程与寒地生物多样性保护重点实验室,黑龙江 齐齐哈尔 161006; 2.齐齐哈尔大学 化学与化学工程学院,黑龙江 齐齐哈尔 161006)
类胡萝卜素是在自然界植物、细菌和真菌中广泛存在的一类色素类物质,同时在植物光合作用中起重要作用[1-2]。β-胡萝卜素羟化酶在植物类胡萝卜素生物合成代谢途径中具有非常重要的作用,其作用是催化β-胡萝卜素通过中间代谢物β-隐黄质生成玉米黄质,因其增加了植物细胞中玉米黄质的含量,所以该反应在植物叶黄素循环中有非常重要的意义[3]。有研究表明,β-胡萝卜素羟化酶基因的过量表达有助于细胞中玉米黄质的过量积累,进而提高细胞中类胡萝卜素含量[4];而利用反义抑制和T-DNA突变获得抑制β-羟化酶基因表达的拟南芥植株,由于β-羟化酶基因的缺陷,它们合成隐黄素等类胡萝卜素的能力减弱,抗逆性随之大幅下降[5-6]。目前已从拟南芥[7]、烟草[8]、柑橘[9]、辣椒[10]等植物中分离鉴定了许多β-胡萝卜素羟化酶基因。通过生物信息学比对分析发现,这些基因均具有非常保守的同源序列。
羽衣甘蓝叶片颜色鲜艳,较耐严寒、干旱,因此成为冬春季节中重要的绿化景观植物。研究表明,在羽衣甘蓝生长过程中,叶色与叶绿素、类胡萝卜素及花青素的含量密切相关[11]。然而到目前为止,关于羽衣甘蓝中类胡萝卜素生物合成途径的相关基因研究还鲜有报道。本研究采用同源克隆和RT-PCR技术获得羽衣甘蓝β-胡萝卜素羟化酶基因BoBCH,并对其进行了生物信息学分析,研究该基因在不同组织、不同发育阶段的表达情况,为羽衣甘蓝β-胡萝卜素羟化酶基因的功能鉴定及调节机制提供理论基础。
1 材料与方法
1.1 材料
紫叶羽衣甘蓝DH系D07于2017年1月种植于齐齐哈尔大学园艺试验基地,分别取D07的根、茎、叶不同组织和幼苗期、莲座期、观赏期3个时期的幼嫩叶片,经液氮速冻后-80 ℃保存,备用。
1.2 方法
1.2.1 总RNA的提取及cDNA的合成
利用Trizol(Invitrogen,USA)试剂盒提取羽衣甘蓝总RNA,之后经NanoDrop 2000分光光度计(Thermo Scientific,USA)测定浓度及D260/D280,琼脂糖凝胶电泳检测RNA完整性。检测合格后,取经DNase处理后RNA作为模板,使用反转录试剂盒将2 μg植物总RNA反转录为cDNA,检测待用。
1.2.2 引物设计与基因克隆
基于作者前期全基因组测序筛选得到的BoBCH基因序列,设计克隆引物F(5′-ATGGCGGCAGCACTCTCATCAATCTC-3′)和R(5′-AGAGGTGGAAACCTTGTTGTATAATTTGTAA-3′)。cDNA扩增使用ABI Veriti PCR 扩增仪进行。PCR体系:2×Ultra-Pfu Master Mix酶(Dye Plus)5 μL、模板1 μL、正反引物各0.8 μL和ddH2O 2.4 μL。PCR反应条件为:94 ℃ 2 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 8 min。PCR产物电泳分析后,回收、连接、转化及测序,得到BoBCH的cDNA序列信息。
1.2.3 生物信息学分析
利用NCBI网站对BoBCH的cDNA序列在线查找开放阅读框(ORF);利用蛋白质分析在线工具(http://web.expasy.org/protparam/)在线程序分析编码蛋白的理化性质(氨基酸组成、相对分子质量、等电点等);利用ExPasy-ProtScale预测氨基酸的亲/疏水性;利用NCBI在线工具CDD(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析氨基酸序列的保守结构域;利用SignalP4.1和Wolf-Psort进行信号肽和蛋白亚细胞定位预测;TMHMM2.0对蛋白进行跨膜区分析;用MEGA6.0软件采用邻接法进行氨基酸序列比对以及构建系统发育树。
1.2.4 基因表达分析
根据测序结果,设计荧光定量引物分别为BoBCH-F和BoBCH-R,以18S rRNA作为内参,引物为18S rRNA-F和18S rRNA-R(表1)。引物采用Roche LCPDS2软件设计并由北京擎科新业生物技术有限公司合成。qRT-PCR反应根据QuantiFast® SYBR® Green PCR Kit试剂盒(Qiagen,Germany)说明书,在Light Cycler®480Ⅱ型荧光定量PCR仪(Roche,Swiss)上进行反应。每个反应采用3个生物学重复和3个技术重复。反应结束后,应用2-△△Ct算法进行相对定量计算[12]。
表1PCR引物
Table1The primers of PCR used in this study
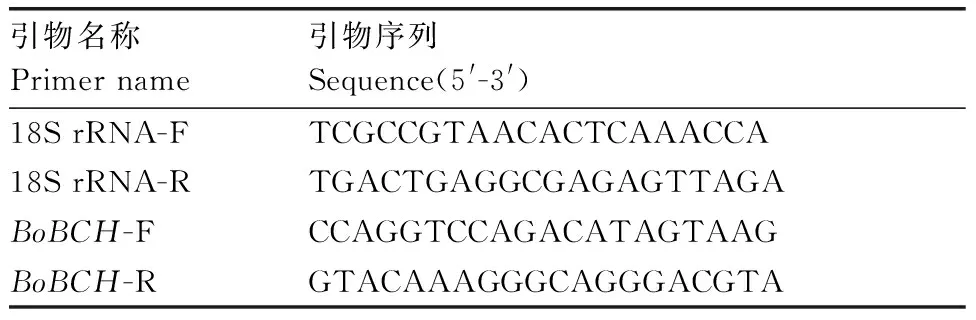
引物名称Primer name引物序列Sequence(5'-3')18S rRNA-FTCGCCGTAACACTCAAACCA18S rRNA-RTGACTGAGGCGAGAGTTAGABoBCH-FCCAGGTCCAGACATAGTAAGBoBCH-RGTACAAAGGGCAGGGACGTA
2 结果与分析
2.1 BoBCH基因的克隆
以羽衣甘蓝D07观赏期叶片cDNA为模板,通过PCR扩增后获得BoBCH基因片段,经过琼脂糖凝胶电泳检测获得条带与预期大小相符(图1)。对扩增结果进行测序分析,将该基因命名为BoBCH(GenBank登录号为MH016242)。
2.2 BoBCH基因cDNA序列的生物信息学分析
2.2.1BoBCH基因编码氨基酸序列分析
利用ORF finder在线工具翻译BoBCH的cDNA序列,BoBCH基因编码301个氨基酸。利用蛋白质分析在线工具(http://web.expasy.org/protparam/)分析BoBCH蛋白的物理化学性质,结果表明BoBCH蛋白由20种氨基酸组成,其中丝氨酸(Ser)含量最多,半胱氨酸(Cys)含量最少,带负电氨基酸残基25个,带正电氨基酸残基37个;分子量约为33.8 ku,理论等电点为9.67;亲水性平均系数(GRAVY)为-0.072,说明BoBCH蛋白为亲水蛋白。利用ExPasy-ProtScale预测氨基酸的亲/疏水性表明:该蛋白的最高值为2.133,在第140个氨基酸处,疏水性最强;最低值为-3.044,在第170个氨基酸处,亲水性最强。同时,从整条多肽链的氨基酸预测值来看,亲水性氨基酸残基所占比例高于疏水氨基酸残基,由此推断,BoBCH蛋白是一种亲水性蛋白,与基因编码氨基酸序列的分析结果一致。利用NCBI在线工具CDD分析BoBCH氨基酸保守蛋白结构域,结果表明,BoBCH属于FA_hydroxylase蛋白超家族(图2)。

M, DNA marker; 1~3, RT-PCR扩增产物。M, DNA marker; 1-3, RT-PCR products.图1 羽衣甘蓝BoBCH基因PCR扩增结果Fig.1 PCR amplification of BoBCH gene from the kale
2.2.2 BoBCH蛋白的信号肽、跨膜结构及亚细胞定位预测
运用在线工具Signal P4.1 server进行信号肽分析预测,结果显示,C值、S值、Y值均小于阈值0.45,推测BoBCH蛋白无信号肽结构,属于非分泌蛋白。蛋白跨膜结构预测分析显示, BoBCH蛋白在93~115、130~152、183~200和204~226处有4个跨膜结构域(图3)。亚细胞定位分析结果显示,BoBCH可能定位于叶绿体中。
2.2.3 BoBCH蛋白序列的进化分析
为了预测BoBCH基因的功能,从NCBI中查找到其他植物的BCH同源蛋白序列,采用MEGA6.0邻接法与羽衣甘蓝BCH蛋白序列对比并构建无根系统进化树(图4)。羽衣甘蓝与结球甘蓝、甘蓝型油菜、拟南芥等10个高等植物的BCH序列比对显示,这11个植物BCH氨基酸序列被聚为两大类。羽衣甘蓝BCH与结球甘蓝处于同一分支,其亲缘关系最近,其序列一致性高达99%;与醉蝶花、萝卜、大白菜等物种的BCH蛋白在进化上亲缘关系较远。
2.3 BoBCH基因特异性表达分析

图2 BoBCH的保守结构域预测Fig.2 Prediction of BoBCH conserved domains

图3 BoBCH蛋白跨膜结构域预测Fig.3 Prediction of transmembrane domains in BoBCH protein
为了研究BoBCH基因在羽衣甘蓝不同组织中的表达情况,对不同组织提取的RNA进行了实时荧光定量qRT-PCR分析。结果表明,观赏期BoBCH在不同器官中均有表达,但表达具有组织特异性,其在叶片中表达量最高,极显著高于其他器官(P<0.01);其次是茎;而在根中表达量最少,与其他组织表达差异极显著(P<0.01)。BoBCH基因在D07幼苗期、莲座期和观赏期3个时期叶片中的表达量也存在显著差异,其中观赏期时表达量最高,莲座期和幼苗期表达量差异不显著(P>0.05),观赏期BoBCH的表达量约为其他两个时期表达量的10倍(图5)。

图4 羽衣甘蓝BoBCH与其他植物BCH蛋白的系统进化树Fig.4 Phylogenetic tree analysis of BoBCH protein in kale and BCHs of other plants
3 讨论
本研究利用同源克隆技术从羽衣甘蓝D07中克隆得到BoBCH基因的全长cDNA序列。通过序列分析发现,BoBCH与结球甘蓝、甘蓝型油菜、拟南芥、琴叶拟南芥等植物的BCH氨基酸序列相似性达76%以上,它们均属于FA_hydroxylase蛋白超家族,表明该结构域在分析进化过程中稳定性较好,在类胡萝卜合成及抵抗非生物胁迫中发挥类似的作用[13-14]。氨基酸序列同源性分析表明,BoBCH蛋白与结球甘蓝蛋白在同一分支,进化关系最近,因此推测它们应该具有相类似的功能,可能与类胡萝卜素合成有关。跨膜结构预测和亚细胞定位预测得知,BoBCH蛋白含有脂肪酸羟化酶超家族保守域(BoBCH保守区域分别为93~115、130~152、183~200和204~226处残基),可能定位于叶绿体中。这与目前己报道的其他物种中β-胡萝卜素羟化酶定位于叶绿体类囊体膜上的结论一致[15],推测该类酶经由叶绿体导肽从细胞质运输到叶绿体类囊体膜上。这些生物信息分析对于将来研究BoBCH蛋白相关功能具有指导意义。

不同大写字母代表不同组织或发育时期间表达量差异显著(P<0.01)。The bars with different capital letters showed the significance(P<0.01).图5 BoBCH在D07不同组织和不同发育时期中的相对表达量Fig.5 Relative expression levels of BoBCH in different tissues and different developmental stages of D07
研究发现,羽衣甘蓝β-胡萝卜素羟化酶基因BoBCH在根、茎、叶中均能表达,但不同组织器官中存在显著性差异,BoBCH在叶片中的表达量最高,其次是茎,根中表达量最低。在不同发育阶段的结果表明,在幼苗期与莲座期时,BoBCH基因表达量均较低,并且无显著差异,然而观赏期时BoBCH的表达量高达幼苗期与莲座期的10倍之多,表明在观赏期时叶片中BoBCH基因积累较多,并发挥其催化作用。这可能是因为BoBCH的活性与叶片中类胡萝卜素含量密切相关[16],说明本研究克隆得到的BoBCH基因可能在羽衣甘蓝叶片的类胡萝卜素合成途径中发挥重要作用。
本研究克隆获得羽衣甘蓝BoBCH基因的cDNA序列,并对该基因在不同组织及不同发育时期的表达模式进行了分析,推测BoBCH基因在羽衣甘蓝类胡萝卜素代谢调控中起重要作用。后续研究中,将会就该基因的瞬时表达、转基因验证等方面进行BoBCH基因功能的研究,并对该基因与类胡萝卜素生物合成途径中相关酶基因之间的互作关系进行深入研究,进而全面解析羽衣甘蓝类胡萝卜素合成代谢调控的分子机制。
