二化螟实时荧光定量PCR内参基因筛选和表达稳定性评价
2019-01-24徐红星王国荣鲁艳辉杨亚军郑许松田俊策吕仲贤
徐红星 王国荣 鲁艳辉,* 杨亚军 郑许松 田俊策 吕仲贤,*
二化螟实时荧光定量PCR内参基因筛选和表达稳定性评价
徐红星1王国荣2鲁艳辉1,*杨亚军1郑许松1田俊策1吕仲贤1,*
(1浙江省农业科学院 农业部农产品信息溯源重点实验室/省部共建国家重点实验室培育基地, 杭州 310021;2杭州市萧山区农业技术推广中心, 杭州 311202;*通讯联系人: luyanhui4321@126.com; luzxmh@163.com)
【目的】筛选特定试验条件下二化螟()稳定表达的内参基因,为二化螟基因表达研究奠定基础。【方法】根据二化螟转录组测序结果挑选出11个候选基因,利用实时荧光定量PCR测定其在二化螟不同发育历期、不同组织、温度处理、杀虫剂处理、取食不同饲料、取食不同水稻、dsRNA处理和混合样品的表达量,利用RefFinder、BestKeeper、GeNorm和NormFinder等软件和ΔC值对11个候选基因的稳定性进行评估。【结果】5种分析方法表明,在二化螟不同发育历期稳定性较高的内参基因是、和,不同组织中稳定性较高的内参基因是、和,不同温度下较稳定的内参基因为、和,杀虫剂处理样品中较稳定的是和,取食不同饲料较稳定的是、、和,取食不同品种水稻较稳定的是和,dsRNA处理样品中较稳定的是、、和,混合样品中较稳定的是和。【结论】为不同试验条件下选择合适的内参基因提供了参考,也有利于在二化螟基因表达研究中获得更加可靠准确的数据。
二化螟;内参基因;荧光定量PCR;基因表达
实时荧光定量PCR(qRT-PCR)是目前检测生物样品中基因表达差异最灵敏、便捷的方法之一[1]。在利用qRT-PCR进行目的基因的表达水平研究时,需要使用合适的内参基因对实验样品进行校正和标准化,以减少转录效率、cDNA浓度差异等对结果的影响。这些内源性参照基因(简称内参或看家基因)应不受外部环境的影响,在各种组织或细胞中以及各种试验条件下都能稳定表达[2]。常用的看家基因包括18S核糖体RNA基因(18S rRNA)、微管蛋白基因(tubulin)、甘油醛-3-磷酸脱氢酶基因(glyceral dehyde-3-phosphate dehydrogenase, GAPDH)、核糖体蛋白基因(ribosomal protein)和β-肌动蛋白基因(β-actin)。然而越来越多的研究表明,这些看家基因在用作内参基因时,因为选用的试验条件不同,稳定性不一[3]。如Gutierrez等[4]报道在用微管蛋白基因(tubulin6)校正发育动态表达时,与已经验证的内参基因相比, 使用未验证的内参基因进行校正将对目标基因表达水平的定量出现100倍的偏差。盲目地使用一种看家基因作为内参, 一方面可能导致基因表达的微小差异难以发现;另一方面可能出现错误甚至相反的结论[5-6]。因此,筛选和评价在不同试验条件下稳定表达的内参基因对获得更准确的试验结果十分重要。
二化螟[(Walker)],是我国水稻上的常发性害虫,食性较杂,除为害水稻外,还为害茭白、玉米等。随着对研究的不断深入,基因表达水平分析对于研究二化螟的寄主选择、适应性、抗药性、滞育和神经调节等相关基因的调控机理方面具有重要作用。因此,筛选稳定的内参基因在二化螟基因表达研究中起着关键作用。在之前的研究中已有对多种鳞翅目昆虫筛选稳定的内参基因的报道,如小菜蛾[7]、斜纹夜蛾[8]、棉铃虫[9-11]、甜菜夜蛾[12]、褐蝶[13]、大螟[14, 15]、大斑蝶[16]、蝙蝠蛾[17]、草原毛虫[18]和桃蛀螟[19]等。尽管之前有二化螟内参基因评价的相关研究[20, 21],探讨了在不同组织、不同发育历期和不同温度处理下内参基因的稳定性,但本研究还对杀虫剂处理、不同喂食、取食不同品种水稻和dsRNA处理下内参基因的表达稳定性进行了评估,为不同试验条件下选择合适的二化螟内参基因提供依据。
1 材料与方法
1.1 供试昆虫和不同的处理
二化螟种群于2014年采自浙江省杭州市萧山区义桥镇(N 30º04', E 120º12')常规水稻田,置于人工气候室饲养并维持种群。温度为(25±1)℃,相对湿度为75%,光周期为16 h光照/8 h黑暗。幼虫采用人工饲料饲养[22],羽化后的成虫以10%的蔗糖水补充营养。
不同组织样本:选择个体大小一致、健康的3龄幼虫,饥饿3 h,在预冷的生理盐水中解剖,获取头、中肠、脂肪体和表皮四部分组织。
不同发育时期样本:收集不同发育阶段的样本,包括第5天的卵、1~6 龄幼虫(蜕皮后第1天的幼虫)、早期蛹(第1天的蛹)、晚期蛹(第7天的蛹)、雌雄成虫(第1天羽化的成虫)。
温度处理:分别采用5℃,10℃,15℃,20℃,25℃,30℃,35℃,40℃处理二化螟3龄幼虫3 h,收集样品,液氮速冻,置于−80℃超低温冰箱保存,以备提取RNA用,每个处理3个生物学重复,每个重复收集5头幼虫。
药剂处理:选取三种常用于防治二化螟的药剂氯虫苯甲酰胺、阿维菌素、甲氧虫酰肼(原药由中国农业大学高希武教授提供),采用稻苗浸渍法进行毒力测定[23]。每种药剂用含0.1% TritonX-100的清水稀释5个浓度梯度,0.1% TritonX-100的清水作为空白对照。将分蘖期的水稻茎秆基部放入各处理药液中浸渍10 s,取出晾干后将稻茎齐根剪下,留下5~6 cm的茎秆。事先准备6.5 cm直径的培养皿若干,每皿内铺4层滤纸并加入无菌水保湿。将茎秆放入培养皿中,每个培养皿放置15根茎秆并用毛笔接入10头3龄幼虫,每组重复3次。然后用两层黑布覆盖。48 h后观察幼虫死亡情况,计算LC25。然后以每种药剂的LC25分别处理二化螟3龄幼虫,48 h后收集存活的试虫,每个重复收集5头,共收集3个重复,液氮冻存置于−80℃下供提取总RNA用。
不同寄主植物饲喂:利用人工饲料、水稻品种TN1(台中本地1号)的茎秆、茭白和香根草饲喂二化螟3龄幼虫3 d后,收集样品,提取总RNA。
不同水稻品种饲喂:用不同水稻品种(TN1和转基因的明恢63)茎秆饲喂二化螟3龄幼虫3 d后,收集样品,提取总RNA。
dsRNA处理:选取大小一致的3龄幼虫,利用以二化螟乙酰胆碱酯酶基因为靶标的dsRNA(利用TranscriptAid™ T7 High Yield Transcription Kit按照说明书操作合成)进行显微注射(仪器:Nanoject II,Drummond Scientific Company;注射部位:第三和第四节间膜[24]),单头注射量为1 μL(1.0 μg/μL)的dsRNA,对照采用缓冲液(dsRNA合成试剂盒中提供的溶解dsRNA的缓冲液)。每组注射30头,注射完3 d后,收集存活的试虫,每个重复收集5头,共收集3个重复,−80℃下保存供提取总RNA用。
1.2 总RNA提取和cDNA合成
所有样本总RNA提取采用Trizol试剂,具体步骤参照Trizol试剂说明书(Invitrogen)。取1 μL RNA样品测定260/280(Nanodrop 2000,Thermo Fisher Scientific),比值在1.8~2.2之间的样品用于cDNA合成。
cDNA合成:取3.0 μg总RNA,利用Oligo dT进行cDNA合成,操作步骤参照Thermo Fisher反转录试剂盒说明书。cDNA置于−20℃下保存以供实时PCR用。
1.3 qRT-PCR检测候选内参基因引物特异性和扩增效率
利用Primer 3.0设计二化螟备选基因(表1)。实时荧光定量PCR反应按照iTaqTMUniversal SYBR Green Supermix (Bio-Rad,USA)说明书进行,使用ABI 7300定量PCR仪。反应体系共20 μL,包含1 μL的cDNA,10 μL iTaq Universal SYBR Green Supermix (2×),正反向引物各1 μL,双蒸水7 μL;反应条件为95℃下30 s,95℃下10 s,55℃下30 s,共40个循环。融解曲线:55℃到95℃,每0.5℃收集一次荧光信号。每个cDNA样本设置2个技术重复。cDNA按5倍等比稀释成5个不同浓度,获得引物扩增效率。
1.5 基因表达稳定性分析
分别利用RefFinder (http://www.leonxie.com/ referencegene.php?type=reference)、BestKeeper[25]、GeNorm[26]、NormFinder[6]等分析软件和ΔC值[27],评估候选内参基因在不同条件下的表达稳定性。每个样品重复3次。
2 结果与分析
2.1 引物的扩增效率及特异性评价
qRT-PCR数据显示,每个候选内参基因的溶解曲线均为单一峰,表明所选的定量引物均具有很好的特异性。同时,基于内参基因不同浓度的cDNA获得的标准曲线具有良好的决定系数(R>0.987),PCR扩增效率也在97.6%~107.0% (表1)。由此可见,候选内参基因的定量引物设计合理,可以用于相应基因的定量检测。
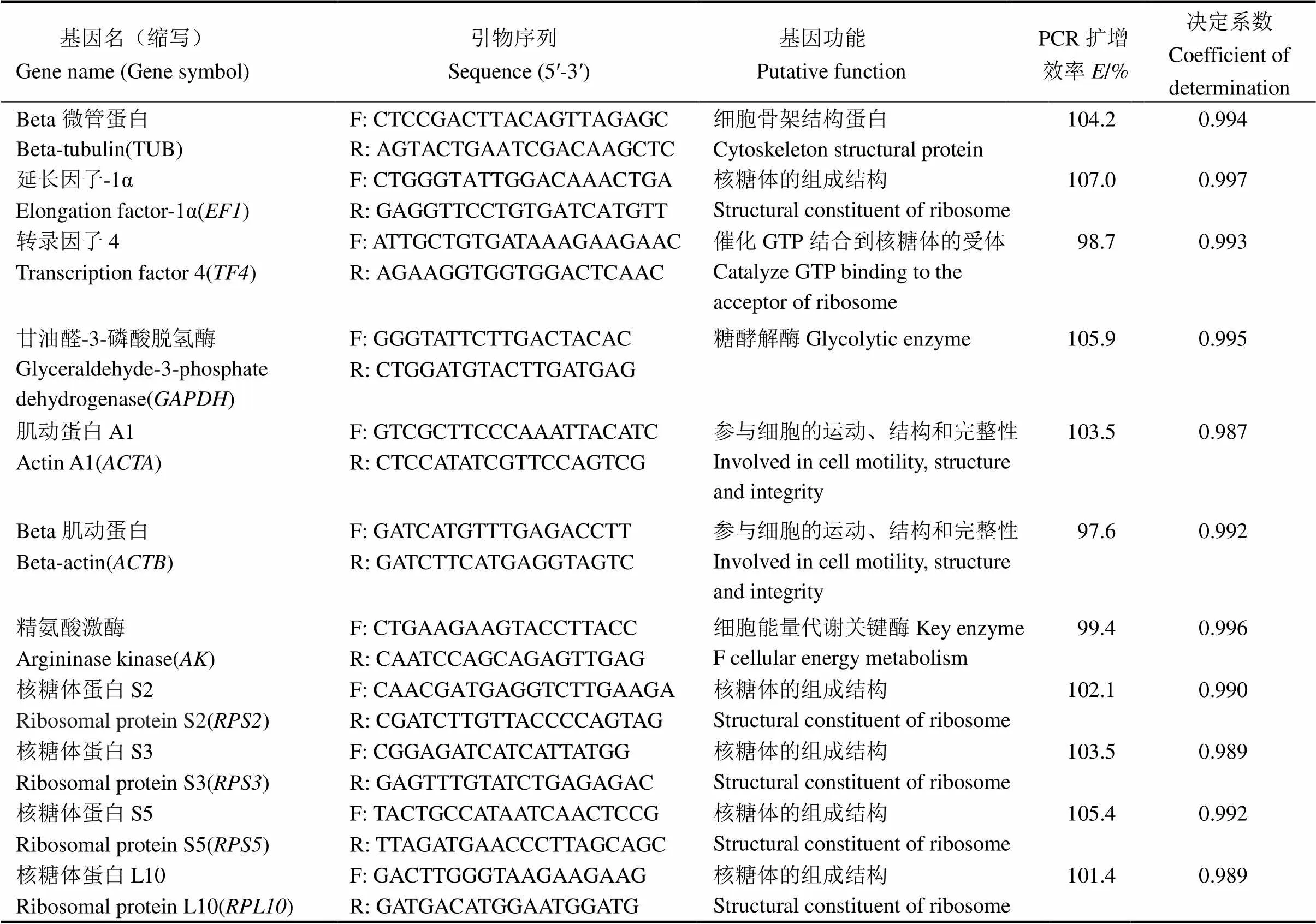
表1 备选基因的功能、引物序列和产物特性
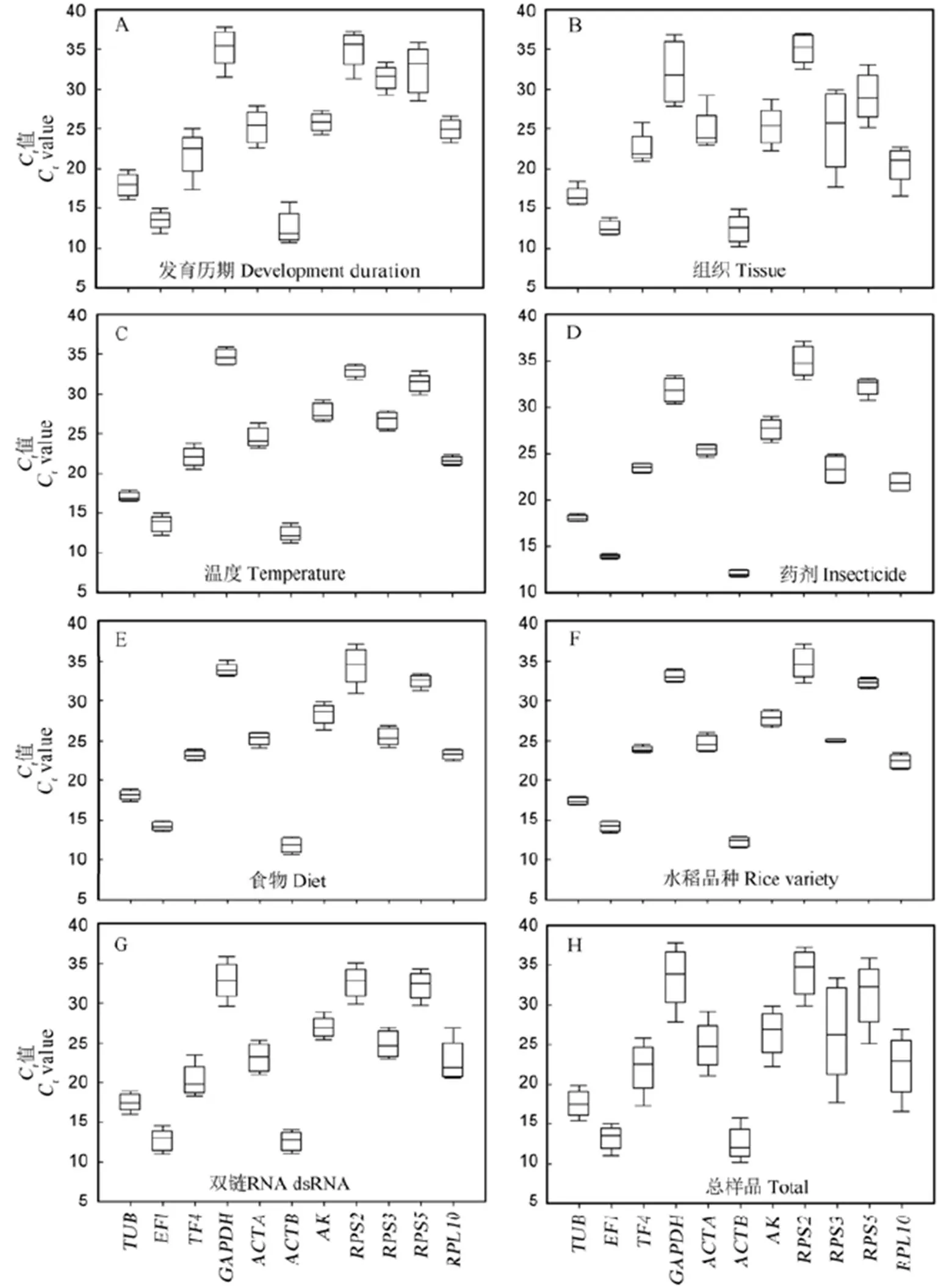
图1 候选内参基因的表达水平(Ct值)
Fig. 1. Expression levels of candidate reference genes (Cvalues).
2.2 候选内参基因的表达水平分析
检测了每个候选内参基因在不同条件下的C值,如不同发育历期(图1-A)、不同组织(图1-B)、不同温度处理(图1-C)、杀虫剂处理(图1-D)、喂食不同饲料(图1-E)、取食不同水稻(图1-F)和dsRNA处理(图1-G)。所有11个候选内参基因的C值中位数为12.08()~34.73()(图1-H)。其中的表达水平最高,C值为10.22~15.84,其他依次为(11.0~14.99)、(15.50~19.90)、(17.36~ 25.86)、(16.57~26.87)、(21.06~29.19)、(17.76~33.45)、(22.26~29.87)、(25.14~ 35.91)、(27.90 ~37.83)、(29.88~37.29)。在不同样品间的表达差异最大,而在不同样品间的表达差异最小(图1-H)。因此,没有一种内参基因在所有的试验条件下都稳定表达。
2.3 候选内参基因在不同发育历期的表达稳定性分析
在不同发育历期样品中,利用RefFinder、GeNorm和NormFinder分析均显示是稳定性最高的基因。BestKeeper和比较t值分析分别表明和是最稳定的基因(图2)。另外,5种分析方法均表明是最不稳定的内参基因(图2)。

Fig. 2. Comparison of the rankings in candidate reference genes expression stability in development durations of, across different tissues ofexposed to different temperatures or insecticides.
根据RefFinder分析,表达稳定性排名为、、、、、、、、、和(图2)。利用GeNorm软件判断配对变异值(V/V+1)来确定内参基因的最佳数目,即当V/V+1<0.15时,该条件下的内参基因最佳数目为个。GeNorm分析显示在不同发育历期中所有配对变异值均高于0.15(图2),说明通过V/V+1不能确定内参基因的最佳数目。此时,我们应选表达稳定性最高的3个基因作为最适内参基因。综合分析,在不同发育历期,表达最稳定的3个内参基因为、和(表2)。
2.4 候选内参基因在不同组织的表达稳定性分析
在不同组织,RefFinder、ΔC值和NormFinder分析表明是最稳定的内参基因,而BestKeeper和GeNorm分析显示是稳定性最高的(图2)。另外,5种分析方法均显示是最不稳定的内参基因(图2)。根据RefFinder分析,表达稳定性排名为、、、、、、、、和(图2)。GeNorm分析显示V/V+1均高于0.15(图2)。综合分析,在不同组织样品中,内参基因表达稳定性排名依次为、和(表2)。
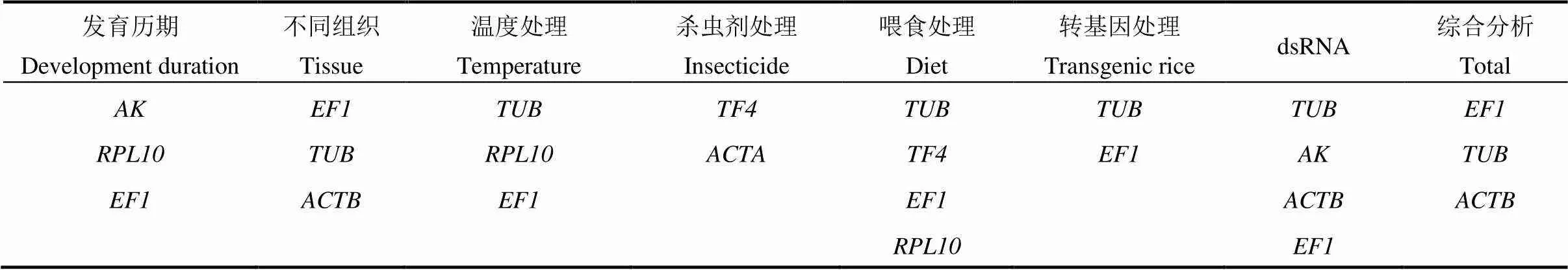
表2 不同实验条件下的理想内参基因
2.5 候选内参基因在不同温度处理下的表达稳定性分析
在不同温度处理下,RefFinder、ΔC值、GeNorm和NormFinder分析均表明是最稳定的内参基因,是最不稳定的,而BestKeeper分析显示是稳定性最高的,是最低的(图2)。根据RefFinder分析,稳定性排名为、、、、、、、、和(图2)。GeNorm分析显示4/5低于0.15(图4),因此,需要4个内参基因,然而的平均C值大于30,不适合作为不同温度处理条件下的内参基因(图1-C)。综合分析,在不同温度处理样品中,3个表达稳定的内参基因分别为、和(表2)。
2.6 候选内参基因在杀虫剂处理下的表达稳定性
分别利用氯虫苯甲酰胺、阿维菌素、甲氧虫酰肼处理二化螟3龄幼虫,RefFinder、ΔC值、GeNorm和NormFinder分析均表明是最稳定的内参基因,是最不稳定的,而BestKeeper分析显示的稳定性最高,最低(图2)。根据RefFinder分析,稳定性排名为、、、、、、、、和(图2)。GeNorm分析,2/3低于0.15(图4),表明需要2个内参基因。因此,在氯虫苯甲酰胺处理样品中,2个需要的内参基因为和(表2)。
2.7 候选内参基因在不同喂食处理下的表达稳定性分析
在取食人工饲料、水稻茎秆和茭白条件下,RefFinder和BestKeeper分析显示是最稳定的内参基因。ΔC值和NormFinder分析表明是稳定性最高的内参基因,GeNorm分析显示是最稳定的(图3)。另外,5种分析方法都显示是最不稳定的内参基因(图3)。RefFinder分析显示内参基因排名为、、、、、、、、和(图3)。GeNorm分析显示4/5低于0.15(图4),表明需要4个内参基因,它们分别是、、和(表2)。
2.8 候选内参基因在取食不同水稻品种下的表达稳定性分析
在取食两种不同品种水稻条件下,RefFinder、ΔC值和NormFinder分析显示是稳定性最高的内参基因。BestKeeper分析表明是最稳定的内参基因,GeNorm分析显示是最稳定的(图3)。5种分析方法均显示是最不稳定的内参基因(图3)。RefFinder分析表明内参基因排名为、、、、、、、、和(图3)。GeNorm分析显示2/3低于0.15(图4),表明需要2个内参基因,它们是和(表2)。
2.9 候选内参基因在dsRNA处理下的表达稳定性
在注射dsRNA处理的条件下,RefFinder、ΔC值、GeNorm和NormFinder分析均表明是最稳定的内参基因。BestKeeper分析显示是稳定性最高的(图3)。根据RefFinder分析,内参基因表达稳定性排名为、、、、、、、、和(图3)。根据GeNorm分析,9/10和10/11低于0.15(图4)。综合分析,4个最稳定的内参基因是、、和(表2)。
2.10 候选内参基因在所有供试样品中的表达稳定性分析
为选择可以通用的内参基因,将所有供试样品的qRT-PCR的原始数据放在一起进行评估。根据RefFinder、ΔC值和BestKeeper分析,二化螟中最稳定的内参基因是、和;根据GeNorm和NormFinder分析,、和是最稳定的。根据RefFinder综合分析,内参基因稳定性排名为、、、、、、、和(图3)。根据GeNorm分析,V/V+1均高于0.15(图4)。因此,在所有样品可以稳定使用的内参基因为和(表2)。

Fig. 3. Comparison of the rankings in candidate reference gene expression stability offed on different diets, reared on different rice varietiesunder dsRNA treatments or in all the tested samples of.
3 讨论
qRT-PCR是研究基因表达水平的重要技术,采用相对定量的方法对基因的表达量进行检测,即以内参基因作为标准,校准目的基因的表达量,具有灵敏度高、准确性好的特点,目前已成为研究基因表达中检测mRNA水平的标准技术[1,28]。为了保证基因表达分析的可靠性,内参基因应该在不同试验条件下稳定表达[6]。因此,筛选合适的内参基因是研究基因表达的关键。之前关于二化螟内参基因筛选的研究,对不同发育时期、不同组织和不同温度处理的样品中内参基因的稳定性进行了评估[20-21]。而本研究通过RefFinder、BestKeeper、GeNorm、NormFinder和ΔC值这5种分析方法,在不同发育时期、不同组织、不同温度、杀虫剂处理、取食不同饲料、取食不同水稻、dsRNA处理和所有的供试样品中评估合适的内参基因用于mRNA水平的表达分析。

图4 二化螟最优内参基因综合分析
Fig. 4. Determination of the optimal number of reference genes in
候选内参基因的稳定性分析,首先使用BestKeeper、GeNorm、NormFinder和t值依据相关参数分析各基因的稳定性,并对稳定性高低进行排序,然后进一步使用在线程序RefFinder给出候选内参基因的综合排名。研究结果表明在不同温度、取食不同饲料、取食不同品系水稻和dsRNA处理的二化螟样品中是最稳定的内参基因。在很多基因表达研究被作为内参基因[29-31],它属于真核生物结构基因家族,参与形成微管和骨架的基础组分,调控细胞分裂、形状、运动和胞内活动等[32]。在一些昆虫内参基因评价研究中,被认为是最稳定表达的内参基因,如在褐飞虱的不同地理种群[33]、白背飞虱不同发育时期和温度处理[34]、松墨天牛不同发育时期和不同组织[31]、蝙蝠蛾的微生物感染[17]和烟粉虱温度处理样品中[35]等。通过催化氨酰基转运RNA的依赖型GTP结合到核糖体的受体位点,在翻译过程中起着重要作用[36]。在很多研究中,被认为是合适的内参基因,如斜纹夜蛾的温度处理样品[8]、东亚飞蝗的不同发育历期[37]、西花蓟马的不同历期和温度处理[38]、大螟的不同组织和不同发育历期[15]和瓢虫的不同发育时期和温度处理[39]等。在本研究中,在二化螟不同组织和混合供试样品中,是最稳定的内参基因。在之前一些二化螟基因表达研究中[40-43],通常被用作内参基因,表现非常稳定。
本研究通过5种方法评估了内参基因的稳定性,ΔC值和NormFinder分析得到的结果在所有实验条件中都非常相似。因此,为了确定合适的内参基因数量,GeNorm分析被用来计算配对变异值(V/V+1);当配对变异值小于0.15,意味着不需要增加额外的内参基因来提高准确性[6]。本研究中,配对变异值在不同发育时期、不同组织和混合样品中,都高于0.15,意味着通过配对变异值不能确定内参基因的最佳数目,根据GeNorm使用手册,当配对变异值大于0.15时,可以根据配对变异值趋势选择2~3个最稳定的内参基因。因此,在这3种条件下需要选择3个表达稳定的内参基因最为合理,以获得更加准确可靠的结果。
本研究中,我们利用5种分析方法评估了、、、、、、、、和这11种候选内参基因在8种不同试验条件下的稳定性。在温度处理、取食不同饲料、取食不同品系水稻和dsRNA处理的二化螟样品中是最稳定的,在不同组织和混合样品中是第二稳定的。在不同组织和混合样品中是最稳定的,在取食不同品系水稻中是第二稳定的,在不同发育时期、温度处理和取食不同饲料中被认为是第三稳定的。另外,和在不同发育时期和杀虫剂处理的样品中分别是最稳定的内参基因。这些结果表明没有一个内参基因适用于任何试验条件,因此我们认为更多的内参基因需要在特定的试验条件下进行评估。本研究结果为不同试验条件下选择合适的内参基因提供了参考,也有利于在二化螟基因表达研究中获得更加可靠准确的数据。
[1] Bustin S A. Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays., 2000, 25: 169-193.
[2] Thellin O, Zorzi W, Lakaye B, De Borman B, Coumans B, Hennen G, Grisar T, Igout A, Heinen E. Housekeeping genes as internal standards: Use and limits., 1999, 75: 291-295.
[3] de Jonge H J, Fehrmann R S, de Bont E S, Hofstra R M, Gerbens F, Kamps W A, de Vries E G, van der Zee A G, te Meerman G J, ter Elst A. Evidence based selection of housekeeping genes., 2007, 2: e898.
[4] Gutierrez L, Mauriat M, Pelloux J, Bellini C, Van Wuytswinkel O. Towards a systematic validation of references in real-time RT-PCR., 2008, 20: 1734-1735.
[5] Huggett J, Dheda K, Bustin S, Zumla A. Real-time RT-PCR normalisation; strategies and considerations., 2005, 6: 279-284.
[6] Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes., 2002, 3: Research0034.
[7] 符伟, 谢文, 张卓, 吴青君, 王少丽, 张友军. Bt毒素诱导下小菜蛾实时定量PCR 内参基因的筛选. 昆虫学报, 2012, 55(12): 1406-1412.
Fu W, Xie W, Zhang Z, Wu Q J, Wang S L, Zhang Y J. Selection of valid reference genes for gene expression studies by quantitative real-time PCR in(Lepidoptera: Plutellidae) after exposure to Bt toxin., 2012, 55(12): 1406-1412. (in Chinese with English abstract)
[8] Lu Y H, Yuan M, Gao X W, Kang T H, Zhan S, Wan H, Li J H. Identification and validation of reference genes for gene expression analysis using quantitative PCR in(Lepidoptera: Noctuidae)., 2013, 8: e68059.
[9] Chandra GS, Asokan R, Manamohan M, Kumar N K, Sita T. Evaluation of reference genes for quantitative real-time PCR normalization in cotton bollworm,., 2014, 48: 927-938.
[10] Shakeel M, Zhu X, Kang T, Wan H, Li J. Selection and evaluation of reference genes for quantitative gene expression studies in cotton bollworm,(Lepidoptera: Noctuidae)., 2015, 18: 123-130.
[11] Zhang S D, An S H, Li Z, Wu F M, Yang Q P, Liu Y C, Cao J J, Zhang H J, Zhang Q W, Liu X X. Identification and validation of reference genes for normalization of gene expression analysis using qRT-PCR in(Lepidoptera: Noctuidae)., 2015, 555: 393-402.
[12] Zhu X, Yuan M, Shakeel M, Zhang Y J, Wang S L, Wang X, Zhan S, Kang T H, Li J H. Selection and evaluation of reference genes for expression analysis using qRT-PCR in the beet armyworm(Hubner) (Lepidoptera: Noctuidae)., 2014, 9: e84730.
[13] Arun A, Baumle V, Amelot G, Nieberding C M. Selection and validation of reference genes for qRT-PCR expression analysis of candidate genes involved in olfactory communication in the butterfly., 2015, 10: e0120401.
[14] Lu Y H, Zheng X S, Liang Q, Xu H X, Yang Y J, Tian J C, He X C, Lu Z X. Evaluation and validation of reference genes for SYBR Green qRT-PCR normalization in(Lepidoptera: Noctuidae)., 2015, 18: 669-675.
[15] Sun M, Lu M X, Tang X T, Du Y Z. Exploring valid reference genes for quantitative real-time PCR analysis in(Lepidoptera: Noctuidae)., 2015, 10: e0115979.
[16] Pan H P, Yang X W, Bidne K, Hellmich R L, Siegfried B D, Zhou X G. Selection of reference genes for RT-qPCR analysis in the monarch butterfly,(L.), a migrating bio-Indicator., 2015, 10: e0129482.
[17] Liu G Q, Qiu X H, Cao L, Zhang Y, Zhan Z B, Han R C. Evaluation of reference genes for reverse transcription quantitative PCR studies of physiological responses in the ghost moth,(Lepidoptera, Hepialidae)., 2016, 11: e0159060.
[18] Zhang L, Zhang Q L, Wang X T, Yang X Z, Li X P, Yuan M L. Selection of reference genes for qRT-PCR and expression analysis of high-altitude-related genes in grassland caterpillars (Lepidoptera: Erebidae: Gynaephora) along an altitude gradient., 2017, 7: 9054-9065.
[19] 杨苓, 胡晓静, 徐志峰, 何林, 肖伟. 桃蛀螟实时荧光定量PCR内参基因的筛选. 昆虫学报, 2017, 60(11): 1266-1277.
Yang L, Hu X J, Xu Z F, He L, Xiao W. Screening of reference genes for qRT-PCR in(Lepidoptera: Crambidae)., 2017, 60(11): 1266-1277. (in Chinese with English abstract)
[20] Teng X L, Zhang Z, He G L, Yang L W, Li F. Validation of reference genes for quantitative expression analysis by real-time RT-PCR in four lepidopteran insects., 2011, 12: 60.
[21] Xu J, Lu M X, Cui Y D, Du Y Z. Selection and evaluation of reference genes for expression analysis using qRT-PCR in(Lepidoptera: Pyralidae)., 2017, 110: 683-691.
[22] 胡阳, 郑永利, 曹国连, 傅强. 利用半人工饲料大规模简便化饲养二化螟中国水稻科学, 2013,27(5): 535-538. Hu Y, Zheng Y L, Cao G L, Fu Q. A technique for rearingin the large scale with an oligidic diet in laboratory., 2013, 27(5): 535-538. (in Chinese with English abstract)
[23] 吴敏, 张真真, 高聪芬. 水稻二化螟抗药性监测方法. 应用昆虫学报, 2013, 50(2): 548-552.
Wu M, Zhang Z Z, Gao C F. Methods of insecticides resistance monitoring of the striped stem borer, Chilo suppressalis., 2013, 50(2):548-552. (in Chinese with English abstract)
[24] Hui X M, Yang W, He G L, Yang Q P, Han Z, Li F. RNA interference ofandinreveals their different contributions to motor ability and larval growth., 2011, 4: 507-518.
[25] Pfaffl M W, Tichopad A, Prgomet C, Neuvians T P. Determination of stable housekeeping genes, differentially regulated target genes and sample integrity. BestKeeper: Excel-based tool using pair-wise correlations., 2004, 26: 509-515.
[26] Andersen C L, Jensen J L, Orntoft T F. Normalization of real-time quantitative reverse transcription-PCR data: A model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets., 2004, 64: 5245-5250.
[27] Schmittgen T D, Livak K J. Analyzing real-time PCR data by the comparative CT method., 2008, 3: 1101-1108.
[28] Radonic A, Thulke S, Mackay I M, Landt O, Siegert W, Nitsche A. Guideline to reference gene selection for quantitative real-time PCR., 2004, 313: 856-862.
[29] Huis R, Hawkins S, Neutelings G. Selection of reference genes for quantitative gene expression normalization in flax (L.)., 2010, 10: 71.
[30] Kozera B, Rapacz M. Reference genes in real-time PCR., 2013, 54: 391-406.
[31] 冯波, 郭前爽, 毛必鹏, 杜永均. 松墨天牛化学感受组织荧光定量PCR内参基因的鉴定与筛选. 昆虫学报, 2016, 59(4): 427-437.
Feng B, Guo Q, Mao B P, Du Y J. Identification and selection of valid reference genes for assaying gene expression in the chemosensory tissues of(Coleoptera: Cerambycidae) by RT-PCR., 2016, 59(4): 427-437. (in Chinese with English abstract)
[32] Nielsen M G, Gadagkar S R, Gutzwiller L. Tubulin evolution in insects: Gene duplication and subfunction- alization provide specialized isoforms in a functionally constrained gene family., 2010, 10: 113.
[33] Yuan M, Lu Y H, Zhu X, Wan H, Shakeel M, Zhan S, Jin B R, Li J H. Selection and evaluation of potential reference genes for gene expression analysis in the brown planthopper,(Hemiptera: Delphacidae) using reverse-transcription quantitative PCR., 2014, 9: e86503.
[34] An X K, Hou M L, Liu Y D. Reference gene selection and evaluation for gene expression studies using qRT-PCR in the white-backed planthopper, Sogatella furcifera (Hemiptera: Delphacidae)., 2016, 109: 879-886.
[35] Dai T M, Lu Z C, Liu W X, Wan F H. Selection and validation of reference genes for qRT-PCR analysis during biological invasions: The thermal adaptability ofMED., 2017, 12: e0173821.
[36] Ponton F, Chapuis M P, Pernice M, Sword GA, Simpson S J. Evaluation of potential reference genes for reverse transcription-qPCR studies of physiological responses in Drosophila melanogaster., 2011, 57: 840-850.
[37] Yang Q P, Li Z, Cao J J, Zhang S D, Zhang H J, Wu X Y, Zhang Q W, Liu X X. Selection and assessment of reference genes for quantitative PCR normalization in migratory locust Locusta migratoria (Orthoptera: Acrididae)., 2014, 9: e98164.
[38] Zheng Y T, Li H B, Lu M X, Du Y Z. Evaluation and validation of reference genes for qRT-PCR normalization in(Thysanoptera: Thripidae)., 2014, 9: e111369.
[39] Pan H P, Yang X W, Siegfried B D, Zhou X G. A comprehensive selection of reference genes for RT-qPCR analysis in a predatory lady beetle,(Coleoptera: Coccinellidae)., 2015, 10: e0125868.
[40] Qiu L, Wang P, Wu T, Li B, Wang X, Lei C, Lin Y, Zhao J, Ma W. Downregulation ofalkaline phosphatase genes associated with resistance to three transgenicrice lines., 2018, 27: 83-89.
[41] Xu G, Gu G X, Teng Z W, Wu S F, Huang J, Song Q S, Ye G Y, Fang Q. Identification and expression profiles of neuropeptides and their G protein-coupled receptors in the rice stem borer., 2016, 6: 28976.
[42] Xu G, Wu S F, Teng Z W, Yao H W, Fang Q, Huang J, Ye G Y. Molecular characterization and expression profiles of nicotinic acetylcholine receptors in the rice striped stem borer,(Lepidoptera: Crambidae)., 2017, 24: 371-384.
[43] Xu G, Wu S F, Wu Y S, Gu G X, Fang Q, Ye G Y. De novo assembly and characterization of central nervous system transcriptome reveals neurotransmitter signaling systems in the rice striped stem borer,., 2015, 16: 525.
Screening Reference Genes and Evaluating of Their Expression Stability for qRT-PCR Normalization in(Lepidoptera: Pyralididae)
XU Hongxing1, WANG Guorong2, LU Yanhui1,*, YANG Yajun1, ZHENG Xusong1, TIAN Junce1, LÜ Zhongxian1,*
(Key Laboratory of Information Traceability for Agricultural Products, Ministry of Agriculture, P. R. of China/Key Laboratory Breeding Base for Zhejiang Sustainable Pest and Disease Control, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China;Xiaoshan Agricultural Technology Extension Center,,;Corresponding author,
【Objective】We aim to screen reference genes stably expressed in striped stem borers (SSB),,under certain conditions, to lay a foundation for the study on the gene expression in SSB【Method】According to the results of SSB transcriptome data, 11 candidate genes from SSB were selected and their expression stability was detected under different treatmentconditions (including development duration, tissues, feeding on different diets and rice varieties, dsRNA and mixed samples under temperature stress, insecticide treatment), by using real-time fluorescence quantitative PCR. The stability of the 11 candidate genes was evaluated by RefFinder, BestKeeper, GeNorm, NormFinder andΔC. 【Result】,andwere highly stable in different development durations;,andwere highly stable in different tissues.,andwere relatively stable under temperature stress.andwere stable in insecticide treated samples.,,andwere stable in samples fed on different diets.andwere stable reference genes in samples fed on different rice varieties.,,andwere stable in the sample treated with dsRNA.,andwere stable in mixed samples. 【Conclusion】It provide a reference for selection of suitable reference gene under different test conditions, and also provide more reliable and accurate data for research in gene expression in riceSSB.
; reference gene; qRT-PCR; gene expression
10.16819/j.1001-7216.2019.8035
Q755; S435.112+.1
A
1001-7216(2019)01-0075-10
2018-03-27;
2018-05-15。
国家自然科学基金资助项目(31672050);浙江省植物有害生物防控省部共建国家重点实验室培育基地自主设计项目(2010DS700124- ZZ1601)。
