邻苯二甲酸酯类污染物雌激素结合活性筛查
2019-01-23张晓聪张冬生刘兰华周小红刘春陆韻施汉昌
张晓聪 张冬生 刘兰华 周小红 刘春 陆韻 施汉昌
(1. 清华大学环境学院 环境模拟与污染控制国家重点实验室,北京 100084;2. 河北科技大学环境科学与工程学院,石家庄 050018;3. 河北省食品检验研究院,石家庄 050200)
邻苯二甲酸酯具有内分泌干扰特性,高浓度暴露可诱导胎儿死亡、癌症、畸形、肝脏和肾脏损伤及动物的生殖毒性[1]。邻苯二甲酸酯是一组合成的工业化学品,于20世纪20年代引入。自1933年首次合成邻苯二甲酸二(2-乙基己基)酯(Di-(2-ethylhexyl)Phthalate,DEHP)以来,邻苯二甲酸酯已成为最普遍的增塑剂[2]。各种邻苯二甲酸酯的用途主要取决于它们的分子量,高分子量DEHP主要用作制造柔性乙烯塑料的增塑剂,而塑料则用于消费品,地板和墙面覆盖物,食品接触应用和医疗设备[3-4]。低分子量邻苯二甲酸酯如邻苯二甲酸二乙酯(Diethyl phthalate,DEP)和邻苯二甲酸二丁酯(Dibutyl phthalate,DBP)可用作溶剂、化妆品、杀虫剂和药物等[5]。这些常用的邻苯二甲酸酯(Phthalic acid esters,PAEs)可通过食品及饮料容器浸入食品并通过直接接触或空气接触等被人体摄取。美国环保署已经发布了129份重点污染物名单,其中包含6种邻苯二甲酸酯:邻苯二甲酸二甲酯(Dimethyl phthalate,DMP)、DEHP、DEP、邻苯二甲酸二辛酯(Dioctyl phthalate,DOP)、邻苯二甲酸丁苄酯(Butyl benzyl phthalate,BBP)、DBP。中国环境优先污染物清单也包括3种邻苯二甲酸酯:DMP、DBP、DOP。尽管大量研究表明少量邻苯二甲酸酯显示出极弱的雌激素活性[6-7],但人体长期暴露在高浓度的具有雌激素活性的邻苯二甲酸酯类环境中,可能对其产生生殖毒性。另外,关于可靠鉴定邻苯二甲酸酯雌激素活性的标准和方法仍存在争议。因此,发展相关检测技术和方法具有重要的现实需求。
PAEs的检测方法主要有仪器分析法和生物检测法。仪器检测方法包括气相色谱-质谱联用技术[8]、液相色谱-质谱联用技术[9]和高效液相色谱与荧光检测器联用[10]等。这些大型仪器分析技术虽然具有精度高、重现性好等优势,但也存在价格昂贵、样品前处理过程复杂和检测周期较长等不足之处,而生物检测法有受体作用理论法[11]、酵母双杂交技术[12]和发光细菌法[13]等,具有灵敏度高、成本低、实验周期相对短及伦理道德上可接受等优点。本实验以课题组发展的倏逝波光纤生物传感器平台,以PAEs污染物为靶标,优化基于受体作用理论的雌激素结合活性筛查生物传感分析方法,考察典型的PAEs的雌激素结合活性。
本课题研发的倏逝波光纤荧光生物传感器系统主要包括3部分:光学元件、流动进样系统、控制及信号处理系统(图1-A),具体详见Lin等[14]的研究,在此不再赘述。

图1 倏逝波光纤荧光传感器系统(A)和基于受体作用理论的雌激素筛查原理(B)
基于受体作用理论雌激素结合活性筛查原理如图1-B所示。首先,将17β-雌二醇(E2)固定在光纤传感界面上,再将外源雌激素化合物与一定量E2竞争结合受体亲和柱(受体蛋白通过6×His标签与亲和柱(Ni-NTA-Sefinose Column)上的Ni通过配位结合得到受体亲和柱)上的雌激素受体(Estrogen receptor,ER),剩余未结合的游离态E2通过离心分离后,与荧光标记E2抗体结合。剩余游离荧光标记E2抗体与传感界面上固定的E2-BSA结合,在倏逝场激发下产生荧光,荧光强度与外源化合物的雌激素结合活性呈负相关,由此可以定性考察化合物的雌激素结合活性大小。
1 材料与方法
1.1 材料
能够表达人雌激素受体蛋白α配体结合域(ERLBD)的重组大肠杆菌由清华大学陆韻课题组提供;酵母提取物(Sigma,美国);蛋白胨(Sigma,美国);琼脂粉(Sigma,美国);氯化钠(Sigma,美国);异丙基硫代半乳糖苷(Sigma,美国);卡那霉素(Sigma,美国);蛋白质Marker(TaKaRa,大连);磷酸(H3PO4,国药集团,北京);甲醇(国药集团,北京);1.5 mol/L Tris-HCl pH 8.8(Solarbio,北京),1 mol/L Tris-HCl pH 6.8(Solarbio,北京),冰醋酸(CH3COOH,国药集团,北京);咪唑(国药集团,北京);17β-雌二醇(E2,Sigma),邻苯二甲酸二丁酯(DBP),邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二异戊酯(Di-iso-amyl phthalate,DIPP)、邻苯二甲酸二(2-乙基己基)酯(DEHP)、邻苯二甲酸丁苄酯(BBP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二辛酯(DOP),二甲亚砜(DMSO,Sigma),3-巯基丙基三甲氧基硅烷(MTS,Sigma),牛血清白蛋白(BSA,Sigma),十二烷基硫酸钠(SDS,国药集团),N-琥珀酰亚胺基-4-马来酰亚胺-丁酸酯(GMBS,Sigma),E2-BSA和抗E2单克隆抗体购于北京勤邦生物技术有限公司,10 mmol/L PBS(pH 7.4)和超纯水为实验室自制。
1.2 方法
1.2.1 重组雌激素受体蛋白亲和柱的制备 首先将冻存的菌体充分分散,再用低温高压细胞破碎仪进行细胞破壁,将破壁后的菌液于4℃,14 000 r/min转速条件下离心45 min,收集上清蛋白提取液备用;以菌液与亲合柱的比例为500:1来量取出所需亲和柱的体积,清洗亲和柱,随后将蛋白提取液加入至预处理后的亲和柱中,于4℃冰箱中混合孵育2 h;反应后的受体蛋白亲和柱于4℃,3 000 r/min转速下水平离心2 min,弃去上清液,用Tris-HCl缓冲液和咪唑溶液等配制的平衡液清洗3次,最终得到纯度较高的雌激素受体蛋白亲和柱。
1.2.2 光纤敏感层修饰 将传感光纤浸入新配置的Piranha溶液中,置于烘箱中70℃加热60 min,使传感光纤表面富含羟基基团,之后用去离子水充分清洗,氮气吹干;将洁净的羟基化光纤浸泡于硅烷化剂溶液,置于通风橱中室温静置反应2 h,用甲苯清洗数次,氮气吹干;把光纤置于1 mL的玻璃管中,加入偶联剂溶液,静置反应1 h;配制合适浓度的包被抗原,将光线浸入包被抗原中,4℃下反应过夜。过夜反应后,用去离子水清洗数次,将表面固定包被抗原的光纤浸泡于封闭液中,室温静置反应1 h,封闭未反应的偶联剂;最后,将光纤末端漆黑,静置晾干后置于4℃冰箱保存。
1.2.3 数据分析方法 对受体竞争检测模式来说,在半对数坐标系中标准曲线呈反S型,本研究采用4参数Logistic模型进行模拟,其公式为:

其中,x为待测标准溶液的浓度,为自变量;y为有效信号值;A1为曲线上渐近线(x→0)对应的信号值;A2为曲线下渐近线(x→∞)对应的信号值;x0为曲线的拐点;P为曲线在拐点处的斜率。该模型定义最大信号值(A1)的80%-20%对应的待测物浓度区间为定量检测区间,最大信号值的90%对应的待测物浓度为检出限。
2 结果
2.1 雌激素受体活性测试
为了验证所制备的雌激素受体亲和柱的活性,对加热变性前后传感器得到的检测信号值进行分析,结果如图2所示。

图2 ER活性测试
以1 μg/mL荧光标记的E2抗体在传感界面产生的信号为原始信号(柱1,100%),1 μg/mL荧光标记的E2抗体与1 μg/L E2标准液进行反应之后,剩余未结合E2的抗体结合在传感界面上所产生的信号下降到原始信号的43%(柱2)。将1 μg/L E2标准液先与17.5 μg ER进行结合之后,上清液中未与ER结合的E2再与1 μg/mL荧光标记的E2抗体进行反应,未结合E2的抗体在传感界面表面上所产生的信号为原始信号的98%(柱3)。将1 μg/L E2标准液先与17.5 μg 95℃热变性之后的ER进行结合之后,上清液中未与ER结合的E2再与1 μg/mL荧光标记的E2抗体进行反应,未结合E2的抗体结合在传感界面表面上所产生的信号为原始信号的49%(柱4)。
2.2 雌激素受体蛋白亲和柱保存稳定性测试
按照1.2方法制备得到的雌激素受体蛋白亲和柱于 -80℃中分别保存 1、2、4、7、10、14、30、60、和90 d后取出,考察保存不同保存天数后受体蛋白的活性,测试结果如图3所示。

图3 ER亲和柱长期保存活性测试
2.3 甲醇试剂对检测结果的影响
用浓度为0.01%、0.1%、1%、10%和50%甲醇溶液配制1 μg/mL E2溶液与ER反应后,取上清液进行测定,结果如图4所示。甲醇浓度在0.01%-10%范围时,相对信号值接近100%;当甲醇浓度为50%时,相对信号值下降到58%。

图4 甲醇对检测结果的影响
2.4 邻苯二甲酸酯雌激素活性测试
在优化条件下,检测7种邻苯二甲酸酯DMP、DEHP、DEP、DOP、BBP、DBP和DIPP的雌激素结合活性,结果如图5所示。PAEs浓度在1-103范围之间时,其检测信号基本保持一致;当浓度为104时,BBP的相对荧光信号值为0.85,其他PAEs相对荧光信号较高;当浓度为105时,BBP、DBP和DIPP的相对荧光信号值分别为0.71、0.76和0.83,其他PAE信号值接近1。
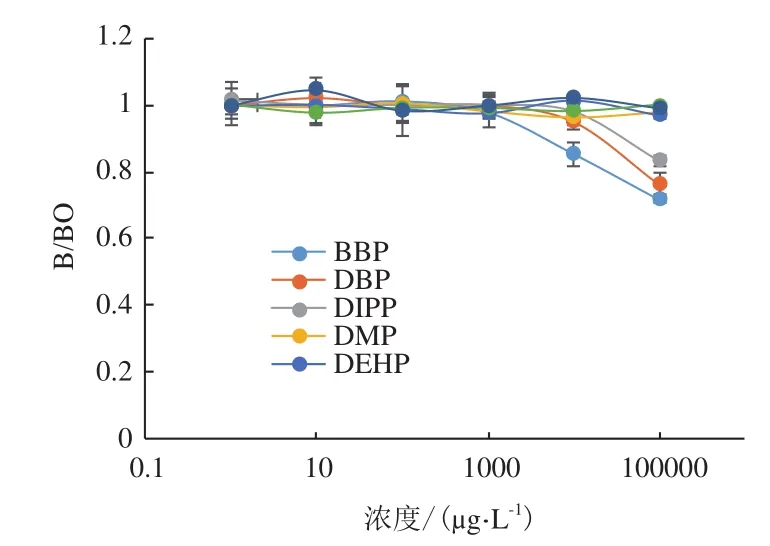
图5 邻苯二甲酸酯类雌激素活性测
3 讨论
3.1 检测条件的优化
ER活性测试结果显示,柱1表示原始信号值100%,柱2是E2与E2抗体反应后所测的信号只有43%,说明它们之间可以发生免疫反应;柱3的信号值为98%,说明ER可以完全与1 μg/L 的E2结合,而使上清液中没有游离E2存在,因此荧光信号几乎恢复到原始信号值大小;柱4为原始信号值的49%,说明ER完全失活,不能与E2进行结合,同时也证明Ni亲和柱不会对E2产生非特异性吸附,因此上清液中E2的浓度与反应前几乎没有变化,荧光信号值与不加ER的信号值相当。表明ER亲和柱具有很好的E2结合活性。在雌激素受体蛋白亲和柱保存稳定性测试中,结果所示,保存3个月之后的检测信号与初始信号相比几乎没有变化,说明本研究所采用的受体蛋白保存方法能长期保持ER亲和柱活性。甲醇浓度对测试结果的干扰表明,当甲醇浓度低于10%时,溶液用的甲醇不会影响到整个反应体系,当甲醇浓度高于10%时,信号开始下降。甲醇含量为50%,传感器测得的信号降至原始信号的58%,可能原因是高浓度的甲醇导致受体蛋白变性,不能结合E2,而使反应后上清液中游离态的E2含量增加,导致传感信号下降。因此,在后续的实验体系中,保证甲醇的含量不高于10%。
3.2 邻苯二甲酸酯的雌激素活性
本研究所选的PAEs化合物常作为增塑剂,而大部分增塑剂是有机酸的二酯或三酯,它们可以从塑料中缓慢释放;并且已被证明暴露于体内体外能够诱导雌激素效应[6]。在优化条件下,对这7种PAEs进行雌激素活性测试,向体系中加入等体积的PAEs和ER,其对应的雌激素活性响应信号曲线表明,在相同浓度下,雌激素结合活性越强,荧光信号越弱。根据这一规律分析,BBP、DBP和DIPP有一定的雌激素活性,其活性顺序为BBP > DBP >DIPP,这一结果与已有的研究结果一致[7],而另外4种物质的雌激素结合活性很低,基本可以忽略。
4 结论
本研究所制备的ER亲和柱具有很好的E2结合活性,所采用的受体蛋白保存方法能长期保持ER亲和柱活性。检测中优化的甲醇浓度为10%。在选取的7种物质中,DMP、DEHP、DEP和DOP的雌激素活性很低,基本可以忽略,而BBP、DBP和DIPP有一定的雌激素活性,其活性顺序为BBP >DBP > DIPP,与酵母双杂交方法所测实验结果和以往研究结论一致,证明本研究使用的基于受体作用理论的倏逝波生物传感分析技术能够作为一种筛查PAEs雌激素活性的有效方法。
