草鱼幼鱼肝胰脏抗氧化系统对MC-LR胁迫的响应
2019-01-23隗黎丽阮记明付建平钟其旺
隗黎丽,何 丽,阮记明,刘 毅,付建平,钟其旺
(1.江西农业大学动物科学技术学院,南昌 330045;2.江西师范大学生命学院,南昌 330022;3.江西农业大学生物科学与工程学院,南昌 330045)
在自然环境因子和人类活动的双重影响下,水体的富营养化问题日趋严重,现已经成为全球水生态系统中所面临的主要环境问题之一[1]。富营养化水体可导致蓝藻水华的暴发,一些有毒蓝藻细胞破裂后可向水体释放藻毒素。在已发现的藻毒素中,由铜绿微囊藻(Microcysis aeruginosa)等产生的微囊藻毒素(Mi⁃crocystins,MCs)是出现频率最高、产生量最大、危害最严重的一类藻毒素[2],其中,微囊藻毒素-LR(MCLR)是目前已知的毒性最强、研究最多的一种MCs。已有的研究表明MC-LR的致毒机理与抑制丝氨酸/苏氨酸磷酸酶1(PP1)和2A(PP2A)有关[3-5]。除此之外,自从上世纪90年代有学者报道MCs可诱导细胞产生氧化损伤以来[6],大量的研究报道表明氧化应激也是MCs的致毒机制之一[7-10],但是MCs如何诱导机体产生氧化应激仍然没有完全弄清楚[11]。
生物体内的抗氧化防御系统是抵御污染胁迫的第一道屏障,抗氧化因子中的活性成分如超氧化物歧化酶(Superoxide dismutase,SOD),过氧化氢酶(Cata⁃lase,CAT),谷胱甘肽过氧化物酶(Glutathione peroxi⁃dase,GPx)和谷胱甘肽还原酶(Glutathione reductase,GR)等可随污染物胁迫而做出迅速响应[12]。生物体内的这些抗氧化因子在清除氧自由基和过氧化氢、遏制或减少羟自由基形成、保护机体免受自由基损害等方面具有关键作用。目前,国内外针对MC-LR对鱼类抗氧化酶活性和抗氧化酶基因表达的影响等方面开展了较多的研究,例如,杨静东等[13]监测了不同时间鲥鱼抗氧化酶活性的变化,发现SOD、CAT、GST和GR活性与组织中MCs的含量呈正相关;任平等[14]比较了不同浓度MC-LR对斑马鱼(Danio rerio)卵巢抗氧化酶的影响,发现卵巢中丙二醛(MDA)含量和谷胱甘肽还原酶(GR)活性在不同浓度处理组中均发生显著下降,谷胱甘肽过氧化物酶(GPx)活性和GR酶活性随着水体毒素浓度的增加而显著下降;Hou等[9]研究发现斑马鱼中SOD、CAT、GST、GPx和GSH酶活性以及基因表达变化与MC-LR剂量相关。草鱼(Ctenopharygodon idella)作为淡水养殖的主要养殖品种,尤其是在池塘集约化养殖的情况下,池塘水体极易被MCs污染,如淮河流域池塘水体MCs浓度达到了3.69 μg·L-1[15],超过了世界卫生组织(WHO)规定饮用水中MC-LR含量的安全指导值(1.0 μg·L-1)[16]。但现在还未见有关草鱼幼鱼抗氧化系统对MC-LR胁迫响应的报道,因此,本文将以淡水养殖常见品种——草鱼作为研究对象,从抗氧化酶活性和基因表达变化来评价MC-LR对草鱼幼鱼肝胰脏氧化胁迫的响应。
1 材料与方法
1.1 材料与试剂
实验用草鱼为当年孵化繁殖的幼鱼,平均体重为22.13±2.17 g,购自江西省南昌神龙渔业公司养殖基地。实验用MC-LR(纯度≥95%),购自Taiwan Algal Science Inc公司,间氨基苯甲酸乙酯甲烷磺酸盐(MS-222)为Sigma公司产品,RNA提取试剂盒TRIzol reagent购自Invitrogen公司,逆转录试剂盒Re⁃vertAidTMFirst Strand cDNA Synthesis Kit和SYBR Green Real-time PCR Master Mix购自Promega公司,酶活性测定试剂盒购于南京建成生物有限公司。
1.2 实验鱼的处理及取样
从养殖场购买的实验草鱼幼鱼在实验室暂养2周,暂养期间每日按照鱼体质量的2.0%投喂商品饲料,试验前48 h停止投喂并将草鱼随机分为实验组和对照组,每组设置3个重复。在先前的研究基础上,实验组草鱼注射剂量设为25μg MC-LR·kg-1(低剂量)和100μg MC-LR·kg-1(高剂量)。对草鱼进行染毒前,根据说明书用甲醇将MC-LR粉末溶解成1 μg·μL-1的储备液,注射前用0.8%生理盐水稀释成所需浓度,每尾鱼注射0.1 mL MC-LR溶液,对照组每尾草鱼则注射等量的0.8%的生理盐水,具体操作方法详见参考文献[17]。各实验组和对照组草鱼分别在处理24、48 h和72 h后各取6尾鱼,使用MS-222麻醉后,用纱布擦干鱼体表面,先迅速分离50 mg左右肝胰脏,置于无RNA酶活性的离心管作为提取RNA的样品,随后分离剩余的肝胰脏放入冰冷的PBS(0.01 mol·L-1,pH 7.2)中漂洗两次除去血液,滤纸擦干后称重,放入离心管中,用眼科剪刀快速剪碎组织,整个操作在冰水浴中进行。随后将样品置于液氮中保存备用。
1.3 酶活性的测定分析
将液氮中保存的作为酶活性分析的肝胰脏样品按质量(g)∶体积(mL)=1∶9的比例加入9倍体积的生理盐水,冰水浴条件下匀浆,2500 r·min-1,离心10 min,收集上清液测定酶活性。SOD和CAT活性的测定的具体操作步骤均根据南京建成生物工程研究所提供的试剂盒说明书进行,SOD活性采用黄嘌呤氧化酶法测定,在波长为550 nm处比色测定吸光度值计算其活力,活力单位定义为每毫克组织蛋白在反应液中SOD抑制率达到50%时所对应的SOD量为1个SOD活力单位(U·mg-1prot)。CAT活性通过405 nm波长下测定H2O2减少的量测定,活力单位定义为每毫克组织蛋白每秒钟分解1 μmol的H2O2的量作为1个CAT活力单位(U·mg-1prot)。蛋白含量采用考马斯亮蓝法,以南京建成生物工程研究所提供的试剂盒中蛋白标准液为标准蛋白,同样按照试剂盒说明书进行测定。
1.4 核酸的提取、cDNA模板的合成及qRT-PCR检测分析
采用Invitrogen公司的Trizol试剂盒提取总RNA,具体提取方法参考试剂盒的说明书进行。cDNA按RevertAidTMFirst Strand cDNA Synthesis Kit操作手册进行合成。Real-time quantitative PCR(qRT-PCR)反应在伯乐公司CFX96 TouchTMReal-time PCR Detec⁃tion System上完成。反应所有引物见表1,其中引物参考了文献[18]。反应体系根据Promega公司的SYBR Green Real-time PCR Master Mix的说明配制,共20 μL,反应条件:94 ℃变性5 min,94 ℃ 10 s,58 ℃15 s,72 ℃ 20 s,45个循环,72℃延伸5 min。荧光定量PCR的数据采用2-△△CT法进行计算。
1.5 数据分析
实验数据均以平均值±标准差表示,采用多因素方差分析进行统计学检验(SPSS 16.0),统计学显著性水平设定P<0.05表示差异显著。
2 结果与分析
2.1 MC-LR对草鱼幼鱼肝胰脏抗氧化酶活性的影响
多因素方差分析结果表明,不同MC-LR诱导时间(24、48 h和72 h)对SOD酶活性有显著影响(F=8.161,P=0.001),不同的诱导剂量对其活性也有显著影响(F=5.053,P=0.010),作用时间和诱导剂量之间有交互作用(F=3.397,P=0.016)。由图1A可知,低剂量组草鱼幼鱼肝胰脏SOD活性在3个时间段变化均不明显,无统计学意义(P>0.05)。高剂量组草鱼幼鱼肝胰脏SOD活性在24 h和48 h均显著上升(P<0.05),且在 24 h后达到高峰,为778.97 U·mg-1prot,随后下降,在72h的活性下降为252.29 U·mg-1prot,差异不显著(P>0.05)。
对CAT活性进行多因素方差分析表明,MC-LR诱导不同时间后对CAT酶活性有显著影响(F=19.642,P<0.001),不同的诱导剂量对其活性影响无显著差异(F=0.925,P=0.404),作用时间和诱导剂量之间有交互作用(F=5.607,P=0.001)。由图1B可知,在24 h,高剂量组肝胰脏中CAT活性在24 h升高,达到43.99 U·mg-1prot,与对照组相比差异显著(P<0.05),随后活性下降;而低剂量组肝胰脏中CAT活性在24 h增强,但与对照组相比差异不显著(P>0.05)。然而,低剂量组和高剂量组肝胰脏CAT活性在48 h和72 h均下降,但与对照组相比差异均不显著(P>0.05)。
2.2 MC-LR对草鱼幼鱼肝胰脏抗氧化基因的影响
采用qRT-PCR检测了MC-LR胁迫下草鱼幼鱼肝胰脏SOD、CAT、GPx和GR基因表达量的变化(图2)。多因素方差分析统计结果表明,MC-LR诱导不同时间(24、48 h和72 h)对SOD基因有显著影响(F=6.341,P=0.004),不同的诱导剂量对其表达也有显著影响(F=1.086E3,P=0.000),但作用时间和诱导剂量之间无交互作用(F=1.314,P=0.279)。LSD分析结果表明,经不同剂量MC-LR胁迫不同时间后,SOD基因的表达量与对照组相比均显著下降(P<0.05),且低剂量组和高剂量组中肝胰脏SOD随着时间的延长,表达量呈现逐渐下降的趋势(图2A)。
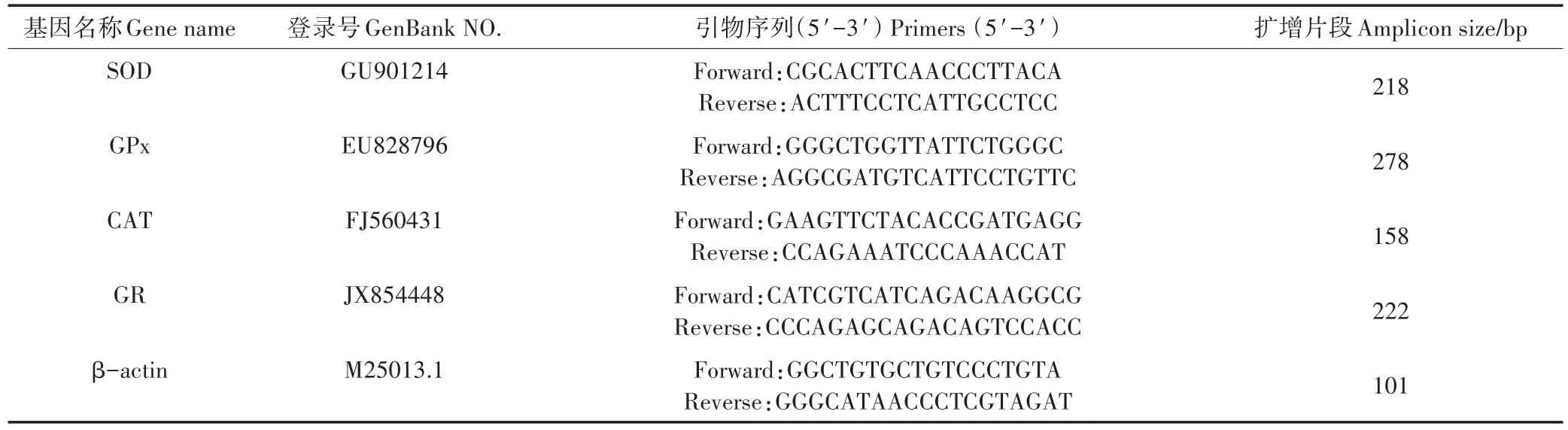
表1 荧光定量PCR扩增的引物Table 1 The primers of genes used for quantitative real-time PCR analysis
用多因素方差分析草鱼幼鱼经不同剂量MC-LR胁迫不同时间后肝脏中CAT基因表达的变化,结果表明,MC-LR不同诱导时间(24、48 h和72 h)对CAT基因表达无显著影响(F=1.095,P=0.343),而不同的诱导剂量对其表达有显著影响(F=52.069,P=0.000),作用时间和诱导剂量之间无交互作用(F=1.132,P=0.354)。LSD分析结果表明,CAT基因的表达量在MC-LR胁迫的第24、48 h和72 h,两个剂量组草鱼幼鱼肝胰脏CAT的表达量均显著低于对照组(P<0.05)。低剂量组CAT表达量呈现先下降后升高趋势,高剂量组CAT表达量呈现逐渐下降趋势,在72 h后,高剂量组草鱼幼鱼肝胰脏中CAT基因的相对表达量仅为0.02(图2B)。
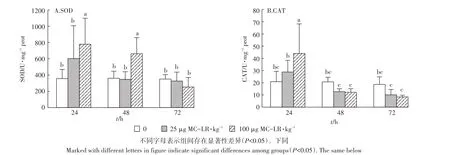
图1 MC-LR对草鱼幼鱼肝胰脏SOD和CAT活性的影响Figure 1 The effects of MC-LR on the enzymatic activities of SOD and CAT in the hepatopancreas of grass carp

图2 MC-LR对草鱼幼鱼肝胰脏中抗氧化基因表达水平的影响Figure 2 The effects of MC-LR on the expression of antioxidative genes in hepatopancreas of grass carp
多因素方差分析统计草鱼幼鱼肝胰脏中GPx基因表达变化的结果表明,MC-LR诱导不同时间(24、48 h和72 h)对GPx基因表达无显著影响(F=2.676,P=0.080),不同的诱导剂量对其活性有显著影响(F=401.271,P<0.001),作用时间和诱导剂量之间无交互作用(F=1.248,P=0.304)。LSD分析结果表明,GPx基因表达量的变化如图2C所示,在两个剂量组中,GPx在MC-LR胁迫不同时间后,表达量均显著下降(P<0.05)。低剂量组中草鱼幼鱼肝胰脏GPx的表达变化呈现先降低后升高趋势,表达量在胁迫48 h时,抑制程度最低,相对表达量为0.13;高剂量组中GPx的表达变化呈现逐渐降低的趋势,在72 h时,其相对表达量为0.07(图2C)。
草鱼幼鱼肝胰脏中GR基因表达量变化的统计分析结果表明,MC-LR诱导不同时间(24、48 h和72 h)对GR基因表达无显著影响(F=2.787,P=0.072),不同的诱导剂量对其表达有显著影响(F=7.707,P=0.001),作用时间和诱导剂量之间无交互作用(F=2.192,P=0.085)。GR基因表达量的变化如图2D所示,GR基因的表达量在低剂量组呈现先升高,后降低再升高的趋势,在24 h,其表达量上调至2.46倍,存在显著差异(P<0.05),随后下降,但在72 h,其表达量又上调至1.95倍,与对照组相比,差异不显著(P>0.05);而高剂量组草鱼幼鱼肝胰脏GR基因呈现先下降后上升的趋势,但在72 h,其相对表达量仍被抑制,GR基因在3个时间段的相对表达量差异均显著(P>0.05)。
2.3 MC-LR对草鱼幼鱼肝脏抗氧化酶活性与基因表达的相关性分析
对抗氧化酶活性与基因表达相关性进行分析,结果表明,不同处理组中,SOD活性与其基因表达的相关系数r=-0.261(P=0.056),在α=0.01下线性关系不显著;CAT活性与其基因表达的相关系数r=-0.085(P=0.541),在α=0.01下线性关系也不显著(表2)。
3 讨论
3.1 MC-LR对草鱼幼鱼肝胰脏SOD和CAT活性的影响
从抗氧化防御系统的角度来研究微囊藻毒素对鱼类的毒性作用机制是一个备受关注的科学问题。在正常情况下,生物体内SOD和CAT等可以及时清除受环境胁迫时产生的过量活性氧,从而使活性氧的产生和清除保持一种动态平衡[13]。本实验研究发现,低剂量的MC-LR对草鱼幼鱼肝胰脏SOD活性没有影响,高剂量的MC-LR使草鱼幼鱼肝胰脏SOD活性明显升高;而草鱼幼鱼肝胰脏CAT活性仅在高剂量MC-LR胁迫24 h后,其活性显著升高,其他变化均不显著。本实验中酶活性的这种变化趋势与其他学者的报道有一定相似性,如Pavagadhi等[8]发现低浓度MC-LR(<5.0 μg·L-1)可诱导SOD活性上升,而高浓度(>5.0 μg·L-1)使SOD活性降低。Yuan 等[19]研究报道低浓度(0.1、1 μg·L-1)的MC-LR对克氏原螯虾(Pro⁃cambarus clarkii)SOD和CAT活性没有影响,然而高浓度(10、100 μg·L-1)的MC-LR可诱导其SOD和CAT活性在暴露早期升高,而随着暴露时间的延长,则降低了SOD和CAT的活性。SOD和CAT均为细胞内重要的抗氧化酶,SOD能将超氧化物阴离子自由基(O-2·)转化成过氧化氢(H2O2),然后在CAT的作用下转变成H2O,当毒素量较高时,可能会引起SOD和CAT活性的消耗过快,从而导致其活性下降[20]。除了浓度的影响之外,朱枫等[21]认为暴露时间的差异也可引起SOD活性的变化,短时间诱导后,SOD为清除过多的ROS而活性快速上升,随着时间的延长,SOD快速消耗又使其活性下降;CAT的活性同样随着诱导时间的延长,其活性下降。另外,也有学者认为在暴露的早期阶段,MC-LR可促使机体抗氧化初级防御系统迅速做出反应出现应激性的保护,随着MC-LR的持续作用,抗氧化酶消耗直到耗竭,从而细胞抗氧化防御系统功能减弱或丧失[22]。根据以上分析可知,本实验中SOD和CAT酶活性的这种变化是机体抵御氧化损伤的一种保护机制。
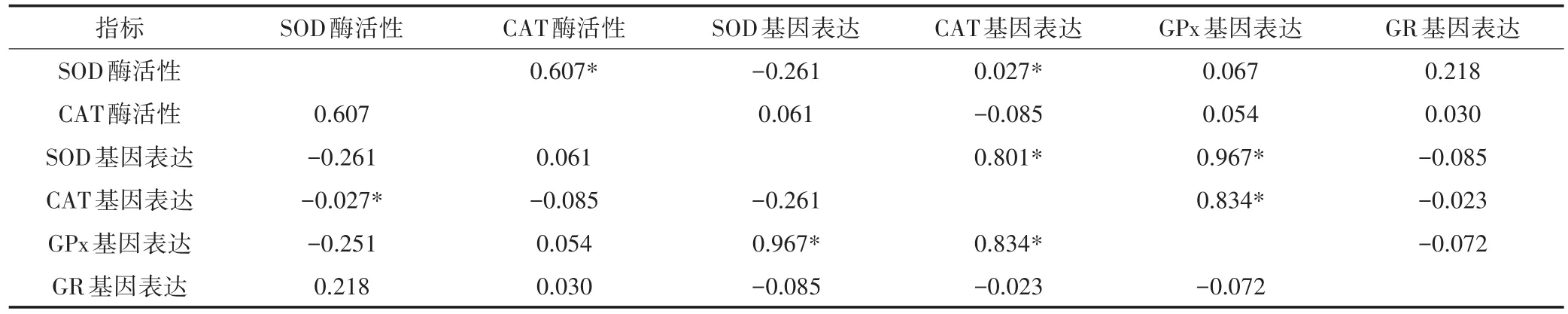
表2 MC-LR胁迫后抗氧化酶活性和基因表达的相关性分析Table 2 Correlation analysis of oxidative enzymatic activities and gene expression under MC-LR stress
3.2 MC-LR对草鱼幼鱼肝胰脏抗氧化基因表达的影响
生物体在基因水平的响应是生物应对环境变化的早期响应之一,抗氧化基因表达的改变可能在抵御MCs诱导的氧化毒性中起着重要的作用[23]。本研究发现抗氧化基因SOD、CAT和GPx在低剂量组和高剂量组中胁迫不同时间后,相对表达量均显著下降,这与其他学者的报道比较相似,如Jayaraj等[7]研究发现小鼠(Mus musculus)暴露在高剂量MC-LR(76.62 μg·kg-1)中GPx基因表达被抑制,但更多研究表明,不同剂量MCs诱导的氧化应激可使抗氧化基因表达趋势不一致,如 Hou 等[9]报道低剂量的MC-LR(50 μg·kg-1)在暴露早期可诱导基因表达增加,然而高剂量MC-LR(200 μg·kg-1)可使斑马鱼肝脏中SOD和GPx基因表达下降。在鲫鱼(Carassius aumtus)暴露实验中,发现MC-LR可使GPx和GR基因表达下调,CAT和SOD基因表达明显上升[24]。另外,本文对GR基因的表达研究发现,GR表达量的变化则与诱导时间和剂量有关,低剂量在暴露早期(24 h),其相对表达量显著上调,而高剂量诱导早期(24 h和48 h),其表达量则下降,但差异不显著,这与其他学者的报道不太一致,如小鼠暴露在MC-LR(38.31 μg·kg-1)中,GR基因表现为显著下调,而暴露在较高浓度(76.62 μg·kg-1)MC-LR中却明显上调[7]。根据以上研究报道可推测抗氧化酶相关基因的表达变化与MC-LR的浓度和时间均有一定关系,此外,基因表达下降或许与MCs直接损伤抗氧化相关基因的蛋白结构有关[25]。
3.3 MC-LR对草鱼幼鱼肝胰脏抗氧化酶活性和基因表达的相关性影响
一般来说,在相同的环境毒物刺激下,SOD和CAT酶活性的变化是一致的[26],但本研究发现草鱼幼鱼经MC-LR诱导后,草鱼幼鱼肝胰脏中SOD和CAT酶活性变化没有相关性,如本实验中高剂量组肝脏中SOD在染毒48 h相对于对照组显著上升,而CAT在染毒48 h却显著下降了,两个酶活性的变化趋势不一致,这与Shi等的报道比较相似[27]。另外,有研究报道抗氧化酶相关基因的表达与酶活性变化的相关性不大[7],本研究也发现类似现象,分析发现草鱼幼鱼经MC-LR诱导后,肝胰脏中SOD和CAT酶活性与其基因表达的变化没有相关性,然而,Xiong等[23]和Galan⁃ti等[28]均表明MCs诱导的氧化应激可使抗氧化酶活性和基因表达增加,并且抗氧化酶活性和基因表达之间呈现正相关。有学者研究发现抗氧化酶相关基因表达水平的改变会直接导致细胞抗氧化防御体系中抗氧化酶活性的变化,从而影响到抗氧化防御体系的效果,进一步放大了MCs引起的机体抗氧化还原系统的不平衡[21]。不同的试验所用的MC-LR剂量以及胁迫时间的不同,从而导致抗氧化酶活性和基因表达的变化曲线呈现多样性。本研究发现SOD和CAT活性在早期阶段都是上升的,随着胁迫时间的延长,又呈现下降的趋势,而SOD、CAT和GPx基因表达在早期就被抑制了,其原因可能是MC-LR胁迫导致ROS过量产生[29],破坏了细胞内蛋白质结构与功能,导致基因表达持续下降,也有可能是转录反应比酶活性更敏感,另外,基因表达量与酶活性表现并不完全一致也可能与转录后调控事件有关。综上所述,MC-LR胁迫下草鱼幼鱼肝胰脏抗氧化防御酶活性及其基因表达会发生改变,但MC-LR对机体抗氧化系统的影响是一个复杂的过程,尤其是MC-LR对机体抗氧化酶活性与基因编码调控之间的相互作用机制还有待更深入的研究。
4 结论
(1)在MC-LR胁迫草鱼幼鱼早期阶段可诱导其肝胰脏抗氧化酶SOD和CAT活性升高,随后活性下降,但两者之间没有相关性。
(2)MC-LR胁迫下,低剂量组和高剂量组草鱼幼鱼肝胰脏中SOD、CAT和GPx基因表达均被抑制,说明抗氧化基因对外界环境较敏感,即使低剂量的MCLR也影响机体的转录水平。在今后进行生物标记物筛选时,尤其是在MC-LR胁迫早期阶段,可从基因水平预警MC-LR的生态风险。
