鲫脑组织细胞系酵母双杂交cDNA文库的构建及初步应用
2019-01-22史玉恒范玉顶刘文枝赵建青曾令兵
许 晨,周 勇,史玉恒,范玉顶,刘文枝,江 南,赵建青,曾令兵
(中国水产科学研究院长江水产研究所,武汉430223)
鲤疱疹病毒II型(Cyprinid herpesvirus 2,CyHV-2)[1],又称为金鱼(Carassiusauratusauratus)造血器官坏死症病毒(goldfish haematopoietic necrosis virus,GFHNV)[2]或疱疹病毒性造血器官坏死症病毒(herpesviral haematopoietic necrosis virus,HVHNV)[3],与鲤痘疮病毒(Cyprinid herpesvirus 1,CyHV-1)、锦鲤疱疹病毒(Koi herpesvirus,KHV,CyHV-3)同属异疱疹病毒科(Alloherpesviridae)鲤疱疹病毒属(Cyprinivirus)成员[4,5]。鲤疱疹病毒II型可感染各种规格的养殖鲫鱼,死亡率高达90%~100%[1,6],给我国鲫鱼养殖业造成巨大的经济损失[7]。目前,围绕CyHV-2及其引起的鲫造血器官坏死症已开展流行病学、病原检测[8,9]、组织病理[10,11]、理化及生物学特性[12]、超微结构形态发生[13]、诊断技术与疫苗[14,15]等研究,但是关于CyHV-2与宿主细胞相互作用分子机制的研究较少。开展CyHV-2与宿主细胞受体相互作用的研究对于阐明CyHV-2的感染机制有重要意义。
目前,研究蛋白质之间相互作用的方法主要有酵母双杂交技术、免疫共沉淀技术、pull down技术、串联亲和层析技术等[16]。酵母双杂交技术作为一种高效研究蛋白质间相互作用的方法,不仅可以检测已知蛋白质之间的相互作用,而且可以筛选与已知蛋白相互作用的未知蛋白,被广泛用于研究病原与宿主细胞的互作机制[17,18]。已有研究表明,CyHV-2 ORF25编码蛋白与GiCB细胞孵育后能够吸附于GiCB细胞表面[19],因此探寻CyHV-2 ORF25的相互作用蛋白,将有助于深入了解病毒与宿主间的相互作用机制。本研究以鲫脑组织细胞GiCB细胞的总RNA为模板,反转录合成cDNA,扩增获得双链cDNA,与载体pGADT7-Rec共转化酵母菌Y187,构建GiCB细胞酵母双杂交cDNA文库,再与表达CyHV-2 ORF25编码蛋白的诱饵菌杂交,初步筛选得到与CyHV-2 ORF25编码蛋白相互作用蛋白的阳性菌落。GiCB细胞酵母双杂交 cDNA 文库的构建为研究CyHV-2与宿主细胞间的互作机制提供了重要研究工具,也为进一步研究CyHV-2病毒的感染机制奠定基础。
1 材料与方法
1.1 材料
鲫脑组织细胞系(Gibel carp brain,GiCB)由中国水产科学研究院长江水产研究所建立并保存[20],培养基为含10% 新生牛血清的M199,培养温度为28 ℃。
菌株与载体酵母Y2HGold和Y187菌株,酵母双杂交载体pGADT7-Rec、pGBKT7、pGBKT7-lam、pGBKT7-53、pGADT7-T购于Clontech公司。
1.2 方法
1.2.1 GiCB细胞总RNA的提取
待传代培养的GiCB细胞铺满瓶底时(25 cm2,Corning,USA),去除培养液,胰酶消化后离心收集细胞置于液氮中保存备用。采用Trizol法提取GiCB细胞的总RNA。通过紫外分光光度计(260 nm和280 nm)检测GiCB细胞的总RNA的吸光值、计算其浓度,并用琼脂糖凝胶电泳对GiCB细胞的总RNA的完整性进行检验。
1.2.2 cDNA文库的构建
1.2.2.1 cDNA合成及纯化
参照Clontech公司Make Your Own “Mate & Plate” Library System试剂盒操作步骤,以提取的GiCB细胞总RNA为模板,合成cDNA。利用CHROMA SPINTM-400 Columns试剂盒(Clontech公司)将双链cDNA进行分离与回收,除去小片段的cDNA分子,并用溶解于50 μL的ddH2O。
1.2.2.2 文库转化子的收获
利用限制性内切酶SmaI将pGADT7-Rec载体线性化,并根据Clontech公司Yeast maker Yeast Transformation System 2步骤,将GiCB细胞cDNA和pGADT7-Rec载体共转化Y187酵母感受态细胞。取150 μL菌液涂布SD/-Leu缺陷性固体培养基上,30 ℃恒温倒置培养,约3~5 d至酵母菌落出现,收集SD/-Leu培养基上酵母菌,即为GiCB细胞cDNA酵母文库。
1.2.3 cDNA 文库的鉴定
1.2.3.1 转化效率
双链cDNA与载体pGADT7-Rec共转化酵母菌Y187后,取转化后的少量菌液分别稀释一百倍和一千倍,取其中100 μL分别涂布SD/-Leu缺陷性固体培养基上,30 ℃恒温倒置培养3~5 d,对长出的菌落进行计数,计算转化效率和文库滴度,计算公式如下:
转化效率=培养基上的单克隆数(CFU)×总转化混合物体积(μL)×稀释系数/稀释混合物涂板体积(μL)×转化质粒质量(μg)
文库滴度=菌落数×稀释倍数/涂布菌液体积
1.2.3.2 插入片段
提取GiCB酵母双杂交cDNA文库的文库质粒,转化至大肠杆菌DH5α,随机选取若干克隆用引物T7/3′ AD(表1)进行菌落PCR扩增,并利用1.0%的琼脂糖凝胶电泳进行鉴定,同时送武汉天一辉远生物科技有限公司测序鉴定。
1.2.4 诱饵菌株pGBKT7-CyHV-2-ORF25(Y2HGold)自激活检测
将诱饵菌株pGBKT7-CyHV-2-ORF25(Y2HGold)(本实验室构建)、阴性对照菌株pGBKT7-lam(Y2HGold)(Clontech公司)和阳性对照菌株pGBKT7-53(Y2HGold)×pGADT7-T(Y187)(Clontech公司)分别划线于SD/-Trp/X-α-Gal、SD/-Trp/Aba+/X-α-Gal、SD/-Leu三种选择性固体培养基上,观察其生长情况。
1.2.5 酵母双杂交文库的筛选
利用pGBKT7-CyHV-2-ORF25(Y2HGold)诱饵菌株与GiCB酵母双杂交cDNA文库进行酵母双杂交实验,筛选与CyHV-2 ORF25编码蛋白互作的细胞受体。将1 mL活化的GiCB酵母cDNA文库菌和4~5 mL诱饵菌株pGBKT7-CyHV-2-ORF25(Y2HGold)加入含有45 mL 2×YPDA 培养基(含50 μg/mL Kan)的 2 L无菌三角锥瓶中,于30 ℃,30~50 r/min慢速震荡培养20-24 h。离心收集菌体,并用10 mL 0.5×YPDA(含 50 μg/mL Kan)培养基重悬,取100 μL菌液涂布于双缺SD/-Trp/-Leu/X-α-Gal/AbA的选择性固体培养基上,30 ℃恒温培养箱中倒置培养3-5 d后,将选择性培养基上的蓝色克隆菌落转移至四缺SD/-Trp/-Leu/-Ade/-His/X-α-Gal/AbA选择性固体培养基上反复筛选,以确定阳性克隆,并使用引物T7/3′AD(表1),T7/3′BD(表1)进行PCR检测。

表1 引物序列Tab.1 Primer sequences
2 结果
2.1 GiCB 细胞总RNA提取
用1%的琼脂糖凝胶电泳检测由Trizol试剂提取GiCB细胞总RNA,电泳结果可见清晰观察到28 S和18 S两条RNA条带(图1),其亮度比约2∶1,而5 S RNA条带亮度较弱,在分光光度计上测试A260 nm/A280 nm的值为1.89,表明提取GiCB细胞总RNA的纯度和完整性较好,已达到合成GiCB细胞cDNA的要求。

图1 GiCB细胞总RNA的琼脂糖凝胶电泳结果Fig.1 Gel electrophoresis analysis of total RNA from CiCB cells
2.2 cDNA文库的构建及保存
以GiCB细胞总RNA为模板,合成双链cDNA,覆盖率从100~3 000 bp,纯化回收并去掉小于250 bp的条带。将双链cDNA与载体pGADT7-Rec混合共转化至酵母Y187菌株中进行同源重组,获得GiCB细胞酵母双杂交cDNA文库,提取文库质粒并用甘油对酵母cDNA 文库进行保存备用。
2.3 文库质量鉴定
将文库质粒转化至大肠杆菌DH5α后,随机选取单克隆菌落以T7/3′ AD为引物进行扩增,根据PCR扩增结果表明插入片段大部分在1 000 bp以上,平均长度约为1.5 kb(图2)。将PCR产物测序结果进行BLAST比较,结果显示,插入片段与鲫鱼和鲤鱼的基因相似性较高(表2)。
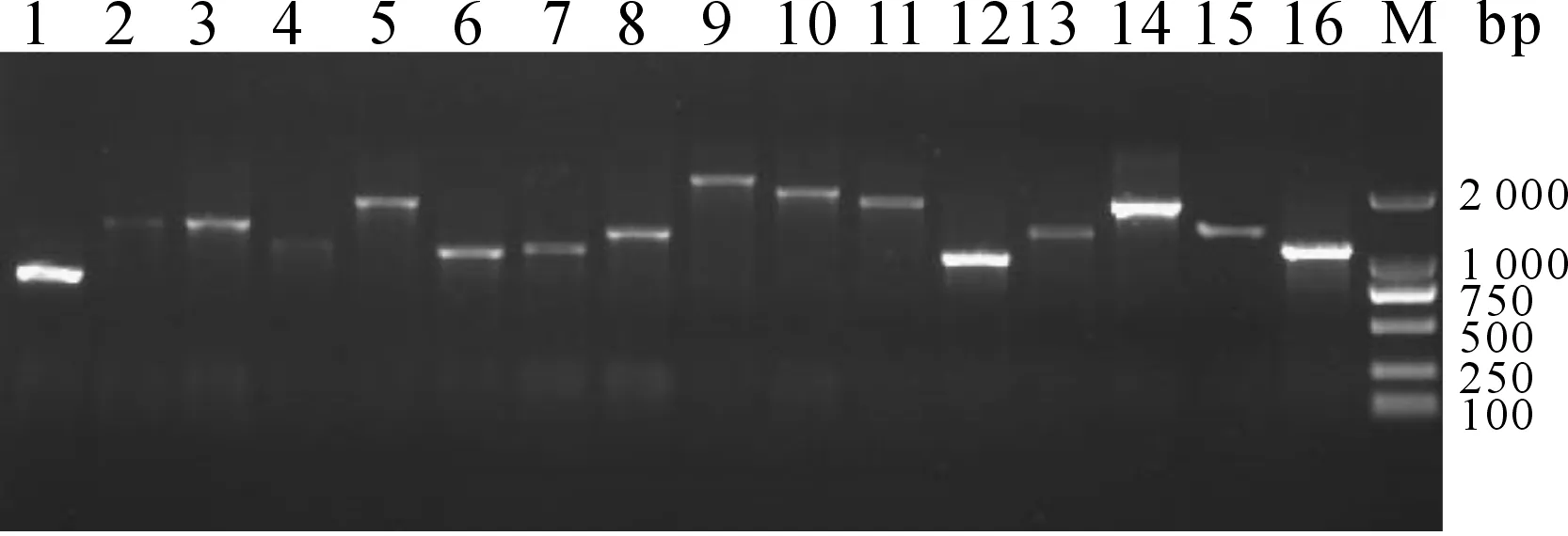
图2 文库随机菌落PCR电泳检测Fig.2 Electrophoresis of PCR products of random colonies from the libraryM:DL 2000 DNA Marker;1-16:随机挑取的单克隆

表2 鲫脑组织细胞文库基因的测序分析Tab.2 Analysis of library gene of GiCB cells
双链cDNA与载体pGADT7-Rec共转化酵母菌Y187后,取10 μL菌液分别稀释一百倍和一千倍,然后各取150 μL分别涂布SD/-Leu,对长出的菌落进行计数,稀释一百倍的SD/-Leu培养基上长出白色菌落1 280个,稀释一千倍的SD/-Leu培养基上长出白色菌落120个,根据公式计算得出GiCB细胞cDNA文库转化酵母菌Y187的效率为1.03×106CFU/μg,GiCB细胞cDNA酵母表达文库滴度约为1.24×106CFU/mL。
2.4 诱饵菌株自激活检测
pGBKT7-CyHV-2-ORF25(Y2HGold)菌株在选择性培养基中的生长结果表明:阴性对照菌株pGBKT7-lam(Y2HGold)和重组菌株pGBKT7-CyHV-2-ORF25(Y2HGold)在SD/-Trp/X-α-Gal选择性固体培养基上长出白色菌落(图3A),在其他培养基上无菌落出现(图3B,C)。阳性对照pGBKT7-53(Y2HGold)×pGADT7-T(Y187)在 SD/-Trp/X-α-Gal、SD/-Trp/Aba+/X-α-Gal、SD/-Leu均长出菌落(图3A,B,C),且在SD/-Trp/X-α-Gal和SD/-Trp/Aba+/X-α-Gal选择性固体培养基上菌落呈蓝色(图3A,B)。说明重组菌株无自激活现象,可以进一步进行文库筛选。

图3 诱饵表达载体自激活检测Fig.3 Detection of bait expression vector self-activation
2.5 诱饵蛋白ORF25的候选互作蛋白的筛选
pGBKT7-CyHV-2-ORF25(Y2HGold)诱饵菌株与cDNA文库进行杂交,分别使用双缺SD/-Trp/-Leu/X-α-Gal/AbA的选择性固体培养基(图4A)和四缺SD/-Trp/-Leu/-Ade/-His/X-α-Gal/AbA选择性固体培养基(图4B)反复筛选,最后获得阳性克隆。分别使用诱饵载体和文库载体的通用引物对阳性克隆进行PCR检测并进行测序分析。对测序结果进行分析发现诱饵载体通用引物扩增的片段为ORF25(图5),文库载体通用引物扩增的片段中仅有1个cDNA序列的开放阅读框正确。将该cNDA序列在GenBank数据库中进行同源性比对分析,发现这一序列编码蛋白与蛋白激酶C受体1(Receptor of activated protein kinase C1,RACK1)呈高度同源,同源性高达96%。
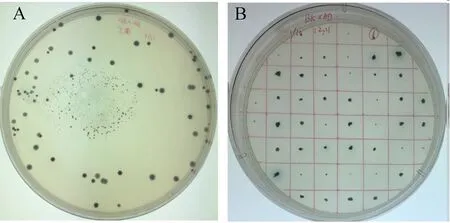
图4 杂交后的阳性菌株Fig.4 The positive strains after hybridizationA:SD/-Trp/-Leu/X-α-Gal/AbA双缺固体选择性培养基,B:SD/-Trp/-Leu/-Ade/-His/X-α-Gal/AbA四缺固体选择性培养基

图5 阳性克隆的PCR验证结果Fig.5 The detection of the positive strain with PCR assayM:DL5000;1:引物T7/3′AD检测;2:引物T7/3′BD检测
3 讨论
cDNA文库的质量与总RNA的纯度和完整性关系密切[21],真核生物的28 S、18 S rRNA的质量决定了总RNA的完整性。完整性较好的总RNA,其28 S与18 S rRNA的强度比一般为1.5~2.5∶1。本研究提取鲫鱼脑细胞系GiCB的总RNA,琼脂糖凝胶电泳结果显示28 S与18 S rRNA的比约为2∶1,并且条带清晰,提取的RNA质量较好,可以用于cDNA文库的构建。
评价酵母双杂交cDNA文库质量好坏的关键因素是插入片段的大小和滴度[22]。根据计算,本研究构建的GiCB酵母双杂交cDNA文库插入片段的平均长度约为1.5 kb,滴度约为1.24×106CFU/mL,均符合Clontech公司 SMART 文库构建的要求(原始文库的库容大于 1×106CFU)。该酵母双杂交文库具有较好的 cDNA 片段多态性和完整性,可用于进一步的文库筛选。
CyHV-2的ORF25基因属于ORF25多基因家族,编码病毒的膜蛋白,含有免疫球蛋白样结构域,具有较好的免疫原性。已有研究表明酵母表达的ORF25编码蛋白与GiCB细胞孵育后,感染CyHV-2,病毒滴度显著降低,进一步研究发现ORF25编码蛋白可特异性地吸附于GiCB细胞表面[19]。以CyHV-2 ORF25编码蛋白为诱饵蛋白与cDNA文库进行杂交,筛选获得阳性克隆,进一步证实了该文库的质量和有效性。
将CyHV-2 ORF25编码蛋白的阳性克隆进行PCR扩增和测序获得阳性克隆的cDNA序列,将序列在NCBI中Blast比对,发现这一序列编码蛋白与蛋白激酶C受体1(Receptor of activated protein kinase C1,RACK1)有96%的同源性。RACK1属于WD40蛋白(色氨酸和天冬氨酸)家族成员,含有7个WD重复序列,分子量为36 kD。1991年,RACK1首次被鉴定为蛋白激酶C(Protein Kinase C,PKC)受体的结合蛋白,RACK1 作为一种穿梭蛋白,可以改变 PKC 定位并发挥其生物学功能[23]。该蛋白参与细胞内多种信号分子的募集、组装和调控,在细胞的生物学过程中发挥重要功能[24,25]。有研究表明,RACK1能够作为接头分子将HIV-1的Nef蛋白与细胞的PKC聚在一起,增强PKC对Nef蛋白的磷酸化[26]。也有研究发现腮腺炎病毒V蛋白通过与RACK1结合,使信号转导因子和激活因子1(STAT1)从 STAT1、RACK1和IFN受体的复合物上脱落下来,从而抑制干扰素的抗病毒作用。根据CyHV-2 ORF25编码蛋白与阳性克隆序列间的相互作用推测,CyHV-2 ORF25编码蛋白可能通过与鲫鱼的RACK1结合,调控细胞内的信号通路,以完成病毒的复制。但是关于阳性克隆序列与CyHV-2 ORF25编码蛋白是如何发生作用仍然需要进一步的验证及研究。在病毒粒子的组装、释放过程中,病毒和宿主间发生了怎样的相互作用,其具体机制究竟是怎样的都不清楚,尚需要进一步的研究。对 CyHV-2 ORF25编码蛋白的互作蛋白和作用机制进行研究,将有助于揭示 CyHV-2的感染机理。
本研究成功构建了GiCB酵母双杂交cDNA文库,并利用此文库筛选到CyHV-2 ORF25编码蛋白的互作蛋白的阳性菌落,推测CyHV-2 ORF25的互作蛋白可能是细胞受体-蛋白激酶C受体1。GiCB酵母双杂交 cDNA 文库的构建为研究CyHV-2与宿主细胞间的互作机制提供了良好的技术平台,也为进一步研究CyHV-2的感染与致病机理奠定了前期基础。
