编织法制备人工神经导管的研究
2019-01-14陈钱杨茂园赵明达蒋季戴佳莹许建梅
陈钱 杨茂园 赵明达 蒋季 戴佳莹 许建梅
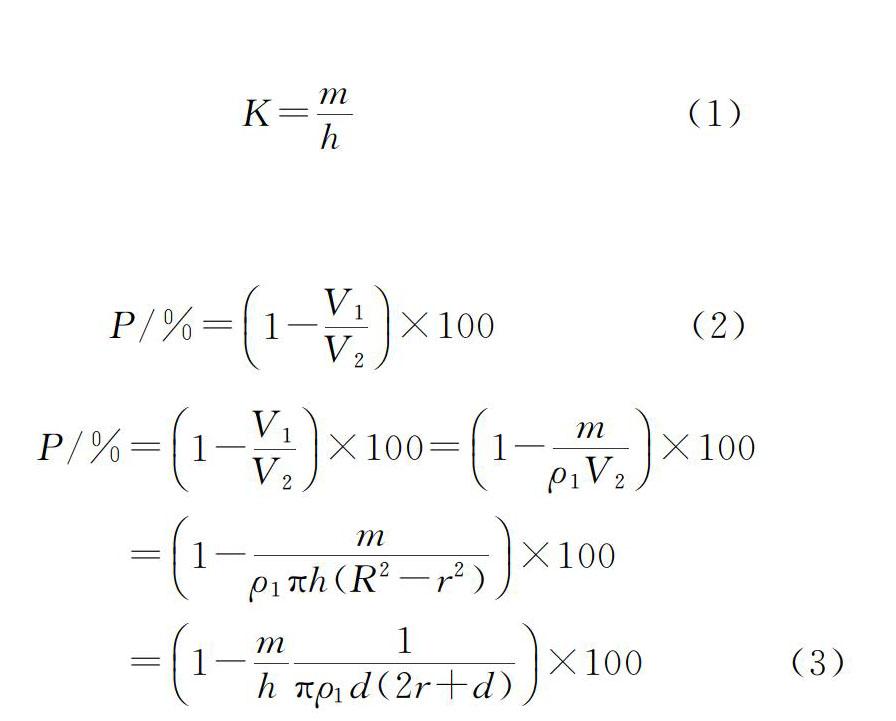
摘 要:探索利用编织法制备符合一定要求的人工神经导管。采用聚乳酸(PLA)纤维为编织材料,通过改变导管芯材料以及芯纤维数量与排列,设计并编织了3种类型的神经导管,并采用3种编织密度制备这3种不同结构类型的导管。对各类型导管的直径、横截面、质量、轴向断裂强力和伸长、外层纱线交织角进行测试与表征。结果表明编织法制备人工神经导管方便快捷,可以通过改变芯纤维数量与排布调节导管尺寸与孔隙率,批与批之间差异小,同时,为人工神经导管的标准化设计提供了参考数据。
关键词:人工神经导管;编织法;紧度系数;孔隙率
中图分类号:R318.08
文献标志码:A
文章编号:1009-265X(2019)05-0006-05
Abstract:The preparation of artificial nerve conduits that meet certain requirements using braiding method was explored. Polylactic acid (PLA) fibers were used as braiding materials, and three types of nerve conduits were designed and braided by changing the number and arrangement of the core materials and the core fibers. These three types of conduits with different structures were prepared using three braiding densities. The diameter, cross-section, mass, axial breaking strength and elongation, and interweaving angle of the outer-layered yarns were tested and characterized for each type of conduit. The experimental results show that preparation of artificial nerve conduit by braiding method is quick and convenient, and its size and porosity can be adjusted by changing the number and arrangement of core fibers. The difference among batches is little. The results provide reference data for the standardized design of artificial nerve conduits.
Key words:artificial nerve conduit; braiding method; tightness coefficient; porosity
全球每年有幾十万人遭受神经损伤,当外周神经受到损伤时,要用合适的桥接物连接两端。历经几代人的研究,实现修复神经缺损和神经再生的人工神经导管应运而生。从早期的自体神经移植到今天的三维神经导管,神经导管的研究已有百年有余。最早在19世纪末,有利用脱钙骨制成骨性管桥接神经损伤部位进行修复,证明了这种导管具有修复神经的功能[1]。10年后,Rice等[2]利用动脉修复了大犬坐骨神经,神经导管已经初具规模。之后神经导管的材料探究逐渐从琼脂、骨、金属等非生物材料发展到生物材料领域[3]。2007年Yang等[4]讨论了以丝素蛋白进行神经移植用于周围神经再生的发展与评价。到了2012年,Daly等[5]研究发现用生物材料能弥合周围神经的差距,增强神经损伤的修复。2015年Srinivasan等[6]研究了微通道再生支架应用于被截肢者长期的外围神经接口这一课题,为人工神经导管的研究提供了更多的可能性。
目前人工神经导管的制备方法多种多样,有模具法[7]、浸提法、挤出成型法、静电纺丝法[8]、3D打印技术[9]、编织法[10]等。前几种方法制成的导管操作存在一定的难度,批与批之间的差异较大,导管强力不够,弯曲性相对较差。相比较而言,编织法却有不同于以上几种方法的优点。首先该法操作简单规范,按同一工艺参数制成的导管批与批间的差异较小;其次采用编织法无论是进行中空导管还是内部织入平行排列的纤维都可以自由设计,织入的纤维数量与纤维间的孔隙情况都可以控制;第三,通过调整编织密度与芯纤维数量和排布可以很容易控制导管的直径与孔隙率等指标。
本研究以聚乳酸纤维(PLA)为编织层,以直径22 mm的聚丙烯(PP)塑料硬管及精练蚕丝纤维为芯材料,利用16锭编带机编织制备了3种类型用于修复周围神经损伤的人工神经导管。通过调整编织密度与芯纤维数量与排列考察导管直径、孔隙率、编织角等物理指标的变化,为人工神经导管的标准化设计提供数据参考。
1 实 验
1.1 导管结构的设计
大量研究表明,用于修复周围神经的人工神经导管除了应具有生物相容性,不具有细胞毒性之外,还须具有一定的强度、抗压扁能力和弯曲回复性能,更重要的是导管的内部结构应存在一定的贯通微孔。为了达到这些性能要求,本研究中采用双层编织,内部填充导管或平行排列纱线。双层编织是为了控制孔壁的孔隙率,既保证导管外壁具有一定的通透性,又能确保孔隙不至过大,导致大量炎症细胞进入导管内,影响神经轴突的再生。内部填充平行排列的纱线一方面是可以制造出贯通的微通道,另一方面给神经受损端游离的雪旺细胞等提供定向迁移生长的平台。
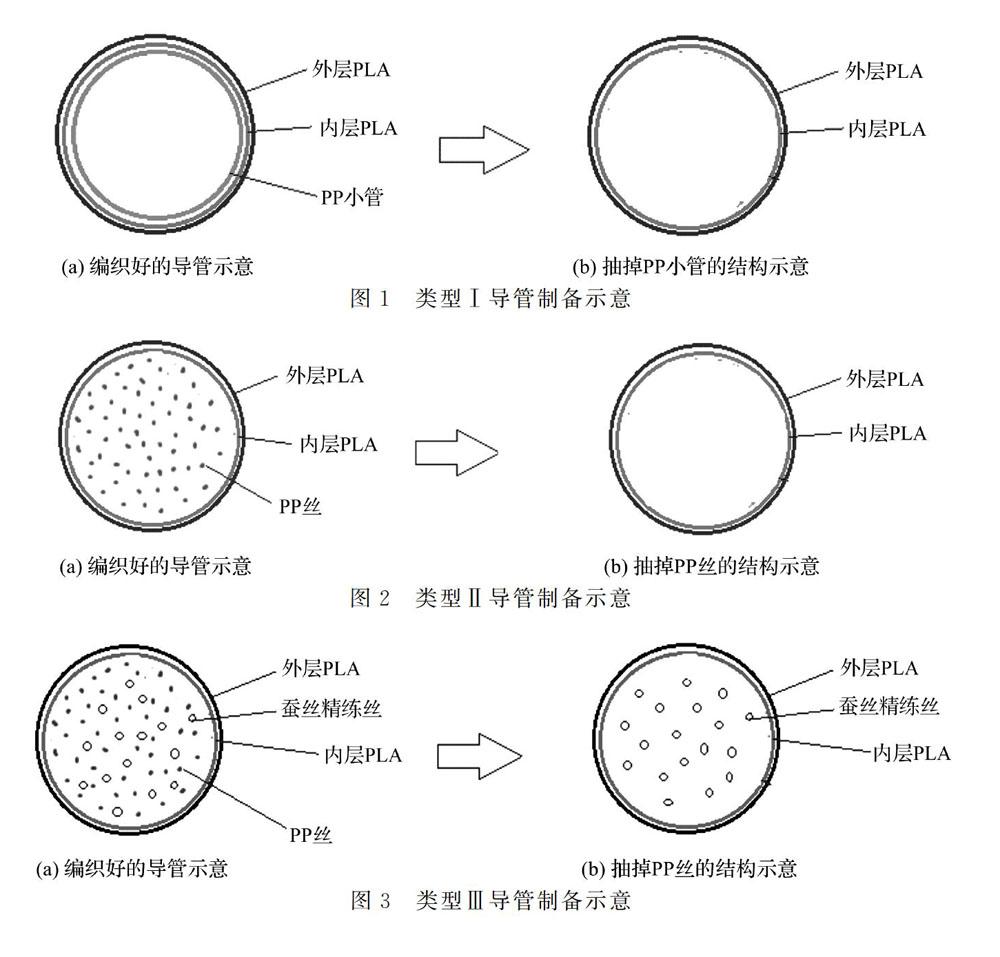
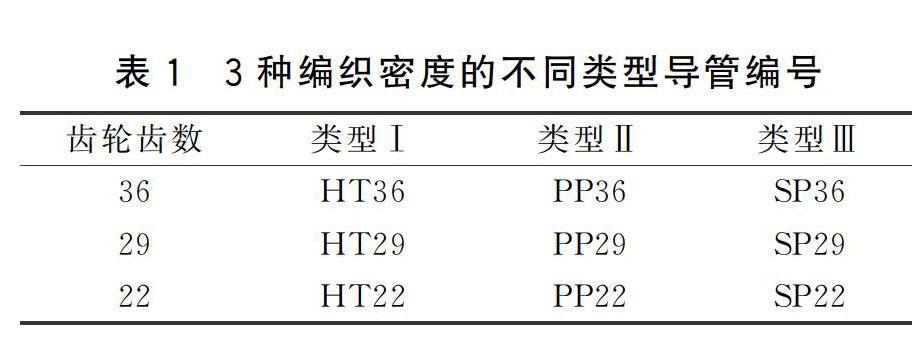
本研究共设计了3种类型的导管,分别为类型Ⅰ,类型Ⅱ,类型Ⅲ。图1-图3即为这3种类型导管制备的示意图。从图1可以看到,类型Ⅰ导管采用PP硬管做芯棒,PLA纱线为双层编织层,织成后再抽出PP芯棒而形成中空结构。类型Ⅱ则是以一定数量的PP丝做芯,PLA纱线为双层编织层,织成后再抽出PP丝而形成中空结构,导管结构见示意图2。类型Ⅲ则是以一定数量平行排列的PP丝和蚕丝精练丝一起为芯,PLA纱线为双层编织层,织成后再将PP丝全部抽出,留下平行排列的丝素纤维形成有微通道的导管,导管结构见示意图3。
1.2 实验材料与设备
实验材料:107.8 dtex(97D)的PLA长丝,444.4 dtex(400D )PP丝,蚕丝精练丝和透明PP中空小管,以上材料均来自南通新帝克单丝科技股份有限公司。
实验仪器:编织仪器全自动双锭打线机(上海哈考线带设备有限公司);医用缝合线编织机(16锭,上海哈考线带设备有限公司);DHG-9077A电热恒温干燥箱(上海精宏实验设备有限公司);OHAUS电子天平(美国奥豪斯有限公司);YG025型电子织物强力仪;超景深三维电子显微镜;便携式多功能数码显微镜(超眼科技有限公司)。
1.3 神经导管的编织
通过更换编织机上的齿轮(齿数分别为36、29、22)编带来改变导管的编织密度。分别制得3种类型下的3种不同密度的导管,每种导管按表1进行编号命名。将编织好的神经导管每根剪成20 cm长,共9组。
1.4 神经导管的热定形
将编织好的导管每组用铝箔纸包好放入干燥箱热定形,定形温度85 ℃,定形时间10 min。外层PLA纤维表层在加热时处于微熔状态,纤维表层互相粘连,冷却后纤维的粘连状态就固定下来。导管的圆柱形态也就固定下来,不易塌坍,并且导管两端则不容易脱散。
定形完成后将所有试样中作芯的PP硬管和所有的PP丝抽出。
1.5 导管物理机械性能测试
1.5.1 直 径
每组随机抽取5个导管试样,用便携式多功能数码显微镜对每个试样拍照,利用专业分析软件对试样照片测量神经导管直径,每个导管测量5个点,取平均值。
1.5.2 质 量
每组随机抽取5个20 cm长的导管试样用电子天平测试该长度下的质量。
1.5.3 轴向断裂强力和伸长
每组随机抽取5个20 cm长的导管试样在电子织物强力仪上测试轴向断裂强力和伸长。
1.5.4 横截面与纵向形态特征
通过三维显微镜观察神经导管的三维结构。
1.5.5 外层纱线轴向交织角
编织而成的神经导管可以通过显微镜观察外层纱线的轴向交织角。
1.5.6 导管紧密度
导管的紧密度是指导管的松紧程度,一般用每厘米纱线的织入数表示。全自动数显的编带机可直接设置该指标。但是对于非全自动的编带机,则无法获知这一数据。考虑到紧密度大的导管管壁密实,紧密度小的导管则管壁疏松,相应的则表现为单位长度克重的差异。为此,这里定义单位长度的编织管管壁(不含填充材料)的质量为管状织物的织入紧度系数,用符号K表示,即:
K=mh(1)
式中:m为整个神经导管的质量,也即双层编织材料的质量;h为神经导管的轴向长度,该系数反映了管状织物的导管紧密度程度,g/m。
1.5.7 导管外壁的孔隙率
作为修复周围神经的导管,外壁的孔隙率是衡量导管通透性的一个重要指标。材料的孔隙率是指材料内部空隙的体积占材料总体积的百分比,用符号P表示,计算见式(2)。利用(2)式可以推算神经导管双层编织材料的孔隙率,这里的计算不包含其中空部分。
P/%=1-V1V2×100(2)
式中:V1为PLA纤维所占的体积,ρ1为PLA纤维的密度;V2为双层编织材料的体积,ρ2为双层编织材料的密度;m为双层编织材料的质量;h为神经导管的轴向长度,r和R分别为神经导管的内外径,d为神经导管的双层编织材料厚度。
则对于一定长度h的神经导管,利用(2)式进行推导如下:
P/%=1-V1V2×100=1-mρ1V2×100
=1-mρ1πh(R2-r2)×100
=1-mh1πρ1d(2r+d)×100(3)
由(3)式可见,孔隙率只和m/h的值有关系,也就是(1)式的紧度系数,其他参数均为定值。m/h值越大,孔隙率越小,导管越紧密;m/h值越小,则反之。
2 结果与讨论
2.1 直 径
本研究中制备的用于周围神经修复的人工神经导管直径设计约2 mm。人体内周围神经种类较大,直径差异也较大,为此对于不同的神经进行修复,导管的直径也非常重要。这里主要是希望探讨由齿轮控制的编织密度对所编织的导管直径大小的影响。由表2可以看到,通过控制芯棒或芯纤维的数量可以较好地控制导管直径,而编织密度的改变对导管直径的影响并不是很大。
2.2 导管紧密度与孔隙率
表3为根据(1)式和(3)式计算的类型I和类型Ⅱ导管的紧度系数和孔隙率。导管壁的厚度是采用游標卡尺测量得到,不同型号导管壁的厚度测量值没有明显差异,这里统一取平均值d=0.02 cm。PLA纱线的密度通过测量计算为ρ1=0.74 g/cm3。导管试样长度h=20 cm,导管外径R采用表2中的数据。类型Ⅲ和类型Ⅱ都是用同规格同数量的PP丝作芯,且类型Ⅲ的蚕丝精练丝与PP丝均匀分布,所以蚕丝精练丝直径与PP丝相比可忽略,因此类型Ⅲ神经导管与类型Ⅱ的PLA双层质量在误差允许范围内相等。在实验中只需分析类型Ⅰ和类型Ⅱ的导管试样质量。由表3中数据可知,在编织同一直径大小的PLA神经导管时,编织齿轮更换时,织入质量和导管紧密度也随之变化。随着齿轮齿数的增加,PLA导管的织入质量减少,紧度降低,织入密度减少,管壁孔隙增大,不利于神经生长的炎症细胞和成纤维细胞[11]透过孔隙的几率也随之增大。在相同情况下,类型Ⅱ导管在织入紧度上和类型Ⅰ差异不大。
PP360.004 64853.0
2.3 轴向断裂伸长和强力
表4是3种类型导管的断裂指标。由表4可以看到,3种类型神经导管的断裂伸长率随着织入紧度的增加而降低。类型Ⅲ神经导管的断裂伸长率稳定,随着拉伸强力的变化而变化,但是这种变化并不明显。且其断裂伸长变异系数较小。说明了填充有蚕丝精练丝的神经导管在断裂时受到蚕丝和PLA的综合作用,强力增大,机械强度强,性能稳定,断裂同时性好。类型Ⅰ和类型Ⅱ强力变异系数较小,说明两者在拉伸过程中受力均匀。而类型Ⅲ强力变异系数较大。
2.4 横截面与纵向形态
图4为同种织入密度不同填充物的3种导管横截面,能看到它们具有较为明显的差异。当齿轮数为22时,3种导管都是双层结构但HT22横截面最接近圆形。图4(c)对应的类型Ⅲ的神经导管中的蚕丝纤维排列集中在导管的中心位置,形成贯通的微孔结构,其他两者类型都是中空的导管,在结构上不具备诱导神经轴定向生长的平行纤维。
图5显示了沿神经导管轴向PLA层热定形的融合情况,可以看出,两个PLA编织层均匀地融合在一起,形成较小孔隙的神经导管管壁。随着织入密度的增加,类型Ⅲ神经导管的交织点越来越紧密。
2.5 轴向交织角
导管的织入紧度大,纱线交织角越大,纱线与纱线的紧密度越大,孔隙率越小。表5是各类型导管的轴向交织角,轴向交织角的测量示意图见图5(c)。由表5中数据可以看到3种类型导管因直径相当,使用同一齿轮时,交织角亦基本相等。而随着齿轮数的增加,交织角也随着减小,导管织入紧度下降。该结果与导管紧密度测量结果一致。
3 结 论
a)通过以一定直径PP导管或PP长丝为芯均可制备直径可控的中空型人工神经导管;
b)采用PP长丝与丝素纤维为芯可制备导管内具有定向排列纤维的人工神经导管,并可通过丝素纤维的织入数量控制导管内孔隙状况;
c)所设计的导管具有较强的机械力学性能可以满足人工神经导管的力学需求;
d)可以通过编织机不同号齿轮来控制导管的织入紧度,交织角,与导管壁孔隙率。
参考文献:
[1] 赵立国,姚康德.神经导管修复周围神经损伤的研究进展[J].生物医学工程与临床,2003,7(2):120-123.
[2] RICE D H, BURSTEIN F D. Restoration of physiologic vocal fold abduction with the ansa cervicalis nerve[J]. Archives of Otolaryngology, 1983,109(7):480.
[3] PRIESTLEY J, KING V, KNIGHT D P, et al. Methods and apparatus for enhanced growth of peripheral nerves and nervous tissue[J]. U. S. Patent, 2009,15:35-56.
[4] YANG Y, DING F, WU J, et al. Development and evaluation of silk fibroin-based nerve grafts used for peripheral nerve regeneration[J]. Biomaterials, 2007,28(36):5526-5535.
[5] DALY W, YAO L, ZEUGOLIS D, et al. A biomaterials approach to peripheral nerve regeneration: bridging the peripheral nerve gap and enhancing functional recovery.[J]. Journal of the Royal Society Interface, 2012,9(9):202-221.
[6] SRINIVASAN A, TAHILRAMANI M, BENTLEY J T, et al. Microchannel-based regenerative scaffold for chronic peripheral nerve interfacing in amputees[J]. Biomaterials, 2015,41(41C):151-165.
[7] 何留民,全大萍,廖凱荣.具有多纵向排列通道的多孔神经导管的制备研究[J].组织工程与重建外科杂志,2006(6):312-315.
[8] 何晨光,高永娟,赵莉,等.静电纺丝的主要参数对PLGA纤维支架形貌和纤维直径的影响[J].中国生物工程杂志,2007,27(8):11-14.
[9] PATI F, GANTELIUS J, SVAHN H A. 3D bioprinting of tissue/organ models[J].Angew Chem Int Edit,2016,55(15):4650-4665.
[10] 王亚玲.复合丝素蛋白神经导管的制备及周围神经缺损的修复研究[D].无锡:江南大学,2016.
[11] LACKINGTON W A, Ryan A J, OBrien F J. Advances in nerve guidance conduit-based therapeutics for peripheral nerve repair[J]. ACS Biomaterials Science & Engineering, 2017,3:1221-1235.
