菠菜抗坏血酸过氧化物酶基因家族的鉴定及表达分析
2019-01-14郁征宇葛晨辉王小丽徐晨曦王全华蔡晓锋
郁征宇, 葛晨辉, 王小丽, 徐晨曦, 王全华, 蔡晓锋
(上海师范大学 生命科学学院 植物种质资源开发协同创新中心,上海 200234)
0 引 言
当植物受到高温、低温、干旱和盐等非生物胁迫时,其体内会产生大量的O2-、HO-、过氧化氢(H2O2)等活性氧(ROS)[1].即使是在正常的条件下,植物体内的许多代谢过程,包括叶绿体、线粒体和质膜相关的电子传递系统也会释放出活性氧[2].当活性氧清除系统无法及时去除细胞中产生的活性氧时,就会造成植物细胞层面上的氧化损伤[3].植物细胞内存在酶类和非酶类两种清除活性氧的抗氧化系统,其中抗氧化物酶类系统中包括了超氧化物歧化酶(SOD),抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)等,而对去除过氧化氢起主要作用的是CAT和APX,APX是抗坏血酸-谷胱甘肽(AsA-GSH)循环中的关键酶,对H2O2的亲和力更强[4],以抗坏血酸(ASA)为电子供体,催化H2O2的还原[5].APX是保护叶绿体免受H2O2氧化损伤的主要酶类.有大量研究证实了APX在植物应对非生物胁迫中起着重要作用.
APX主要存在于高等植物中,在某些真核藻类、蓝细菌和昆虫中也检测到了APX[6].通过亚细胞定位研究,将APX同工酶分为4种类型:细胞质型、叶绿体型、线粒体型和微体型[7].在拟南芥和水稻中都检测到了8种APX同工酶,拟南芥APX有3个位于细胞质,2个位于叶绿体,另外3个位于过氧化物酶体中[8];水稻APX中的2个存在于细胞质,3个存在于叶绿体,2个存在于过氧化物酶体,另外1个结合在线粒体上[9].
菠菜(SpinaciaoleraceaL.)为耐寒性蔬菜,含有丰富的营养,生长温度高于25 ℃时,其品质和产量都会受到影响,严重时甚至死亡.高温、干旱和盐含量的急剧变化都会导致活性氧的大量累积,APX在清除活性氧中的关键作用使得探讨菠菜APX基因的表达调控具有重要的理论意义和实践价值.本文作者对菠菜APX进行了生物信息学的分析,并研究了其组织表达和环境胁迫调控能力.
1 材料与方法
1.1 菠菜APX基因的鉴定
在拟南芥种质信息(TheArabidopsisInformation Resource,TAIR) 数据库(http://www.arabidopsis.org)中获得拟南芥AtAPXs(Ascorbate Peroxidases)蛋白序列,在菠菜数据库(http://www.spinachbase.org/?q=blast)中进行TBLASTN分析得到菠菜APX基因候选序列,同时对所获得的序列开放阅读框(ORF),利用GENSCAN (http://genes.mit.edu/GENSCAN.html)预测确认.经筛选后的氨基酸序列再利用ScanProsite软件(http://www.expasy.ch/tools/seanprosite/)和InterProScan软件(http://www.ebi.ac.uk/Tools/InterProScan/)来验证是否含有APX基因保守序列.
1.2 基因结构、蛋白保守序列及进化树分析
利用基因核苷酸编码序列与其相对应的基因组序列,通过Gene Structure Display Server (GSDS 2.0,http://gsds.cbi.pku.edu.cn/index.php)确定其基因结构.利用Protpi (https://www.protpi.ch/Calculator/ProteinTool#ProteinInputs)预测氨基酸数量、分子量和等电点.使用ClustalW进行多重序列比对,MEGA5[10]绘制进化树(NJ tree).利用MEME suite (http://meme-suite.org/tools/meme)进行蛋白质保守基序(motif)分析,通过p-value判断结果是否达到显著水平.在线使用WoLF PSORT (http://www.genscript.com/psort/wolf_psort.html)对其蛋白质序列进行亚细胞定位.
1.3 菠菜材料的处理与采样
选取S104菠菜为实验材料,将种子播种于穴盘,以体积比例为1∶1的草炭土/珍珠岩为基质,在玻璃温室中育苗.选取长势一致的幼苗,小心洗去根部基质,移至营养液(大量元素采用Hoagland配方,微量元素采用Arnon配方)中进行水培,营养液每3 d进行一次更换,并且每天对其pH值进行测量与调节,使其保持在5.8~6.0之间.水培菠菜置于人工气候室中,光周期为10 h光照/14 h黑暗,温度控制在21 ℃(光照)/18 ℃(黑暗),光照强度约为5000 lx,湿度控制在71%左右.水培两周后,选取长势一致的菠菜苗,准备进行环境胁迫处理.采用添加20%(质量分数)PEG 4000的方式进行干旱模拟;通过添加物质的量浓度为400 mmol·L-1的NaCl溶液模拟盐胁迫环境;喷施物质的量浓度为100 mmol·L-1的H2O2模拟氧化胁迫;调节人工气候箱的温度模拟高温胁迫(40 ℃)及低温胁迫(4 ℃).分别在胁迫处理后的0,3,6,12 h时对菠菜功能叶进行采样.
选取长势一致的幼苗定植于自然条件光照的玻璃温室中.在菠菜植株开花期采集不同发育阶段的根、茎、功能叶、功能叶叶柄、新叶、新叶叶柄、雄花和雌花样品,并立即于-80 ℃液氮中冰冻保存.
1.4 APX基因表达分析
使用Trizol法提取菠菜总核糖核酸(RNA),并使用NanoDropTMOneC分析RNA的浓度与质量.通过PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒将提取的总RNA反转录成cDNA(Complementary DNA)模板.使用Primer-BLAST (https:www.ncbi.nlm.nih.gov/tools/primer-blast)进行引物设计.使用TB GreenTMPremix Ex TaqTM(Tli RNaseH Plus) 试剂盒在ABI 7500上进行实时荧光定量聚合酶链式反应(qRT-PCR).采用So18s基因作为内参,用2-ΔΔCt法计算相对表达量,用GraphPad Prism 7对结果进行作图.
2 结 果
2.1 菠菜SoAPXs家族成员全基因组鉴定
在菠菜基因组数据库中利用8个拟南芥AtAPX蛋白序列进行TBLASTN分析,经过保守序列确认得到7个菠菜SoAPXs基因,数量与拟南芥和水稻的8个相似.将这7个基因分别命名为SoAPX1,SoAPX2,SoAPX3,SoAPX4,SoAPX5,SoAPX6和SoAPX7.
菠菜SoAPXs基因的基因组核苷酸序列长度分布于755 bp(SoAPX7)到6688 bp(SoAPX2)之间.开放式阅读框长度最短的是429 bp(SoAPX7),最长的为421 bp(SoAPX6),对应的蛋白质氨基酸数量分布于142~421之间.蛋白质相对分子量(MW)在1.554×104~4.572×104u之间,等电点(pI)最大为8.40(SoAPX6),最小为5.26(SoAPX7)(表1).亚细胞定位预测结果显示SoAPX1,SoAPX3和SoAPX7蛋白定位于细胞质;SoAPX2、SoAPX5和SoAPX6蛋白定位于细胞周质;SoAPX4则定位于细胞外基质.
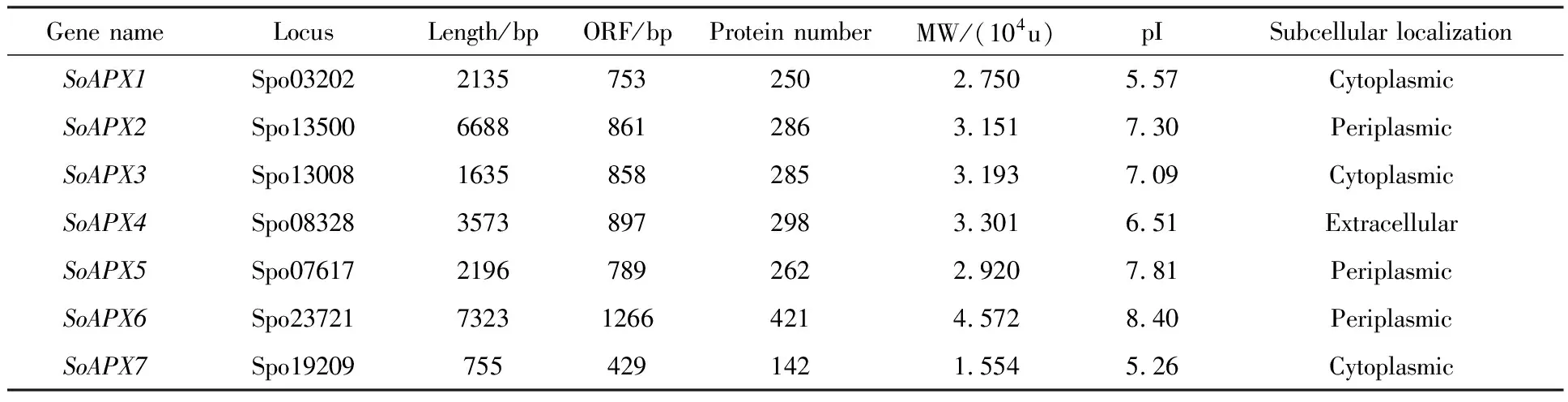
表1 菠菜SoAPX家族基因信息
菠菜SoAPXs基因的外显子数量为5~12个(图1),其中SoAPX2,SoAPX3,SoAPX4和SoAPX5都含有9个外显子,8个内含子;SoAPX1含有8个外显子,SoAPX6含有12个外显子,SoAPX7含有5个外显子.

图1 菠菜SoAPX家族基因结构
2.2 菠菜SoAPX家族蛋白保守基序分析
利用Pfam对拟南芥和菠菜APX蛋白序列进行分析,结果显示每个基因都含有过氧化物酶(peroxidase)的结构域.MEME对菠菜和拟南芥共15个APX蛋白质序列进行分析,共鉴定了9个保守基序,长度在11~50个氨基酸残基之间(图2).

图2 菠菜SoAPX基因中保守基序的氨基酸序列
这些motifs的分布如图3所示:每个APX蛋白中的motif数量在4~9之间,其中motif 4存在于所有蛋白中,其次是motif 1和motif 7,存在于除SoAPX6外的其余14个蛋白中,其中motif 7都位于C末端,出现次数最少的是motif 8,在SoAPX1,SoAPX2,SoAPX3,SoAPX4,SoAPX5,AtAPX1,AtAPX2和AtAPX5中出现,并且都位于N端.
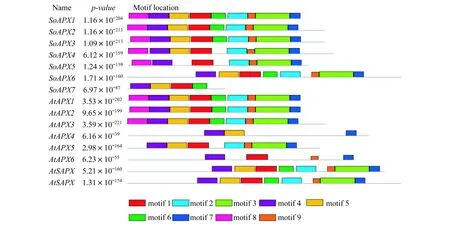
图3 菠菜与拟南芥APX蛋白保守基序分布
2.3 菠菜和其他植物APX蛋白系统发育分析

图4 菠菜及其他3种植物的APX蛋白进化树分析
利用菠菜、拟南芥和水稻的APX蛋白质长序列构建了系统进化树(图4).结果表明AtAPX4和AtAPX6未被聚类,其他APX被聚为4个大类:SoAPX1与定位于细胞质的AtAPX1,AtAPX2,OsAPX1和OsAPX2为一类,SoAPX2,SoAPX3及SoAPX7与定位在过氧化物酶体上的AtAPX3,OsAPX3及OsAPX4聚为一类,SoAPX5和SoAPX4与定位在过氧化物酶体上的AtAPX5聚为一类,SoAPX6与定位于叶绿体上的AtSAPX,AtTAPX,OsAPX5,OsAPX8,以及OsAPX6,OsAPX7聚为一类.
2.4 菠菜SoAPX基因在各组织中的表达
利用菠菜的7个SoAPX基因特异引物(表2)进行qRT-PCR检测,表达结果表明菠菜SoAPXs基因在所使用检测部位中均有表达,除SoAPX2在根中表达较低外,其他6个基因在根中都有较高的表达(图5).SoAPX7在各个组织中的表达较低,其次是SoAPX3.SoAPX7在雄花中表达最多,在功能叶、功能叶叶柄和茎中表达较低.SoAPX3主要在根、新叶和新叶叶柄中表达,在功能叶中表达较低.SoAPX4和SoAPX5的组织表达模式类似,在根部表达最多,其次是功能叶、功能叶叶柄,在茎中表达较低,在新叶、新叶叶柄、雄花和雌花中几乎不表达.SoAPX1则与SoAPX3具有类似的表达模式,主要在新叶和新叶叶柄中表达,其次是根,在功能叶中的表达较低.SoAPX6除了在根中表达较高外,在其他各组织中均有类似的表达量(图5).

表2 菠菜APX基因qRT-PCR引物

图5 SoAPX基因在菠菜不同组织中的表达分析.(a)~(g) SoAPX1~SoAPX7,R:根;S:茎;L:功能叶;P:功能叶柄;YL:新叶;YP:新叶叶柄;FF:雌花;MF:雄花
2.5 菠菜SoAPX基因在不同环境胁迫下的表达
图6为菠菜SoAPX基因经不同胁迫处理后的表达结果.由图6可知,经低温胁迫处理6 h后,各SoAPX基因的表达都出现了不同程度的上调,而在低温胁迫12 h后,大部分基因的表达下调.SoAPX3和SoAPX6在低温胁迫时长为3 h时上调,在时长为6 h和12 h时的表达则逐渐降低,特别当时长为12 h时其表达相比对照存在明显的下调.SoAPX1,SoAPX2和SoAPX7在低温胁迫时长为1,3,6 h时的表达呈上升趋势,在6 h时表达量已达到对照的2.5倍,在处理12 h后的表达则下调.
冬天。然而,潜伏在这种表象之下的,是永不停滞的创造力。这座城市就像一个巨大的试验场,永远不会缺少新的生存形态。因此,理所当然的,我们选择了为21世纪用车生活而生的XF SPORTBRAKE。

图6 菠菜SoAPX基因对不同环境胁迫的响应.(a)~(g) SoAPX1~SoAPX7
经盐胁迫处理后,在3 h时SoAPX3和SoAPX7的表达有明显上升,表达量是对照的3.8倍和4.6倍,其他基因的表达也都有小幅的上调.SoAPX3和SoAPX6的表达仅在3 h时有所上调,其余处理时长的表达均下调表达,并在12 h时达到最低.SoAPX5的表达在12 h时有小幅上调,其他基因的表达在处理12 h后都被不同程度地抑制.
SoAPX6经高温胁迫处理后表达下调.经高温胁迫12 h后,除SoAPX7外,其他基因的表达都明显受到抑制,SoAPX3与SoAPX7类似,它们的表达均于高温胁迫3 h后显著上调,在其他时长下基本都被抑制.
SoAPX7对干旱处理的响应最为强烈,在处理3 h和12 h后其表达量分别上调到对照组的5.5倍和4.2倍.经干旱处理1 h后,SoAPX1,SoAPX2,SoAPX3和SoAPX6的表达都被抑制,在处理3 h后都出现回升,随后又呈下降趋势.SoAPX4和SoAPX5在干旱处理下各个时长的表达相比对照组都有小幅上调.
经氧化胁迫3 h和6 h后,各SoAPX基因的表达都有所上调,处理6 h后表达量的上调最为明显,其中最明显的是SoAPX1的表达量达到了对照组的5.2倍,其次是SoAPX4(4.9倍).
3 讨 论
植物体内含有多个APX蛋白的编码基因,本研究在菠菜中发现的7个APX蛋白家族成员,在数量上与拟南芥(8个)、水稻(8个)以及玉米(9个)[11]相近.通过Blast比对发现筛选到的7个APX蛋白均与水稻和拟南芥相对应的氨基酸序列有较高的同源性,这7个蛋白也与茶树[12]以及白桦[13]的APX蛋白同源性较高,都含有过氧化物酶的保守结构域.亚细胞定位预测到菠菜SoAPX蛋白的表达部位和与其同源的拟南芥、水稻APX并不完全相同,还有待进一步实验的验证,然而由多部位的表达可以推测它的功能具有多样性,可通过多重机制多细胞器配合清除细胞内多余的活性氧,实现抗氧化功能.
植物APX基因家族在植物生长发育和逆境胁迫响应等生理过程中都发挥着非常重要的作用.当植物受到多种生物和非生物胁迫时,APX将通过调控植物的一系列生理生化过程,快速清除细胞中过量的H2O2,使细胞免受活性氧的毒害.本研究结果表明菠菜SoAPX6基因在各个组织均有表达,与刘慧春[14]发现的红掌AnAPX基因表达相似,由此推断该基因在菠菜生长发育过程中发挥着多重作用.此外,红掌AnAPX基因在根中表达最高,与本研究中除SoAPX2外的其他6种菠菜SoAPX基因表达类似.SoAPX2在根中的表达比叶中低很多,这与张蕾等[15]对毛白杨PcAPX进行的组织表达分析结果相似,只是SoAPX2主要在新叶中表达,而PcAPX主要在老叶中表达.SoAPX1和SoAPX3的组织表达模式基本一致,由此推测两者在植物体内所发挥的作用相似.SoAPX7在雄花和雌花中相对较高的表达量,表明其可能在菠菜性器官的发育过程中起重要作用.
本研究中SoAPX3和SoAPX7在受盐胁迫的过程中被诱导表达的结果与王超等[13]SsAPX在盐胁迫下的反应一致,表明它们可能参与了菠菜抗盐的生理反应,具有保护菠菜免受盐胁迫造成的氧化损伤的作用.
在本研究中喷施H2O2对菠菜进行模拟氧化胁迫时,7种SoAPX基因的转录水平都有不同程度的升高,这可能是由于APX蛋白的主要作用就是清除植物体内的活性氧,当外源H2O2进入植物体内时,APX基因的表达作出响应,以应对氧化胁迫对植物所产生的影响.
4 结 论
在菠菜基因组中鉴定出7个APX基因,对其基因结构、保守基序和进化关系进行了分析.同时对SoAPX在菠菜不同组织中的表达进行了检测与分析,明确了菠菜SoAPXs的组织表达模式.此外,还对SoAPX在不同环境胁迫下的表达进行分析.这些结果表明菠菜SoAPXs可能在抗盐、耐寒、抗旱以及抗氧化胁迫中起作用,为后续深入鉴定APX家族成员的功能提供参考.
