柚皮苷促进牙周韧带干细胞增殖和分化的研究
2019-01-09唐琪柯婷史丹晖荣彩丽
唐琪 柯婷 史丹晖 荣彩丽
[摘要] 目的 探讨不同浓度柚皮苷对牙周韧带干细胞增殖和分化的影响。 方法 分别在含有0.14 mg/mL(低浓度组)和1.4 mg/mL(高浓度组)柚皮苷的细胞培养基上对牙周韧带干细胞进行培养,并与不含柚皮苷的细胞培养基(空白对照组)培养情况进行对比。在培养1 d、4 d、7 d后对牙周韧带干细胞的增殖情况进行测定,在培养7 d、14 d后对牙周韧带干细胞的碱性磷酸酶活性及成骨相关基因[成骨特异性转录因子(Runx2)、骨钙素(OCN)、碱性磷酸酶(ALP)、Ⅰ型胶原(Col Ⅰ)]的表达进行测定。 结果 高浓度(1.4 mg/mL)的柚皮苷对牙周韧带干细胞的增殖具有促进作用(P<0.05),对牙周韧带干细胞的成骨向分化也具有一定的促进作用,能够显著提高成骨相关基因(Col Ⅰ、ALP、OCN、Runx2)的表达。 结论 柚皮苷在一定的浓度和时间下,能促进牙周韧带干细胞的增殖与成骨向分化。
[关键词] 牙周韧带干细胞;柚皮苷;骨组织工程;牙周再生医学
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-9701(2019)33-0030-05
[Abstract] Objective To investigate the effects of different concentrations of naringin on the proliferation and differentiation of periodontal ligament stem cells. Methods The periodontal ligament stem cells were respectively cultured on the cell culture medium containing 0.14 mg/mL naringin(low concentration group) and 1.4 mg/mL naringin(high concentration group), and compared with the cell culture medium without naringin (blank control group). The proliferation of periodontal ligament stem cells was measured after 1, 4 and 7 days of culture. The activity of alkaline phosphatase and the expression of osteogenic related genes (Runx2, OCN, ALP, Col Ⅰ) in periodontal ligament stem cells were measured after 7 and 14 days of culture. Results The high concentration (1.4 mg/mL) of naringin promoted the proliferation of periodontal ligament stem cells. It also played a role in promoting the osteogenic differentiation of periodontal ligament stem cells and significantly increased the expression of osteogenesis related genes (Col Ⅰ, ALP, OCN, RUNX2) (P<0.05). Conclusion Naringin can promote the proliferation and osteogenic differentiation of periodontal ligament stem cells at a certain concentration and time.
[Key words] Periodontal ligament stem cells; Naringin; Bone tissue engineering; Periodontal regenerative medicine
牙周病作為患病率很高的口腔慢性感染性疾病,迄今无根治方法,主要原因是牙槽骨炎性吸收的修复和再生存在困难。牙槽骨高度的降低和牙龈退缩引发的美观和功能上的问题难以解决[1]。尽管开展的骨移植和引导牙周组织再生(Guided tissue regeneration,GTR)术已取得一定的进展,但因其不能使牙周膜细胞数量明显增加和生物相容性问题,在恢复牙周组织的生理结构和功能上还未达到所期望的目标[2]。柚皮苷是一种二氢黄酮类化合物,提取自芸香科植物柚等的外壳,是中药骨碎补的主要作用成分[3]。改变给药方式直接作用于靶细胞或搭载局部生物支架缓释控制给药时限或为高柚皮苷对牙周病疗效的可能途径[4,5]。
牙周韧带干细胞(Periodontal ligament stem cell,PDLS)即牙周膜中的未分化间充质细胞,是一类具有异质性和分化潜能的细胞,具备成体干细胞的特性,是牙周组织再生的重要细胞来源[6]。诱导PDLS定向分化可以获得更多的目标功能细胞,减少非目标细胞的自发分化。而且PDLS来源有限,牙周病拔除的牙齿因缺乏健康的牙周膜和潜在的细菌感染风险而不能使用[7],来源于健康的第三磨牙和正畸减数拔除的牙齿数量非常有限。因此采用细胞因子或细胞因子替代产品或细胞因子强化放大产品如中药某些有效成份扩增干细胞数量并诱导其定向分化为目标功能细胞具有非常重要的意义[8]。本实验旨在通过体外细胞培养技术,观察柚皮苷对牙周韧带干细胞增殖与成骨向分化的影响,为柚皮苷用于牙周病的治疗提供实验依据。
1 资料与方法
1.1 主要试剂和仪器
柚皮苷(阿拉丁公司,中国)、DMEM培养基(Gibco,美国)、胎牛血清(FBS)(Gibco,美国)、细胞冻存液(索莱宝,中国)、CCK-8试剂盒(同仁,日本)、碱性磷酸酶试剂盒(碧云天、中国)、CO2恒温培养箱(赛默飞,美国)、称量天平(美国Ohaus公司)、-20°C冰箱(赛默飞,美国)、-80°C冰箱(赛默飞,美国)、台式离心机(德国Heraeus公司)、无菌超净操作台(赛默飞,美国)、恒温水浴锅(上海医用恒温设备厂)、制冰机(美国Ross Temp公司)、光学显微镜系统(日本OLYMPUS公司)、酶标比色仪(美国Bio-Rad公司)、微流移液器(德国Eppendorf公司)、NanoDrop 2000C(赛默飞,美国)、PCR仪(美国Bio-Rad公司)。
1.2 实验方法
1.2.1 人牙周韧带干细胞的原代培养 取12~24岁患者因正畸或阻生而拔除的牙体牙周均健康的新鲜牙齿,冠根单向刮取根中1/3牙周膜,将组织块修剪为1 mm×1 mm×1 mm,Ⅰ型胶原酶37℃振荡消化10 min,大部分细胞游离,用吸管吹打使其充分分散,加入至含有10% FBS的DMEM培养基中终止消化。离心机1000 r/min离心5 min,弃去上清液,重旋沉淀,均匀接种在6 cm直径培养皿中,将培养皿置于37℃、5% CO2饱和湿度的孵箱中。细胞长至孔底60%左右时,进行胰酶消化、传代,取3~5代细胞进行后续研究。
1.2.2 CCK-8法测定柚皮苷对人牙周韧带干细胞增殖的影响 取生长良好的第3代牙周韧带干细胞,以1×104个/mL的浓度接种于96孔培养板,每孔接种100 μL。24 h后,弃去培养液,依照不同柚皮苷浓度(0 mg/mL、0.14 mg/mL、1.4 mg/mL)进行分组,分为两个实验组和一个对照组,每组设3个复孔。在培养1 d、4 d、7 d后,将DMEM培养基与CCK-8试剂按9:1配置成混合液,每孔加入100 μL,置于培养箱2 h后,以空白对照孔调零,于450 nm波长处测定吸光度(Optical density,OD)。
1.2.3 柚皮苷对人牙周韧带干细胞碱性磷酸酶活性的影响 取生长良好的第3代牙周韧带干细胞,以2×105个/mL的浓度接种于24孔培养板,每孔接种100 μL。24 h后,弃去培养液,依照不同柚皮苷浓度(0 mg/mL、0.14 mg/mL、1.4 mg/mL)进行分组,分为两个实验组和一个对照组,每组设3个复孔。在培养7 d、14 d后,利用碱性磷酸酶试剂盒测定样本内细胞碱性磷酸酶活性。
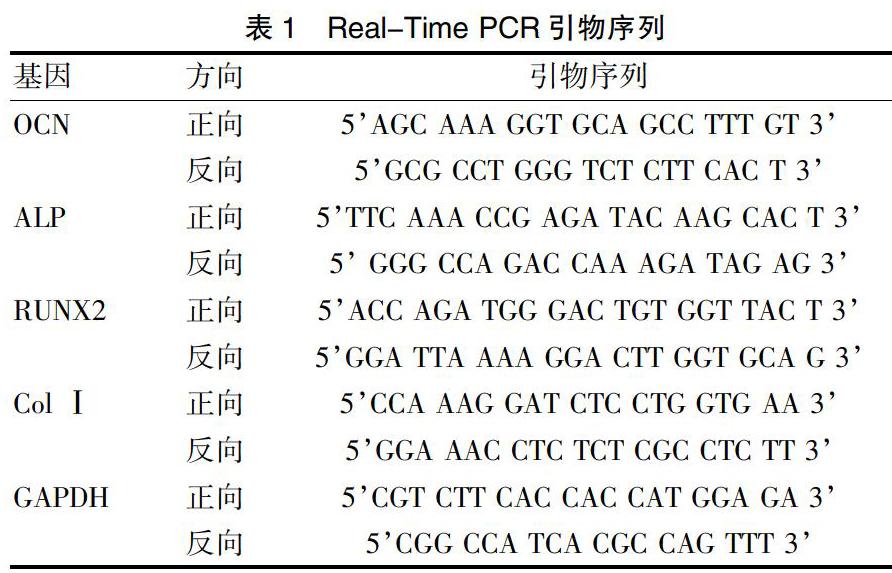
1.2.4 柚皮苷对人牙周韧带干细胞成骨相关基因的影响 取生长良好的第3代牙周韧带干细胞,以2×105个/mL浓度接种于24孔培养板,每孔接种100 μL。24 h后,弃去培养液,依照不同柚皮苷浓度(0 mg/mL、0.14 mg/mL、1.4 mg/mL)进行分组,分为两个实验组和一个对照组,每组设3个复孔。在培养7 d、14 d后,通过Real-Time PCR对各组人牙周韧带干细胞的成骨特异性转录因子(Runx2)、骨钙素(OCN)、碱性磷酸酶(ALP)、Ⅰ型胶原(Col Ⅰ)的基因表达进行检测。吸净24孔培养板中的培养基,PBS缓冲液清洗3次后,向孔中加入800 μL Trizol裂解液,冰上反复吹打支架,使细胞充分裂解,收集裂解液,转至离心管中,加入200 μL三氯甲烷后充分振荡15 s,冰上静置3 min。4℃,12000 g离心15 min,取上清液400 μL至另一离心管中,加入400 μL异丙醇,充分混匀后冰上静置10 min,4℃,12000 g离心10 min。充分上清液后加入1 mL无水己醇洗涤沉淀,4℃,7500 g离心5 min后弃去液体,静置3 min,待乙醇完全挥发后加入20 μL DEPC水溶解RNA沉淀,60℃金属浴5 min,用NanoDrop 2000C测定抽提RNA的浓度和纯度。提取1 μg RNA进行逆转录,利用逆转录试剂盒合成cDNA,以GAPDH为内参,构建PCR反应体系[20 μL、cDNA 1 μL、引物各0.5 μL(表1)、SYBR Green Master mix 10 μL、双蒸水8 μL]。将配好的PCR反应溶液置于Realtime PCR仪上进行扩增反应,反应条件为95℃,1 min,紧接40个PCR循环(95℃,15 s;64℃,25 s,收集荧光)。反应完成后进行扩增曲线和熔解曲线分析,基因表达量以检测基因的初始模板量表示(2-△△Ct)。
1.3 统计学方法
所有实验数据使用SPSS 16软件进行分析,行单因素方差分析,数据以均数±标准差(x±s)表示。P<0.05为差异有统计学意义,P>0.05为差异不显著。每组实验独立重复3次。
2 结果
2.1 人牙周韧带干细胞的原代培養
原代培养的组织块,经过3~5 d,爬出梭形细胞,约7 d后可长满培养皿底部。细胞呈细长状,核圆形或卵圆形。经传代,3~5代内生长迅速,细胞形态不发生改变。免疫组化抗细胞角蛋白染色阴性,抗波形蛋白多克隆抗体阳性。稳定培养的3~5代细胞用于实验。
2.2 CCK-8法测定柚皮苷对人牙周韧带干细胞增殖的影响
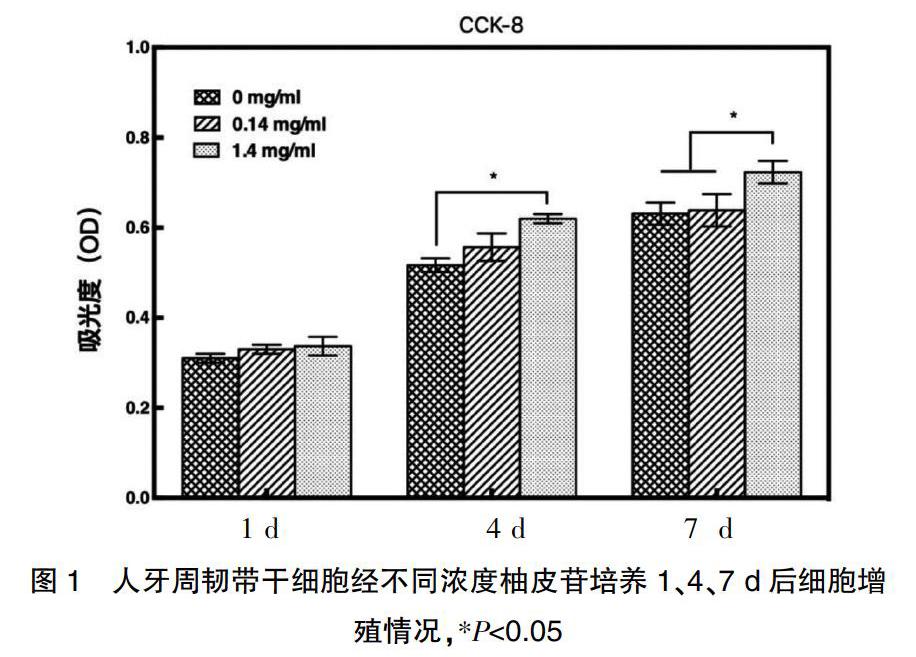
对比0、0.14、1.4 mg/mL浓度柚皮苷的三种培养基在1、4、7 d对人牙周膜干细胞增殖情况的影响。图1显示经CCK-8试剂盒检测后所得OD值。在第1天,细胞增殖情况随柚皮苷浓度增加略有上升,但无明显差异(P>0.05)。在第4天,0.14 mg/mL低浓度组(0.56±0.02)略高于无柚皮苷空白对照培养基组(0.52±0.01),但无显著性差异(P>0.05),1.4 mg/mL高浓度组(0.62±0.01)的细胞增殖显著高于无柚皮苷空白对照培养基组(P<0.05)。在第7天,0.14 mg/mL低浓度组(0.64±0.03)高于无柚皮苷空白对照培养基组(0.63±0.02),仍无显著性差异(P>0.05),而1.4 mg/mL高浓度组(0.72±0.02)的细胞增殖显著高于其他两组(P<0.05)。
2.3 柚皮苷对人牙周韧带干细胞碱性磷酸酶活性的影响
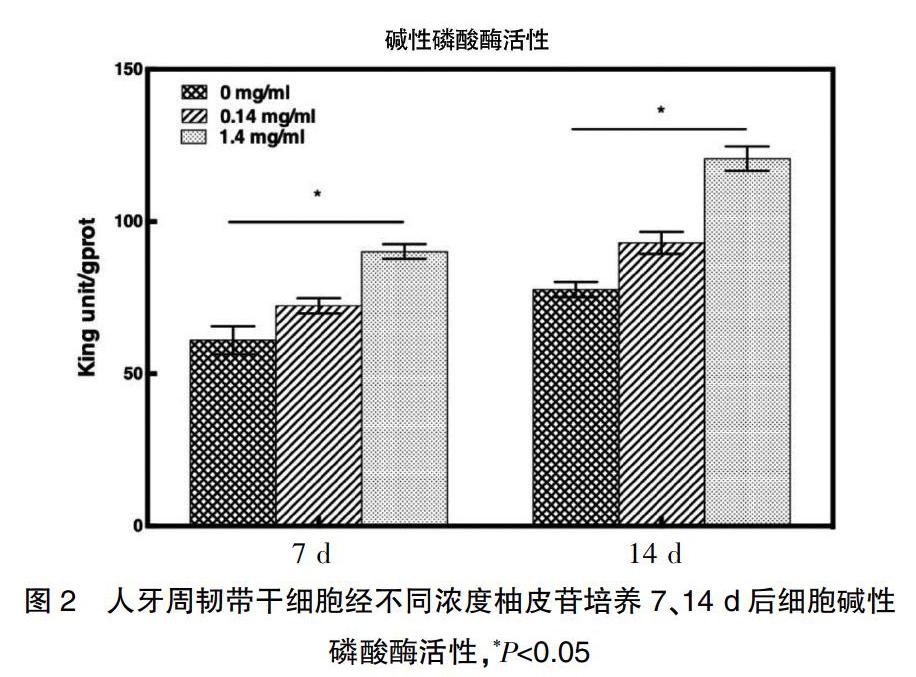
图2显示人牙周韧带干细胞在0、0.14、1.4 mg/mL浓度柚皮苷的三种培养基中7、14 d细胞碱性磷酸酶活性。可以看到,随着时间的推进和柚皮苷浓度的升高,人牙周韧带干细胞碱性磷酸酶活性也随之显著升高(P<0.05)。0、0.14、1.4 mg/mL浓度柚皮苷在7 d时的碱性磷酸酶活性分别为(61.02±3.74)、(72.33±2.05)、(90.11±1.97);而高浓度的柚皮苷使得牙周膜干细胞碱性磷酸酶活性上升更大。
2.4 柚皮苷对人牙周韧带干细胞成骨相关基因的影响
2.4.1 7 d时柚皮苷对人牙周韧带干细胞成骨相关基因的影响 图3显示人牙周韧带干细胞经不同浓度柚皮苷培养7 d后细胞成骨相关基因的表达。在第7天,0、0.14、1.4 mg/mL柚皮苷浓度三组间ColⅠ基因相对表达量均有显著性差异[(1.03±0.08)、(1.25±0.04)、(1.81±0.08)],随着柚皮苷的浓度增加,差异逐渐增大(P<0.05)。而三组间OCN基因的表达无明显差异。在第7天时,1.4 mg/mL高浓度组的ALP基因表达(2.11±0.06)显著高于空白对照组(1.17±0.12)和低浓度组(1.31±0.20)(P<0.05)。三组间的Runx2基因的表达量随着柚皮苷浓度上升而呈现上升趋势,然并未有显著性差异(P>0.05)。
2.4.2 14 d时柚皮苷对人牙周韧带干细胞成骨相关基因的影响 图4显示人牙周韧带干细胞经不同浓度柚皮苷培养14 d后细胞成骨相关基因的表达。在第14天,三组间Col Ⅰ基因相对表达量均有显著性差异,分别为(1.01±0.10)、(2.61±0.07)、(3.07±0.12)(P<0.05)。三组间OCN基因的表达随柚皮苷浓度上升而上升,1.4 mg/mL浓度组的基因表达量(2.20±0.23)显著高于空白对照组(1.80±0.38)和低浓度组(1.47±0.12)(P<0.05)。但0.14 mg/mL低浓度组与空白对照组间无明显差异(P>0.05)。在第14天时,三组间的ALP基因表达量均有显著差异,且随柚皮苷浓度提高而提高,分别为(1.31±0.18)、(2.23±0.12)、(2.51±0.21)(P<0.05)。在第14天,1.4 mg/mL高浓度组的Runx2基因的表达量(2.20±0.16)显著高于空白组(1.59±0.14)和低浓度组(1.71±0.07)(P<0.05)。
3 讨论
牙周病是发生于牙周组织的慢性感染性疾病,其主要病理改变是牙周袋形成和牙槽骨吸收。牙周病不仅危害牙周健康、口腔健康,也影响全身健康,与全身疾病有着密切关系。结合干细胞治疗及生物因子促进的牙周细胞组织工程学为近年来研究的热点,为牙周组织再生提供了新的选择[9]。其中种子细胞的选择具有重要的意义[10],必须具备干细胞的特性,可以分化成为软硬组织新生的功能细胞和合成细胞[11]。口腔内相关的干细胞主要来自于牙髓、牙周膜、牙囊和牙龈乳头等牙周组织[12]。这类细胞容易获得,具有多项分化潜能,并可以自体移植。牙周韧带干细胞已在今年的研究中被证实具有多向分化潜能,能分化成为牙周组织中所需要的纤维、牙槽骨、牙骨质等多种组织。但牙周韧带干细胞经过传代后分化潜能下降,需要一些生物因子或其他昂贵的药物提高其增殖分化活性,而这些细胞因子价格昂贵难以推广[13]。采用确切、高效和经济的方法扩增和诱导干细胞定向分化对推广牙周组织工程的运用是非常必要的。中医中药是我国传统医学的宝库。骨碎补是水龙骨科斛蕨的干燥根茎(Drynaria fortunei),性溫,味苦,具有疗伤止痛,补肾强骨的功效。临床上使用的补肾固齿丸主要组分即为骨碎补,但因其作用成份庞杂,口服给药经机体代谢吸收有限而对牙周组织再生重建的疗效不佳。目前已有相关文献研究证实中药骨碎补提取液具有促进成骨细胞株MC3T3-E1细胞增殖、分化和基质矿化的作用[14],以及对实验性大鼠牙槽骨吸收模型的促成骨疗效,以及将柚皮苷与生物材料相结合来修复骨缺损[15,16]。但其作用机制不明。而骨碎补的主要有效成分为以柚皮苷为主的二氢黄酮类化合物。这为取得廉价高效的骨促进生物因子提供了可能性。
本实验通过CCK-8法对不同浓度的柚皮苷溶液对牙周韧带干细胞增殖的影响进行研究。发现牙周韧带干细胞的增殖对柚皮苷的浓度呈一定的正比关系。且在一周内,高浓度(1.4 mg/mL)的柚皮苷溶液能显著增强牙周韧带干细胞的增殖。低浓度(0.14 mg/mL)的柚皮苷溶液能提高牙周韧带干细胞的增殖,但可能由于药物浓度过低,没有引起显著性的差异。
碱性磷酸酶是一种膜结合蛋白[17],是细胞成骨向分化的一种标志性蛋白,在成骨细胞矿化中起着重要的作用。实验中,不论是高浓度组还是低浓度组都表现出对牙周韧带干细胞碱性磷酸酶活性的显著促进。说明可能只需要较低的有效浓度,柚皮苷即可促进牙周韧带干细胞的成骨向分化及成骨矿化能力。
成骨相关基因表达的检测中,我们发现在整个实验周期,不论是高浓度组还是低浓度组,都能够显著促进牙周韧带干细胞Col Ⅰ表达的提高。Col Ⅰ是牙周组织中含量最多的胶原,是骨的含量最多的一种纤维基质,在早期成骨中有着重要的作用。OCN与Runx 2两种基因在7 d时,三组间未有明显差异,而在14 d时,高浓度组有明显表达,这可能由于这两种基因出现在成骨中后期,且柚皮苷引起这两种基因高表达的有效浓度较高。ALP基因的表达情况与2.2中碱性磷酸酶的表达情况较为一致,验证了柚皮苷对牙周韧带干细胞成骨向分化及矿化的促进作用。
综上所述,挖掘中医中药中的有效作用因子,将其与现代牙周组织工程技术相结合。能够为组织工程解决方案提供高效、经济的新的技术方式。柚皮苷,作为一种植物来源的化合物,有望在牙周组织再生中作为成骨促进因子进行作用[18]。还有相关研究表明,其对于免疫调节[19,20]、抑菌抗炎[21,22]也有一定的作用。这些作用的机制还有待进一步的探索。
[參考文献]
[1] Saud B,Malla R,Shrestha K.A review on the effect of plant extract on mesenchymal stem cell proliferation and differentiation[J]. Stem Cells Int,2019,19:7513404.
[2] Meric P,Buduneli N,Kanmaz B,et al. Cholinergic signaling mechanisms and early implant healing phases in healthy versus generalized aggressive periodontitis patients:A prospective,case-control study[J].J Clin Periodontol,2019,46(12):1165-1302.
[3] Kuang MJ,Zhang WH,He WW,et al.Naringin regulates bone metabolism in glucocorticoid-induced osteonecrosis of the femoral head via the Akt/Bad signal cascades[J]. Chem Biol Interact,2019,304:97-105.
[4] Huang J,Wang S,Zhang X,et al. Experimental study on loading naringin composite scaffolds for repairing rabbit osteochondral defects[J].Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2017,31(4):489-496.
[5] Xu Z,Li N,Wooley PH,et al. Naringin promotes osteoblast differentiation and effectively reverses ovariectomy-associated osteoporosis[J].Journal of Orthopaedic Science, 2013,18(3):478-485.
[6] Zheng DH,Wang XX,Ma D,et al.Erythropoietin enhances osteogenic differentiation of human periodontal ligament stem cells via Wnt/beta-catenin signaling pathway[J]. Drug Des Devel Ther,2019,13:2543-2552.
[7] Lopez-Garcia S,Lozano A,Garcia-Bernal D,et al.Biological effects of new hydraulic materials on human periodontal ligament stem cells[J].J Clin Med,2019,8(8):unpublished.
[8] Lin F,Zhu Y,Hu G.Naringin promotes cellular chemokine synthesis and potentiates mesenchymal stromal cell migration via the Ras signaling pathway[J]. Exp Ther Med, 2018,16(4):3504-3510.
[9] Chen P,Huang Y,Wang Y,et al. MALAT1 overexpression promotes the proliferation of human periodontal ligament stem cells by upregulating fibroblast growth factor 2[J]. Exp Ther Med,2019,18(3):1627-1632.
[10] Pizzicannella J,Pierdomenico SD,Piattelli A,et al.3D human periodontal stem cells and endothelial cells promote bone development in bovine pericardium-based tissue biomaterial[J]. Materials (Basel),2019,12(13),unpubloshed.
[11] Rovai ES,Ambrosio L,de Franca BN,et al.Protease-activated receptor type 1 activation enhances osteogenic activity in human periodontal ligament stem cells[J]. Stem Cells Int,2019,19:6857386.
[12] Iwasaki K,Washio K,Meinzer W,et al.Application of cell-sheet engineering for new formation of cementum around dental implants[J].Heliyon,2019,5(6):e1991.
[13] Lin F,Zhu Y,Hu G.Naringin promotes cellular chemokine synthesis and potentiates mesenchymal stromal cell migration via the Ras signaling pathway[J]. Exp Ther Med,2018,16(4):3504-3510.
[14] Xu Z,Li N,Wooley PH,et al. Naringin promotes osteoblast differentiation and effectively reverses ovariectomy-associated osteoporosis[J]. Journal of Orthopaedic Science,2013,18(3):478-485.
[15] Liu Y,Wu G,de Groot K. Biomimetic coatings for bone tissue engineering of critical-sized defects[J].Journal of The Royal Society Interface,2010,7(suppl_5):S631-S647.
[16] Dou XC,Li QL,Zhou J,et al. Biomimetic synthesis of a novel antibacterial nano-composite materials of hydroxyapatite and gelatin for bone repair and its biocompatibility in vitro[J].Shanghai Kou Qiang Yi Xue,2010,19(3):285-289.
[17] Sun M,Liu A,Shao H,et al. Systematical evaluation of mechanically strong 3D printed diluted magnesium doping wollastonite scaffolds on osteogenic capacity in rabbit calvarial defects[J]. Sci Rep,2016,6:34029.
[18] Wang D,Ma W,Wang F,et al.Stimulation of Wnt/β-catenin signaling to improve bone development by naringin via interacting with AMPK and Akt[J]. Cellular Physiology and Biochemistry,2015,36(4):1563-1576.
[19] Cao X,Lin W,Liang C,et al. Naringin rescued the TNF-α-induced inhibition of osteogenesis of bone marrow-derived mesenchymal stem cells by depressing the activation of NF-кB signaling pathway[J].Immunologic Research,2015,62(3):357-367.
[20] Wang JN,Jiang JJ,Xie YM,et al. Population pharmacokinetics of naringin in total flavonoids of Drynaria fortunei (Kunze) J. Sm. in Chinese women with primary osteoporosis[J]. Chin J Integr Med, 2012,18(12):925-933.
[21] Li F,Sun X,Ma J,et al. Naringin prevents ovariectomy-induced osteoporosis and promotes osteoclasts apoptosis through the mitochondria-mediated apoptosis pathway[J].Biochemical and Biophysical Research Communications,2014,452(3):629-635.
[22] Alam MA,Subhan N,Rahman MM,et al. Effect of citrus flavonoids,naringin and naringenin,on metabolic syndrome and their mechanisms of action[J]. Advances in Nutrition,2014,5(4):404-417.
(收稿日期:2019-07-15)
