MyoG基因多态性与牦牛生长性能的关联分析
2019-01-09柴志欣信金伟钟金城张成福姬秋梅
柴志欣,信金伟,王 会,郭 琳,钟金城,张成福,姬秋梅
(1.西南民族大学 青藏高原研究院,四川 成都 610041;2.青藏高原动物遗传资源保护与利用四川省、教育部重点实验室,四川 成都 610041;3.西藏自治区农牧科学院,省部共建青稞和牦牛种质资源与遗传改良国家重点实验室,西藏 拉萨 850009)
生肌调节因子(Myogenic regulatory factors,MRFs)家族主要包括生肌决定因子(Myogenic determining factor,MyoD)、生肌调节因子4(Myogenic regulatory factor 4,MRF4)、肌细胞生成素(Myogenin,MyoG)和生肌决定因子5(Myogenic fatcor 5,MYF5)[1],主要控制骨骼肌正常生长发育,体肌细胞定型、增殖,成肌细胞转化以及肌纤维形成,同时对肌肉功能完善发挥重要作用[2]。研究表明,MyoG在所有骨骼肌细胞中均可表达,其可调控中胚层细胞分化为成肌细胞、再由成肌细胞融合成肌纤维[3-4],是该家族中唯一能在骨骼肌细胞发育与生长过程中均可表达的调控因子。Neville、Weintraub等[5-6]敲除生肌调节基因家族4个转录因子,其中单独敲除MyoG基因的小鼠骨骼肌发育受损进而死亡,且个体发育较正常小鼠小;而单独敲除其他3个基因的小鼠,骨骼肌发育正常。肌细胞生成素具有调节基因表达功能,对其他因子起调控作用,MyoG可调控MRF4基因表达,也可通过调节肌肉肌酸激酶、肌钙蛋白和肌球蛋白轻链基因表达从而调节肌肉特异性。其作为转录调节因子,表达并启动骨骼肌特异胚胎性受体和收缩蛋白的合成[7]。Wright等[1]研究表明,MyoG基因作为一种正调控因子,影响小鼠骨骼肌发育。Fujisawa-Sehara等[8]研究发现,在小鼠胚胎发生期,MyoG基因上游序列可促进骨骼肌细胞系转录激活。Buonanno等[9]研究表明,MyoG基因上游区域可促进转基因小鼠组织发育的特异性表达。
牦牛生长性状是选育工作的重要参考指标,MyoG基因是骨再塑的重要调控因子,对骨骼肌发育成熟发挥重要作用,而骨骼生长在大型畜种中主要表现在体高、体长等生长指标上。基于MyoG基因在 MRFs 基因家族中的决定性作用,其调控机制已得到广泛研究,但目前对牦牛该基因的研究较少。
本研究以西藏主要牦牛类群及四川麦洼牦牛为对象,分析MyoG基因遗传多样性及与生长性状的相关性,寻找新的性状关联SNPs位点,以期应用于牦牛育种实践,提高生产性能,为牦牛分子标记辅助选育提供参考。
1 材料和方法
1.1 样本采集
选取四川麦洼牦牛、西藏类乌齐牦牛、申扎牦牛、帕里牦牛、斯布牦牛5个类群共286头健康成年个体(表1)。采集耳组织,-80 ℃保存备用。同时测定其体高、体斜长、胸围、管围、体质量等生长性能指标。按照动物组织基因组DNA提取试剂盒说明进行提取,1% 凝胶电泳和分光光度计检测其纯度及浓度,-20 ℃保存备用。
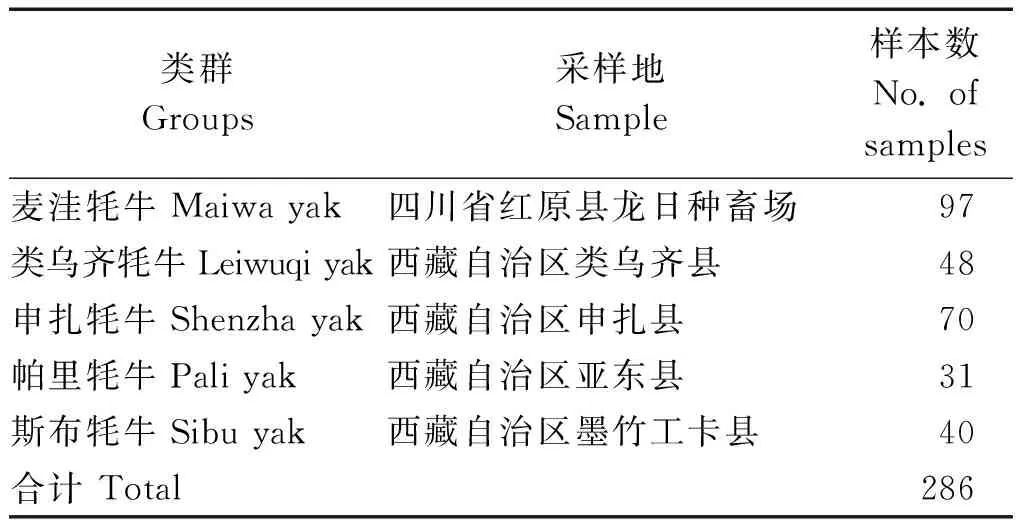
表1 供试牦牛样品清单Tab.1 List of samples used for analyses
1.2 牦牛体尺性状测定
测量需牦牛端正站立于宽阔、平坦地面上。四肢直立,从后面向前看只能看见后腿而不见前腿,侧望左腿不见右腿或右腿不见左腿,头自然前伸,不左不右,不高不低,4蹄落在地面2条平行的直线上。体质量测定采用电子磅秤,测杖测量牦牛个体高度、体斜长。体高测量标准为耆甲最高点到地面的垂直距离,体斜长通常称体长,肩端至坐骨端的距离,卷尺测量胸围、管围。胸围为肩胛后角处体躯的垂直周径。管围为前肢胫部上1/3的周径,一般在胫部最细处测量[10],每项测量2次,取平均值。
1.3 试验方法
1.3.1 DNA池构建 重复测定DNA浓度,取其3次平均值,稀释至50 ng/μL。100个DNA样品各取5 μL混合,4 ℃静置24~48 h。
1.3.2 PCR扩增 根据GenBank牛MyoG基因序列(AC_000173),利用Primer Premier 6.0软件设计PCR引物(表 2)。
PCR扩增体系(50 μL):DNA模板2 μL,上下游引物各2 μL,ddH2O 19 μL、Premix ExTaq聚合酶25 μL。
PCR扩增条件:94 ℃预变性4 min;94 ℃ 变性30 s,退火30 s,72 ℃延伸(具体如表2所示),共30个循环;72 ℃延伸5 min,4 ℃保存。10 g/L凝胶电泳检测,纯化、回收后送往英潍捷基(上海)生物科技有限公司测序。
1.3.3 SNPs筛查及数据分析 利用BioEdit 7.0.5软件将扩增序列与参考序列比对,查找双峰(突变位点)。利用直接测序法验证突变位点,并判定基因型。
统计不同基因型个体数量,利用PIC_CALC、Popgen 32、SPSS 17.0等软件分析多态指数,Hardy-Weinberg平衡检测及进行关联性分析。
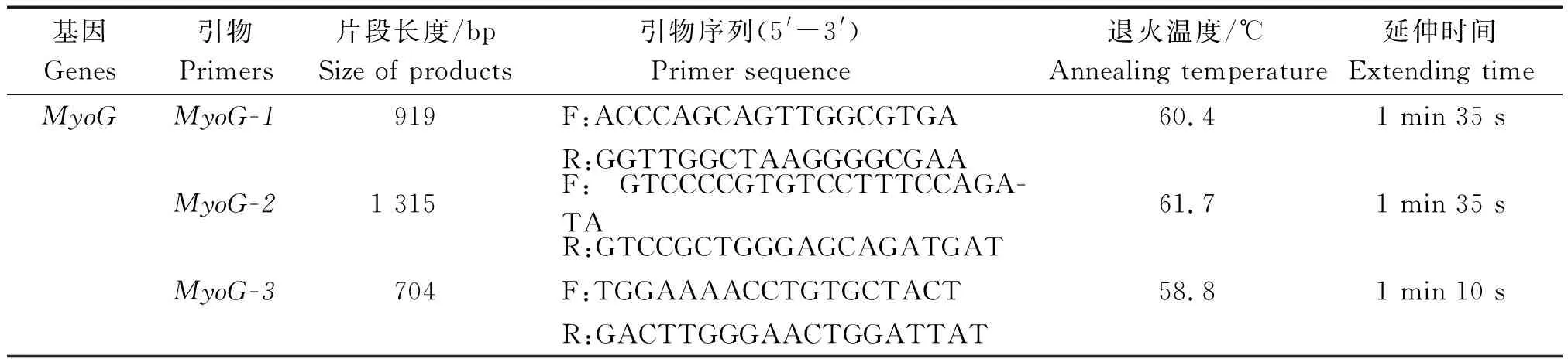
表2 候选基因引物信息Tab.2 Information of primer in candidate gene
2 结果与分析
2.1 牦牛体尺性状比较
从286头牦牛样品中,筛选年龄结构相同的牦牛个体进行体尺性状比较。由表3可知,申扎牦牛体高、体斜长、胸围、管围和体质量等指标均明显小于麦洼牦牛、类乌齐牦牛和帕里牦牛。申扎和斯布2个牦牛类群体质量及体尺指标接近,申扎牦牛在西藏当地称为矮小牦牛,群体个体均较小,而斯布牦牛称为矮脚牦牛,其肢长指数较小,因其在地理条件、生态环境较为相近且年降水量稀少导致植被及牧草长势较差从而影响其发育。帕里牦牛体高、胸围和体质量指标均优于其他类群。5个类群中,公牦牛各项体尺指标普遍大于母牦牛,但在斯布牦牛体质量指标中,母牦牛的体质量明显大于公牦牛。牦牛的生长与气候及牧草生长情况密切相关。
表3 牦牛类群的体尺性状方差分析(平均数±标准差)Tab.3 Analysis of variance on growth traits in yak
注:不同字母表示差异显著(P<0.05);表中数据为平均数±数准差。表4,7同。

体尺指数是衡量牦牛发育完全的重要参考标准,其中,体长指数表明高和长相对发育程度,胸围指数说明胸部宽和深相对发育程度,管围指数反映骨骼的发育程度。各相关指数计算方法均为与体高的百分比[11]。由表4可知,麦洼牦牛和类乌齐牦牛各项指数较接近,类乌齐牦牛胸围指数高于其他4个类群,说明其胸部肌肉发育较好。麦洼牦牛和类乌齐牦牛雌性个体的体长、胸围指数较接近,2个品种均具有较典型的乳肉兼用体型。申扎牦牛体长指数较小但管围较大,与实际情况相符。帕里牦牛胸围和管围指数较其他牦牛类群偏低,与体型特征相符。
表4 五个牦牛品种(类群)平均体尺指数比较(平均数±标准差)Tab.4 Comparison body size average index of five yak %
2.2 MyoG基因的多态性分析
2.2.1 PCR 产物检测 扩增目的片段,1.2%琼脂糖凝胶电泳检测(图1)。扩增产物大小与预期扩增片段长度一致。

图1 MyoG基因PCR扩增Fig.1 The amplification result of MyoG from PCR
2.2.2 序列分析 将测序结果与参考序列比对、校正,根据峰值图筛查SNPs位点,发现MyoG基因存在4个SNPs(图2),均位于内含子区域,分别为g.757 T>C、g.662 G>A、g. 539 A>G和g. 2216 A>G。利用DNAMAN 5.0对测序结果比对分析,判定个体基因型(图2)。其中,g.757 T>C包括CC、CT、TT共3种基因型,g.662 G>A、g. 539 A>G均检出AA、AG和GG 共3种基因型,g. 2216 A>G在麦洼、类乌齐和申扎牦牛类群存在AA、AG基因型,帕里牦牛和斯布牦牛包含基因型 AA、AG和GG。
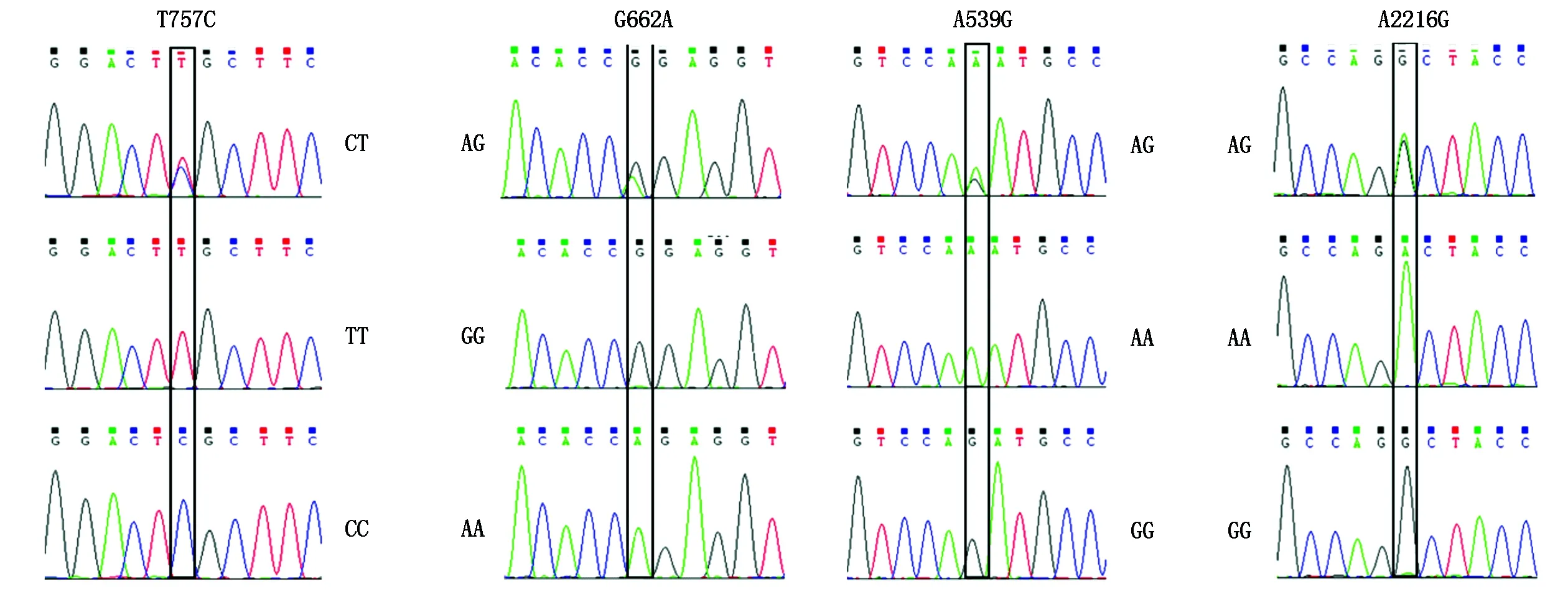
图2 牦牛MyoG 基因 757,662,539,2 216 bp 处碱基变异Fig.2 The bases variation of the MyoG gene at positions 757,662,539,2 216 bp in yak
2.2.3MyoG基因遗传学分析 牦牛MyoG基因SNP位点基因型频率和基因频率如表5所示。g.757 T>C位点,基因型CT在类乌齐牦牛、申扎牦牛和帕里牦牛类群为优势基因型;TT基因型在麦洼牦牛和斯布牦牛为优势基因型;CC基因型在5个牦牛类群中的分布频率最低。位点g.662 G>A,杂合基因型AG在类乌齐牦牛、申扎牦牛和帕里牦牛类群分布频率分别为0.50,0.51和0.65,为优势基因型;GG基因型在麦洼牦牛和斯布牦牛中频率分别为0.55和0.48,为优势基因型;AA基因型在5个牦牛类群中的分布频率最低。g. 539 A>G位点AG型在类乌齐牦牛、申扎牦牛和帕里牦牛类群中分布频率分别为0.50,0.51和0.65;AA在麦洼牦牛和斯布牦牛中为优势基因型。位点g. 2216 A>G,AA型在5个牦牛类群中均为优势基因型。
牦牛MyoG基因SNPs位点的群体遗传多态性如表6所示。根据经典多态信息含量评估模型(PIC<0.25为低度多态;0.25

表5 牦牛MyoG基因SNPs位点基因型及基因频率Tab.5 Gene frequency and genotype frequency of SNPs in MyoG gene

表6 牦牛MyoG基因SNPs位点的遗传多态性Tab.6 Genetic polymorphism of SNP sites of MyoG gene in yak
2.2.4MyoG基因多态性与牦牛生长性能的关联性分析 运用SPSS 17.0建立最小二乘线性模型分析MyoG基因多态位点不同基因型与牦牛体高、体斜长、胸围、管围及体质量等生长性状的相关性。由表7可知,位点g.757 T>C、g.662 G>A和g. 539 A>G均与体高相关(P<0.05)。位点g.757 T>C中CC基因型个体体高显著高于CT基因型和TT基因型,g.662 G>A位点中AA基因型个体体高显著高于AG和GG型个体,在位点g. 539 A>G中,GG基因型个体体高显著高于AG基因型和AA基因型。g.2216 A>G与生长性状不相关,无统计学差异(P>0.05),但该位点中GG基因型在体斜长和体质量指标较其他位点有明显差异,可以作为影响因子进行相关研究。

表7 MyoG基因多态位点与牦牛生长性状的关联分析Tab.7 The association analysis the polymorphic locus of MyoG gene and growth traits
3 讨论
3.1 不同牦牛类群体尺指标比较
生长性状是畜牧业生产重要的性状指标,是衡量育种价值及经济效益的重要指标,寻找相关基因分子标记可缩短对生长性状的选育周期[12]。申扎牦牛体高、体斜长、胸围、管围及体质量等指标均明显小于麦洼牦牛、类乌齐牦牛和帕里牦牛,这与牦牛所处生态环境及气候条件有关,不同生态环境与草场、植被类型及长势显著相关,也直接影响牦牛的采食量和生长发育。
类乌齐牦牛分布在西藏自治区昌都市类乌齐县,海拔高度4 500 m,光照充足,但昼夜温差大,属高原温带半湿润性气候,俗称“西藏小瑞士”,属藏东牦牛产业带,以牧业为主,农、林相结合,经济较为发达。类乌齐牦牛肉质鲜嫩,膘肥体壮,类乌齐牦牛肉被列为地理标志保护产品,且因其遗传多样性丰富,作为遗传资源通过农业资源委员会鉴定。麦洼牦牛分布于四川省阿坝藏族自治州红原县、若尔盖县等地,平均海拔3 600 m,太阳辐射强度大且日照时间充足,气候类型为高原寒温带季风气候,是中国草地型优良地方品种,是典型乳肉兼用型品种。斯布牦牛以上体尺指标与申扎牦牛接近,申扎牦牛主产于那曲地区申扎县平均海拔4 450 m,属高原亚寒带半干旱季风气候,寒冷干旱[12],而斯布牦牛主产于拉萨市墨竹工卡县斯布村,平均海拔4 000 m,属高原温带半干旱季风气候区,高寒干燥,年温差小而昼夜温差大[13],申扎和斯布牦牛类群在地理条件、生态环境较为接近且年降水量稀少导致植被及牧草长势较差,牧草作为牦牛主要食物来源,直接影响牦牛个体生长发育。而帕里牦牛产于亚东县帕里地区,处于吐蕃南部、喜马拉雅山脉中段南麓,平均海拔4 640 m,属高原温带季风半湿润气候,气温日差较大,年日照时数2 663.8 h,降水充沛,物产丰富[14],使帕里牦牛体高、胸围和体质量指标存在一定的优势。5个牦牛类群,公牦牛各项体尺指标普遍大于母牦牛,但在斯布牦牛体质量指标中,母牦牛的体质量明显大于公牦牛,牦牛的生长与气候及牧草生长情况密切相关,同时也因选取试验用牦牛公母数量差异有关,存在误差。
3.2 牦牛MyoG基因多态性分析
MyoG是重要的成肌调节因子,其表达水平对肌细胞生成、融合及肌肉组织生长均产生重要影响,对骨骼肌发生起重要调节作用[15-17]。近年来,许多研究对家畜、家禽MyoG基因多态位点进行挖掘分析,并进一步探究SNPs位点与相关性状的关联性。赵忠海等[18]利用MyoG和MEF2a基因多态性聚合效应对鸭屠宰性状的影响进行分析,发现MyoG基因 g.1131C>T 和 g.2204G>A 突变分别对胸肌率、体质量和全净膛质量有显著影响。杨又兵[19]对猪2个资源家系进行RFLP-MspⅠ多态性扫描,显示MyoG基因多态性与猪瘦肉率显著相关;朱超杰等[20]研究发现,草原红牛MyoG基因外显子1上SNP位点与体高、体斜长和十字部高均显著相关。薛梅等[21]研究认为,MyoG基因可作为黄牛体尺性状标记候选基因。韩银仓等[22]研究表明,MyoG基因对藏羊生长发育有一定影响。白俊艳等[23]研究表明,MyoG基因外显子1对羊肉的水分和色泽有影响。栾兆进等[16]研究报道,MyoG基因表达影响绵羊肌内脂肪的沉积。研究显示,MyoG基因不同SNPs位点与家畜和家禽骨骼、肌肉及体尺、产肉质量、生长速度及肉品质等经济性状显著相关。目前,对牦牛MyoG基因研究相对较少,仅林亚秋等[24]对九龙牦牛MyoG基因cDNA区进行克隆并在不同组织中进行表达分析。
本研究,共发现4个SNP位点,均位于内含子区域,这与王敏强等[25]对牦牛、黄牛和水牛MyoG基因外显子1和5′侧翼区部分序列研究中,在牦牛该区域内并未检测到多态位点的研究结果一致,说明该基因外显子区域较稳定;卡方适合性检验显示,4个位点在不同牦牛类群χ2值均符合Hardy-Weinberg平衡,说明牦牛在生长发育过程中具有相对稳定性,但对生产性能的提高有一定阻碍,需适度进行人工干预。在位点g.757 T>C、g.662 G>A和g. 539 A>G中分布均为中度多态(0.25
