芍药苷通过JAK2/STAT3信号通路抑制高糖诱导的RAW264.7巨噬细胞激活
2019-01-05蔡建月邵云侠吴永贵
蔡建月,邵云侠,王 坤,吴永贵
(安徽医科大学第一附属医院肾内科,安徽 合肥 230022)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者最常见且最严重的并发症之一,相关证据表明,炎症是DN病理学的重要特征[1]。巨噬细胞介导免疫炎性反应,通过增加促炎因子和趋化因子,加速DN的进展,抑制这些因子可以减少肾脏损伤[2]。JAK2/STAT3信号途径是一个高度进化保守的途径,参与生长发育、细胞间的通信,与Ras、MAPK等信号通路存在交互作用,可以增强巨噬细胞中肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白细胞介素1β(interleukin 1β,IL-1β)、 单核细胞趋化因子1(monocyte chemoattractant protein 1,MCP-1)和促炎细胞因子诱生型一氧化氮合酶(inducible nitric oxide synthase,iNOS)基因转录水平。Brosius等[3]报道了在DN患者中,JAK2/STAT3基因表达相比于正常组明显升高。芍药苷(paeoniflorin,PF)是白芍总苷(total glucosides of paeony,TGP)主要活性成分。课题组前期研究表明,TGP在糖尿病动物模型中可抑制肾脏JAK2/STAT3信号通路的激活,以及巨噬细胞浸润[4]。本研究在体外探讨PF是否通过JAK2/STAT3信号通路,抑制高糖(high glucose,HG)诱导的巨噬细胞激活,为DN防治提供新思路。
1 材料与方法
1.1材料
1.1.1细胞株 RAW264.7巨噬细胞系,购自中科院细胞库。
1.1.2试剂 DMEM培养基、胎牛血清(FBS)(加拿大WISENT);D-葡萄糖、甘露醇(美国Sigma公司);CCK-8试剂盒(南京诺唯赞生物科技);反转录试剂盒(美国Promega公司);实时荧光定量PCR试剂盒(美国Bio-Rad公司);实时荧光PCR引物(上海生工、美国GeneCopoeia);兔抗p-JAK2、JAK2、p-STAT3、STAT3抗体(美国CST公司);小鼠抗β-actin单克隆抗体、辣根过氧化物酶标记的羊抗兔IgG或羊抗小鼠IgG(武汉三鹰);增强化学发光(ECL)试剂盒(美国Thermo Scientific公司);小鼠TNF-α、小鼠IL-1β ELISA试剂盒(美国R&D公司);小鼠MCP-1 ELISA试剂盒(北京瑞博奥科技)。
1.1.3仪器 细胞培养箱 (美国Thermo公司),超净工作台(苏州市苏信净化设备厂),冷冻高速离心机(德国Eppendorf公司),台式冷冻离心机(德国Backman公司),酶标仪、梯度PCR仪、荧光定量PCR检测系统(美国Bio-Rad公司)。
1.2方法
1.2.1PF细胞毒性检测 将RAW264.7细胞以1×104个/孔接种于96孔板中,不同浓度PF(10-8~10-3mol·L-1)孵育细胞24 h,10 μL CCK-8试剂混合到每个孔中,再培养4 h。酶标仪测量490 nm处的吸光度,对照组细胞中的平均光密度值设定为100%生存力,处理结果表示为对照的百分比。
1.2.2siRNA转染 JAK2、STAT3 6条siRNA由广州锐博生物科技有限公司设计合成,序列见Tab 1。参考Invitrogen公司LipofectamineTM2000转染说明书操作:用无血清培养基稀释siRNA至浓度50 nmol·L-1,取1 μL LipofectamineTM2000稀释于50 μL培养基中,室温孵育5 min,将上述混合,室温静置20 min。将细胞接种至24孔板培养孔中,使转染时细胞密度达30%~50%,在每孔细胞中加入100 μL转染液,37 ℃培养48 h后,Western blot分别检测细胞JAK2和STAT3表达量,筛选出干扰效率最高的siRNA进行后续实验。

Tab 1 JAK2/STAT3 siRNA sequence report
1.2.3PF和JAK2/STAT3 siRNA干预 RAW264.7细胞用低糖(low glucose,LG)DMEM培养基,于37 ℃、 5% CO2和完全饱和湿度的细胞培养箱中常规培养,生长达80%融合的细胞,按照1×106个/孔细胞接种于6孔板,同步化培养(糖浓度为5 mmol·L-1)24 h后,分9组进行处理:LG(5 mmol·L-1)、HG(25 mmol·L-1)、HG+PF、LG+JAK2 siRNA、JAK2 siRNA+HG、 JAK2 siRNA+HG+PF、LG+STAT3 siRNA、STAT3 siRNA+HG、STAT3 siRNA +HG+PF。其中,siRNA转染48 h后,加HG刺激24 h,PF(10-5mol·L-1)预先干预细胞30 min,再加HG(25 mmol·L-1)刺激24 h。
1.2.4Western blot检测 收集细胞,冰上裂解后提取总蛋白,测定各组蛋白浓度。每个蛋白样品取40 μg上样,经8%~12% SDS-PAGE电泳,恒流转至硝酸纤维素膜上,5%脱脂牛奶37 ℃封闭2 h,加一抗JAK2(1 ∶1 000)、p-JAK2(1 ∶1 000)、STAT3(1 ∶1 000)、p-STAT3(1 ∶1 000)、β-actin(1 ∶35 000),4 ℃孵育过夜,PBST洗膜后,加入辣根过氧化物酶标记二抗(1 ∶8 000),37 ℃孵育45 min, PBST洗膜后,ECL显影、曝光。用Western blot条带光密度进行比较分析。
1.2.5MCP-1趋化实验 用无血清培养基同步化培养细胞24 h。将收集细胞接种于Transwell小室中,每孔1×105个细胞,培养基50 μL,按照实验分组,在各组的Transwell下室中分别加入重组小鼠MCP-1,终浓度为20 μg·L-1,培养24 h。吸弃上清,Transwell上室放入预冷乙醇中固定20 min,切去上室底部薄膜,结晶紫染色,轻铺于载玻片上,显微镜下拍照,然后用PBS溶液漂洗2次,薄膜置于33%的冰醋酸中,回收结晶紫染色液,酶标仪570 nm测定各组OD值。
1.2.6实时定量PCR 使用TRIzol试剂提取各组细胞总RNA,以RNA为模板反转录成cDNA。实时定量PCR采用SYBR Green法。GAPDH引物序列上游引物:5′-ACCCCAGCAAGGACACTGAGCAAG-3′,下游引物:5′-GGCCCCTCCTG-TTATTATGGGGGT -3′;TNF-α引物序列上游引物:5′-CCCTCCTGGCC-AACGGCATG -3′,下游引物:5′-TCGGGGCAGCCTTGTCCCTT -3′。下列引物由Gene-Copoeia公司合成:MCP-1:货号MQPO27672; IL-1β:货号MQPO27422; iNOS:货号MQPO29793。反应条件为:95 ℃预变性10 min,进入循环;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,扩增35个循环;每组设3个复孔,采用2-△△Ct法分析相对表达量。
1.2.7ELISA法检测培养上清液细胞因子含量 实验结束后,吸取各组细胞培养上清液,5 000 r·min-1、4 ℃离心10 min,吸取上清液,-80 ℃保存。ELISA试剂盒测定培养基中TNF-α、IL-1β、MCP-1含量。
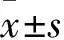
2 结果
2.1PF对巨噬细胞活性的影响为了研究PF对HG刺激下巨噬细胞活性的影响,将RAW264.7细胞用不同浓度PF干预24 h后,CCK-8法检测细胞活性。如Fig 1所示,与没加PF的对照组相比,10-8~10-4mol·L-1PF未表现出对巨噬细胞的毒性(P>0.05)。PF(10-8~10-4mol·L-1)干预24 h对巨噬细胞活性无影响,可用于后续的实验研究。
2.2siRNA的筛选将细胞通过不同的处理分组:没有转染的细胞(control组);加入Lipo 2000(control+lipo组);转染阴性对照siRNA载体(control+siRNA control组);转染Lipo2000+靶基因siRNA(control+siRNA组)。Fig 2的Western blot结果显示,JAK2 siRNA转染中,siRNA3片段干扰后的JAK2蛋白表达量减少最明显;STAT3 siRNA转染中,siRNA3片段干扰后的STAT3蛋白表达量减少最明显(P<0.01),即沉默效果最好。

Fig 1 Viability analysis of RAW264. 7 cells after
*P<0.05vsLG group

Fig 2 Expression of JAK2,STAT3 protein determined by Western blot in RAW264.7 macrophages transfected
1:Control;2:Control+lipo;3:Control+siRNA control;4:Control+siRNA1;5:Control+siRNA2;6:Control+siRNA3.**P<0.01vscontrol group.
2.3HG刺激对JAK2、STAT3磷酸化水平的影响Fig 3、4的Western blot结果显示,RAW264.7细胞p-JAK2/JAK2、p-STAT3/STAT3水平呈葡萄糖浓度(5、20、25、30、35 mmol·L-1)和时间(0 min、5 min、15 min、30 min、1 h、3 h、6 h、12 h、24 h)依赖性。随葡萄糖浓度增加,JAK2、STAT3蛋白磷酸化水平增加,均在25 mmol·L-1达高峰;蛋白磷酸化程度随时间延长而升高,p-JAK2/JAK2在15 min达到高峰,p-STAT3/STAT3在24 h达到高峰(P<0.01)。甘露醇作为高糖的渗透压对照,对JAK2、STAT3的磷酸化无影响。

Fig 3 Effects of HG with different concentrations
*P<0.05,**P<0.01vslow glucose group(5 mmol·L-1)
2.4PF对HG刺激下JAK2、STAT3磷酸化水平的影响PF干预细胞30 min后,用HG刺激细胞,Fig 5的Western blot结果表明,与HG组相比,p-JAK2/JAK2、p-STAT3/STAT3水平呈PF浓度(10-8、10-7、10-6、10-5、10-4mol·L-1)依赖性,当PF的浓度为10-5mol·L-1时,可明显降低上述磷酸化水平(P<0.05,P<0.01)。
2.5PF降低HG诱导的巨噬细胞趋化和迁移Fig 6趋化实验显示,HG刺激可以增加MCP-1对RAW264.7细胞的趋化,导致巨噬细胞迁移。JAK2/STAT3 siRNA组巨噬细胞趋化与LG组间差异无统计学意义,HG组细胞迁移相比LG组明显增加(P<0.01);与HG组相比,JAK2 siRNA+HG组、STAT3 siRNA+HG组无差异,HG+PF组细胞迁移明显减少(P<0.01);与JAK2/STAT3 siRNA+HG组相比,PF干预可降低MCP-1诱导的巨噬细胞趋化和迁移(P<0.01)。
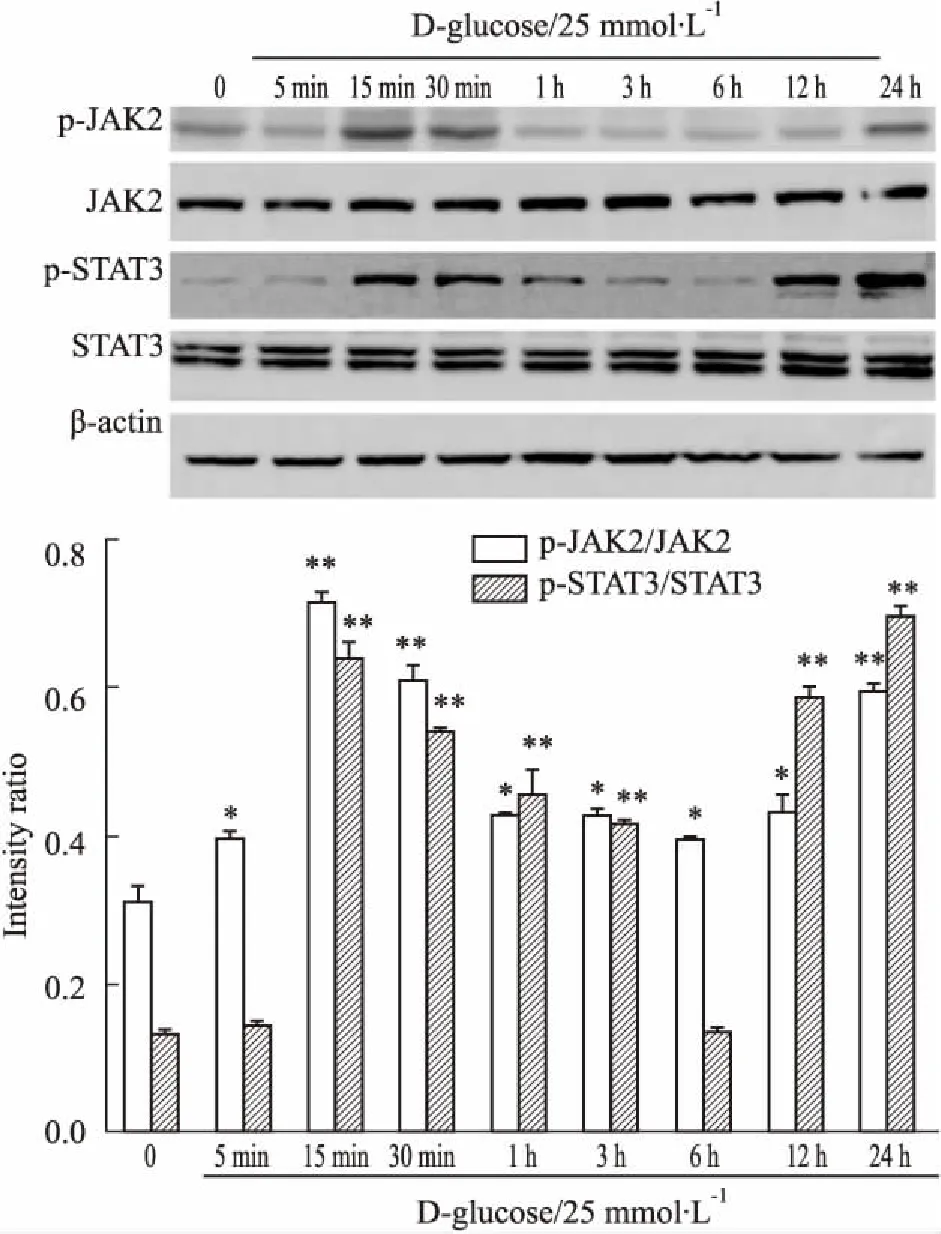
Fig 4 Effects of HG with different time on p-JAK2,p-STAT3 protein expression in RAW264.7
*P<0.05,**P<0.01vscontrol group(0 h)
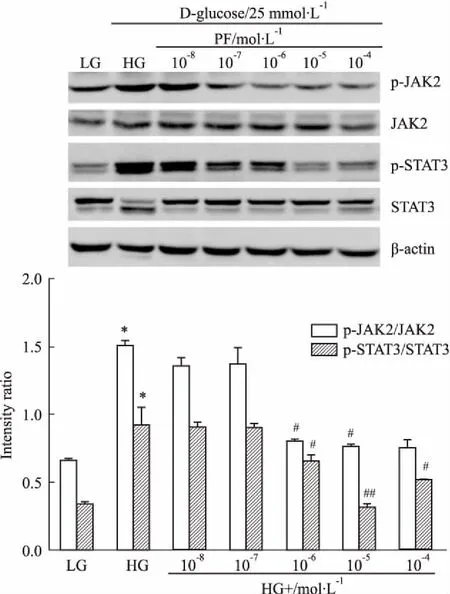
Fig 5 Effects of PF on p-JAK2/JAK2,p-STAT3/STAT3 protein in HG-induced RAW264.7 macrophages
*P<0.05vsLG group;#P<0.05,##P<0.01vsHG group

Fig 6 RAW264.7 macrophages’ invasion and migration through MCP-1 determined by Transwell chamber assay(A), and OD value detection of migration cell crystal violet staining solution (B)
1:LG;2:LG+JAK2 siRNA;3:LG+STAT3 siRNA;4:HG;5:HG+PF;6:JAK2 siRNA+HG;7:JAK2 siRNA+HG+PF;8:STAT3 siRNA+HG;9:STAT3 siRNA+HG+PF;**P<0.01vsLG group;##P<0.01vsHG group;△△P<0.01vssiRNA group
2.6PF与JAK2/STAT3siRNA抑制HG刺激巨噬细胞中炎症因子转录和分泌实时定量PCR和ELISA结果显示(Fig 7、8),HG刺激可明显增加RAW264.7细胞中iNOS和炎症因子(TNF-α、IL-1β、MCP-1)mRNA水平,以及细胞培养液中炎症因子的分泌(P<0.01)。与HG组比较,JAK2/STAT3 siRNA和PF干预可降低iNOS及炎症因子(TNF-α、IL-1β、 MCP-1)mRNA水平和炎症因子的分泌(P<0.01),即抑制HG刺激RAW264.7细胞的促炎反应。PF可在基因沉默基础上,进一步下调炎症因子的水平(P<0.01)。
Fig 7 Expression of iNOS,TNF-α,IL-1β and MCP-1 mRNAdetermined by real-time PCR in RAW264. 7macrophages
1:LG;2:LG+JAK2 siRNA;3:LG+STAT3 siRNA;4:HG;5:HG+PF;6:JAK2 siRNA+HG;7:JAK2 siRNA+HG+PF;8:STAT3 siRNA+HG;9:STAT3 siRNA+HG+PF;**P<0.01vsLG group;##P<0.01vsHG group;△△P<0.01vssiRNA group
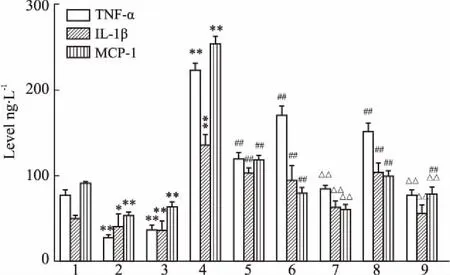
Fig 8 Levels of TNF-α,IL-1β and MCP-1 measured by
1:LG;2:LG+JAK2 siRNA;3:LG+STAT3 siRNA;4:HG;5:HG+PF;6:JAK2 siRNA+HG;7:JAK2 siRNA+HG+PF;8:STAT3 siRNA+HG;9:STAT3 siRNA+HG+PF;*P<0.05,**P<0.01vsLG group;##P<0.01vsHG group;△△P<0.01vssiRNA group
2.7PF影响HG刺激巨噬细胞中JAK2、p-JAK2、STAT3及p-STAT3蛋白表达Fig 9的Western blot结果显示,HG刺激增加RAW264.7细胞中p-JAK2/JAK2、p-STAT3/STAT3水平。与HG组相比,HG+PF组JAK2、STAT3蛋白磷酸化水平明显降低(P<0.01)。与JAK2/STAT3 siRNA+ HG组相比,PF干预可同时降低JAK2、STAT3蛋白磷酸化水平(P<0.01)。

Fig 9 Expression of p-JAK2/JAK2,p-STAT3/STAT3 protein determined by Western blot in RAW264.7
1:LG(5 mmol·L-1);2:HG(25 mmol·L-1); 3:HG+PF; 4:LG+JAK2 siRNA; 5:JAK2 siRNA+HG; 6:JAK2 siRNA+HG+PF; 7:LG+STAT3 siRNA; 8:STAT3 siRNA+HG; 9:STAT3 siRNA +HG+PF.*P<0.05,**P<0.01vsLG group;##P<0.01vsHG group;△P<0.05,△△P<0.01vssiRNA group.
3 讨论
PF是一种从芍药根提取的单萜糖苷,已被普遍用于缓解炎症、闭经、腹痛等症状[5]。TGF作为抗炎免疫调节药物可改善类风湿性关节炎患者的病情。炎症也是促进DN发生、发展的关键因素。Fu等[6]研究证实,PF可降低糖尿病大鼠尿蛋白,抑制肾小球肥大,减轻巨噬细胞肾内浸润活化和炎症因子的表达,延缓DN病程进展,但机制不明。
在DN早期阶段,巨噬细胞聚集在肾小球和间质中,肾巨噬细胞积累量与肾小球硬化程度、肌酐血清水平、蛋白尿和间质性纤维化程度密切相关[7]。MCP-1可以趋化巨噬细胞, DN患者肾小管上皮细胞中高表达MCP-1,可使大量巨噬细胞在皮质小管外周聚集,导致DN患者肾脏炎症和纤维化的形成[8]。我们以RAW264.7细胞为研究对象,以MCP-1作为趋化因子,发现HG刺激下巨噬细胞迁移明显增加,而PF干预可抑制HG刺激的巨噬细胞迁移增加。巨噬细胞可以促进炎性反应,产生大量iNOS及炎症因子,促进组织损伤。本实验发现,HG刺激RAW264.7细胞iNOS mRNA的表达,诱导产生大量促炎因子及趋化因子(TNF-α、IL-1β、MCP-1),而PF干预可以抑制HG刺激的RAW264.7细胞的激活。
JAK/STAT信号通路是介导炎症反应的重要通路之一。细胞因子与JAKs受体结合后,引起受体分子的二聚化,使得与受体偶联的JAKs发生酪氨酸磷酸化,活化的JAKs催化受体本身的酪氨酸残基发生磷酸化修饰,形成相应的STATs停靠位点,使STATs通过SH2结构域与受体结合,并在JAKs的作用下实现其磷酸化,然后入核,并激活相应的基因转录和表达[9]。研究显示,在高脂饮食诱导的小鼠动脉粥样硬化模型中,可通过抑制骨髓来源巨噬细胞内的JAK2/STAT3通路,下调炎症因子的分泌,从而缓解动脉粥样硬化[10]。姜黄素可以抑制JAK2/STAT3激活,减少炎症反应,防治胰腺炎相关肾损伤[11]。已有研究证明,JAK2/STAT3途径的调节与免疫炎症反应密切相关。本研究发现,HG刺激下p-JAK2、p-STAT3蛋白表达明显增加,PF干预可以下调HG刺激的JAK2、STAT3磷酸化水平的升高。JAK2/STAT3 siRNA基因沉默明显下调HG刺激的TNF-α、IL-1β、MCP-1、iNOS mRNA的表达及炎症因子的释放,PF干预与基因沉默的结果相似,表明PF可以通过下调HG刺激的JAK2、STAT3磷酸化水平,从而抑制JAK2/STAT3信号通路发挥抗炎作用。
最近的研究表明,PF可以通过抑制p38、ERK1/2 MAPK 和 NF-κB信号通路,拮抗血管平滑肌细胞中炎症因子的产生,抑制MCP-1的表达,减轻血管炎症[12]。在HG诱导的糖尿病视网膜病变中,PF可通过抑制TLR4/NF-κB通路,调节视网膜小胶质细胞的炎症反应,这与我们前期在DN中的研究结果相似[13-14]。本研究中,在JAK2/STAT3基因沉默基础上给予PF干预,可以进一步抑制巨噬细胞相关活性因子的产生。趋化实验中,PF干预可以抑制HG刺激下MCP-1对巨噬细胞的趋化迁移,而JAK2/STAT3基因沉默与HG组差异无显著性,推测JAK2/STAT3信号通路可能并不影响巨噬细胞的趋化功能,PF对巨噬细胞激活的调节作用除了通过JAK2/STAT3途径外,还与其他信号通路相关。我们前期的研究发现,PF可以抑制巨噬细胞中TLR2/4通路的激活,抑制巨噬细胞向M1型促炎表型的转化,从而抑制相关炎症因子的表达[14]。PF是否也通过上述p38、ERK1/2 MAPK、NF-κB等信号通路影响巨噬细胞激活,需要进一步研究论证。
综上所述,本研究证明HG刺激了RAW264.7细胞激活,增加巨噬细胞的趋化。而PF干预可明显下调HG刺激产生的效应,其机制可能与抑制JAK2/STAT3信号通路相关,本研究为PF防治DN提供了理论依据。PF对巨噬细胞激活的影响还可能与其他炎症通路相关,仍需进一步探究。
(致谢:本实验于安徽医科大学第一附属医院肾内科实验室完成,实验过程中孟晓明教授给予悉心指导与大力支持,在此表示衷心的感谢。)
