甘草酸二铵改善Con A致小鼠肝损伤的作用研究
2019-01-03仲金秋曹玉珠徐宏江吴媛媛张婷婷李晓曼陈文星王爱云
仲金秋,曹玉珠,徐宏江,吴媛媛,张婷婷,李晓曼,陈文星,2,王爱云,2*,陆 茵,2*
1南京中医药大学 江苏省中药药效与安全性评价重点实验室;2南京中医药大学 江苏省中医药防治肿瘤协同创新中心; 3中国药理学与毒理学研究所 正大天晴药业集团股份有限公司,南京210023
肝损伤是一类严重危害人类健康的疾病,是多种肝脏疾病共有的一种病理状态,当损伤程度超过其代偿能力时,则出现临床和生化的特征性改变;肝损伤的长期存在往往能够导致肝纤维化、肝硬化、甚至肝癌的发生,因此防治肝损伤是临床肝病治疗的主要环节之一[1]。
甘草酸二铵(Diammonium glycyrrhizinate,DG)是由甘草根中提取的成分,在我国应用于治疗肝炎已有数千年的历史。因其较甘草酸(Glycyrrhizin,GL)稳定性更好、溶解度更高且生物活性更强,目前已广泛应用于临床[2]。甘草酸二铵具有广泛的药理活性,包括抗炎、抗生物氧化、膜保护和免疫调节作用,并且具有类固醇类激素的作用等;口服摄入后,甘草酸二铵代谢为甘草酸,然后在肠道菌群的作用下水解成甘草次酸(Glycyrrhetinic acid,GA):18α-甘草次酸(18α-Glycyrrhetinic acid,18α-GA)和18β-甘草次酸(18β-Glycyrrhetinic acid,18β-GA),由肠道吸收。研究表明,18α-GA在肝脏和十二指肠中的浓度明显高于18β-GA,是保肝和抗炎作用中的主要有效成分[3]。
甘草酸二铵广泛应用于临床肝病治疗,但目前对于其保肝机制研究报道并不多。本研究首次采用Con A诱导的小鼠肝损伤模型研究甘草酸二铵的保肝作用,并利用分子生物学手段探索其可能的作用机制,为其在临床的应用提供实验依据。
1 材料与仪器
1.1 实验动物
SPF级雄性ICR小鼠60 只,18~20 g,上海杰思捷实验动物有限公司,许可证号:SCXK(沪)2013-0006,动物合格证号:2010002607994。
SPF级雄性WISTAR大鼠20 只,180~220 g,扬州大学比较医学中心,许可证号:SCXK(苏)2012-0004,动物合格证号:NO.201613691。
1.2 药物
甘草酸二铵肠溶胶囊(江苏正大天晴药业股份有限公司);水飞蓟素胶囊(德国马博士大药厂);双环醇片(北京协和药厂);刀豆蛋白(sigma);双环醇(中检所);18α-GA(江苏正大天晴药业股份有限公司,TQ0813-s03);水飞蓟宾(上海源叶生物科技有限公司);18β-GA(≥98%)和苦参碱(≥98%)购自上海源叶生物科技有限公司。
1.3 试剂
谷草转氨酶测定试剂盒(IFCC法)、谷丙转氨酶测定试剂盒(IFCC法)(日本和光纯药工业株式会社);活化型半胱氨酸天冬氨酸蛋白酶-3(cleaved Caspase-3)、B淋巴细胞瘤-2基因编码蛋白(BCL-2)、BCL2相关X蛋白(Bcl-2 Associated X Protein,BAX)、多腺苷二磷酸核糖聚合酶(PARP)、γ-干扰素(IFN-γ)抗体(美国Cell Signaling Technology 公司);甘油醛-3-磷酸脱氢酶(GAPDH)、环氧合酶-2(COX-2)、羊抗兔IgG(H+L)-HRP抗体(巴傲得生物科技有限公司);转化生长因子-β1(TGF-β1)、环氧合酶-1(COX-1)、半胱氨酸天冬氨酸蛋白酶-1(Caspase-1)抗体(Abcam公司);白细胞介素-1β(IL-1β)、白介素-6(IL-6)、肿瘤坏死因子(TNF-α)(万类生物科技有限公司)、白细胞介素-10(IL-10)(美国Affinity Biosciences公司)。
1.4 仪器
台式冷冻离心机(美国Beckman公司,Allegra 30R);石蜡包埋仪(德国LEICA公司,EG 1150H+C);石蜡切片机(德国LEICA公司,RM2245);全自动生化分析仪(HITACHI,日立7020);体视荧光显微镜(德国 LEICA 公司,M205FA);恒温培养箱(上海笃特科学仪器有限公司,HWP-9162);凝胶电泳仪(来自美国Bio-Rad,Mini Protean 3 Cell);凝胶成像系统(美国Bio-Rad公司,ChemiDocTMXRS+)。
2 实验方法
2.1 小鼠模型的给药与制备
实验小鼠适应性饲养5 天后,称重,随机分为5 组,每组12 只,分别为空白组(Control),模型组(Con A),甘草酸二铵组(DG),水飞蓟素对照组(Silymarin),双环醇对照组(Bicyclol)。甘草酸二铵、水飞蓟素和双环醇的临床给药剂量,分别为450、280和75 mg/d,按体表面积折算的等效剂量比值(小鼠临床等效剂量=临床日用药量(0.0026/0.02)计算药物的临床等效剂量,分别为58.5、36.4、9.75 mg/kg。各治疗组小鼠分别灌胃给药,给药体积为0.1 mL/10 g;空白组和模型组给予等体积生理盐水。连续给药7 天,并称重。
第8 天,小鼠称重,实验组按尾静脉单次注射Con A 30 mg/kg的药物剂量,给药体积为0.05 mL/10 g(Con A溶解于无菌生理盐水中,浓度为6 mg/mL);空白组采用同体积生理盐水处理。其后所有小鼠禁食不禁水。
2.2 小鼠处理
造模8 h后,小鼠眼眶后静脉丛采血,每只小鼠收集血液1~1.5 mL,于室温静置1 h后,4 ℃过夜。全血离心(2 500 rpm,10 min,4 ℃)后取上层血清保存待用。解剖小鼠,分离肝、脾、胸腺后立即用生理盐水冲洗并称重。计算动物的各脏器指数,脏器指数=(脏器质量/体质量)×100。每只小鼠取肝脏同一叶浸泡于4%多聚甲醛中固定过夜,后用于组织病理学检查和免疫组织化学分析。剩余部分肝脏放入-80 ℃冰箱冷冻保存,用于Western blot分析。
2.3 蛋白免疫印迹实验(Western blot)
称取50 mg肝组织中于玻璃匀浆器中,加入1 mL RIPA后置于冰上充分研磨,离心取上清液,采用BCA试剂盒进行蛋白含量测定。蛋白变性后-80 ℃冰箱保存。配制10%聚丙烯酰胺凝胶,每孔50 μg蛋白上样。电泳条件为40 mA,120 min,转膜条件为100 V,90 min。一抗BAX、BCL-2、PARP、IFN-γ、GAPDH、COX-2、cleaved Caspase-3、TGF-β1、COX-1、IL-1β、IL-6、TNF-α和IL-10的稀释比例均为1∶1 000。使用凝胶成像仪进行成像并利用Photoshop软件进行蛋白条带灰度分析。
2.4 小鼠肝组织病理学检查
肝脏组织在4%多聚甲醛中固定后,后依次进行常规脱水、石蜡包埋、切片烤片(4 μm)、HE染色。显微镜下(200×)观察组织病理变化并拍照。
2.5 免疫组织化学
将肝组织石蜡切片常规脱蜡至水,抗原修复,封闭,cleaved Caspase-3(1∶200)、COX-2(1∶200)或Caspase-1(1∶500)4 ℃孵育过夜,滴加二抗,DAB显色,苏木精复染。显微镜下(200×)拍照,每组选取肝组织切片中9个互不重叠的视野,采用Image Pro Plus 6.0软件进行图像分析。
2.6 药物与转氨酶异常大鼠血清共孵育实验
2.6.1 收集大鼠AST、ALT水平异常的血清
WISTAR大鼠适应性饲养7 天。第8 天称重,复制Con A诱导的大鼠肝损伤模型,方法同2.1。造模8 h后,通过腹腔注射10%的水合氯醛麻醉大鼠,随后采用腹主动脉取血,分离血清。
2.6.2 药物与大鼠血清共孵育[4]
配制各药物浓度为18α-GA(11、22、44、88 μg/mL)、18β-GA(11、22、44、88 μg/mL);水飞蓟宾对照组(7.5、15、30、60 μg/mL);双环醇对照组(2.5、5、10、20 μg/mL);苦参碱(10 μg/mL),均用DMSO溶解,pH7.2~7.4。取各浓度药物1 μL与AST、ALT异常升高的血清200 μL混匀,于37 ℃分别孵育0、2、4、6、8、10、12 h。一式3份。各药物终浓度如下:18α-GA(55、110、220、440 ng/mL)、18β-GA(55、110、220、440 ng/mL)、水飞蓟宾(37.5、75、150、300 ng/mL)、双环醇(12.5、25、50、100 ng/mL)、苦参碱(50 ng/mL)。差值计算公式:Normalized(AST)=AST-AST control;Normalized(ALT)=ALT-ALT control。
2.7 血清转氨酶活性检测
采用HITACHI 7020全自动生化分析仪,按厂家试剂盒说明书设置参数后检测血清中AST和ALT水平。
2.8 统计学方法
3 实验结果
3.1 甘草酸二铵对肝损伤小鼠的体质量和脏器指数的影响
如表1、表2所示,各组小鼠体质量无显著差异,但模型组小鼠肝脏、脾脏和胸腺内脏指数较空白组显著增加(P<0.001或P<0.05),而且肉眼可见小鼠肝脏、脾脏和胸腺肿大,肝脏外表面充血。而58.5 mg/kg甘草酸二铵能够显著降低Con A 诱导的小鼠肝脏指数异常(P<0.05);36.4 mg/kg水飞蓟素对小鼠的脏器指数没有影响;9.75 mg/kg双环醇能改善刀豆蛋白引起的小鼠脾脏脏器指数异常(P<0.05)。
3.2 甘草酸二铵对肝损伤小鼠的组织病理学和血清生化指标的影响
凋亡、炎症是Con A诱导急性肝损伤的重要病理机制。肝组织HE染色结果显示,空白组肝小叶结构完整,肝细胞围绕中央静脉呈放射状排列。模型组肝脏汇管区正常结构被明显破坏,细胞边界不清,胞浆呈絮状,部分细胞核缩小,炎性细胞浸润(图1A中箭头所指)。各给药组肝小叶轮廓较模型组清晰,细胞形态相对完整,部分可见轻度病变,肝细胞索排列整齐,肝组织病理学形态得到改善(图1A)。此外,我们还对空白组、模型组和甘草酸二胺组小鼠肝组织切片进行了凋亡蛋白、炎症介质的免疫组化染色。结果显示,模型组小鼠肝组织中cleaved Caspase-3的表达显著增加(P<0.01),而58.5 mg/kg甘草酸二铵能够下调肝组织中cleaved caspase-3的水平(图1B)。同时,模型组小鼠肝组织中Caspase-1和COX-2的表达升高(P<0.001)。而58.5 mg/kg甘草酸二铵能够降低caspase-1以及COX-2的表达(P<0.01)(图1C)。
表1 甘草酸二铵对Con A所致肝损伤小鼠体质量的影响Table 1 Effect of DG on the body weight of
注:与空白组比较没有差异;与模型组比较没有差异。
Note:Compared with control group,no significant difference;compared with Model group,no significant difference.

表2 甘草酸二铵对Con A所致肝损伤小鼠肝脏、脾脏和胸腺脏器指数的影响Table 2 Effect of DG on the liver,spleen and thymus viscera index of
注:与空白组比较#P<0.05;###P<0.001;与模型组比较*P<0.05。
Note:Compared with control group,#P<0.05;###P<0.001;Compared with Model group,*P<0.05.
血清转氨酶水平的检测结果与组织病理学变化结果相一致。如表3所示,模型组血清中AST和ALT水平显著升高(P<0.001),58.5 mg/kg甘草酸二铵能够降低小鼠血清中AST和ALT水平(P<0.001或P<0.01);36.4 mg/kg水飞蓟素也具有降低小鼠血清中AST和ALT的作用(P<0.05或P<0.001);但是9.75 mg/kg双环醇仅能降低小鼠血清中ALT水平(P<0.05),而对AST没有影响。
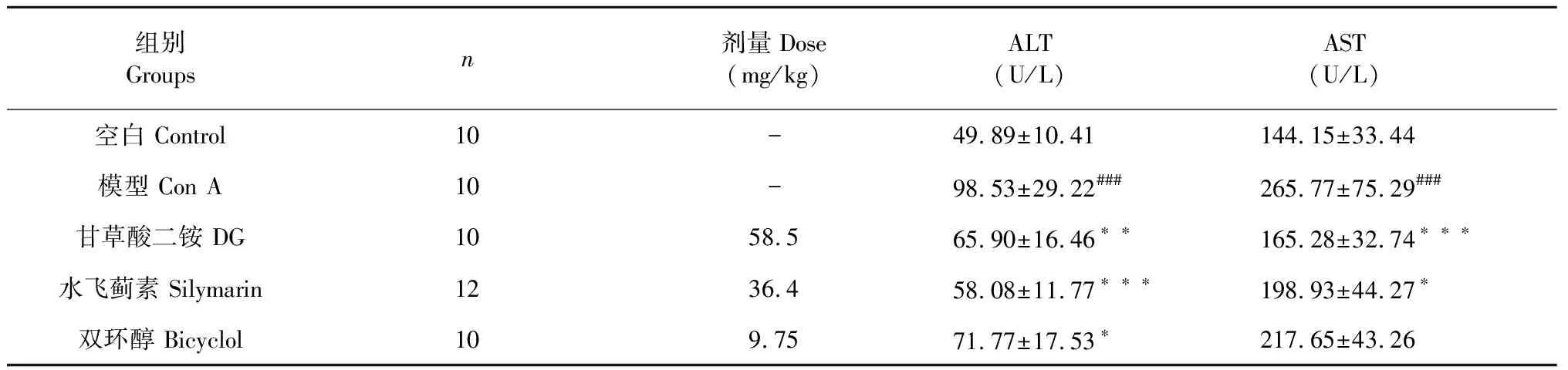
表3 甘草酸二铵对Con A所致肝损伤小鼠血清ALT和AST水平的影响Table 3 Effects of DG on the serum ALT,AST levels in mice
注:与空白组比较,###P<0.001;与模型组比较,*P<0.05;**P<0.01;***P<0.001。
Note:Compared with control group,###P<0.001;Compared with Model group,*P<0.05;**P<0.01;***P<0.001.

图1 甘草酸二铵对Con A所致肝损伤小鼠的组织病理学的影响(200x)Fig.1 Effects of DG on histopathology in mice with Con A-induced hepatic injury (200x)注:A:不同治疗组的肝组织HE染色;B:小鼠肝组织cleaved-Caspase 3的免疫组化分析;C:小鼠肝组织Caspase-1、COX-2的免疫组化分析;(a) 空白组;(b) 模型组;(c) 甘草酸二铵组;(d) 水飞蓟素对照组;(e) 双环醇对照组;与空白组比较,###P<0.001;与模型组比较,**P<0.01;***P<0.001。Note:A:Liver tissue sections from the different treatment groups were stained with hematoxylin-eosin;B:Immunohistochemistry analysis of cleaved-Caspase 3 expression in mice liver tissues;C:Immunohistochemistry analysis of Caspase-1,COX-2 expression in mice liver tissues;(a) Control group,(b) Model group;(c) DG treatment group;(d) Silymarin treatment group;(e) Bicyclol treatment group;Compared with control group,###P<0.001;Compared with Model group,**P<0.01;***P<0.001.
3.3 甘草酸二铵体外对血清中的AST、ALT水平的影响
如表4和表5所示,阳性对照药苦参碱(50 ng/mL)在与血清孵育10 h后,能够降低血清中的AST水平(P<0.001)。18α-GA、18β-GA和双环醇不能直接降低血清中的AST、ALT水平。而水飞蓟宾(300 ng/mL)在与血清孵育8 h后,能够降低血清中的ALT水平(P<0.001)。

表4 18α-GA、18β-GA体外对血清中AST活性的影响Table 4 Serum AST activity from serum-18α-GA,18β-GA incubation assay
注:与DMSO组比较,***P<0.001。
Note:Compared with DMSO group,***P<0.001.

表5 18α-GA、18β-GA体外对血清中ALT活性的影响Table 5 Serum ALT activity from serum-18α-GA,18β-GA incubation assay
续表5(Continued Tab.5)
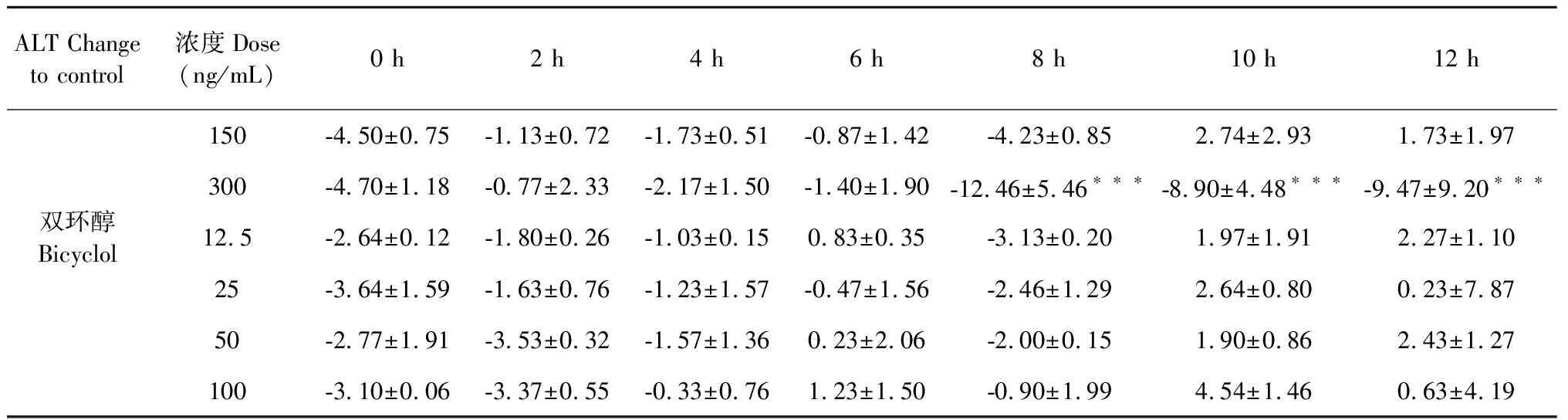
ALT Change to control浓度Dose(ng/mL)0 h2 h4 h6 h8 h10 h12 h150-4.50±0.75-1.13±0.72-1.73±0.51-0.87±1.42-4.23±0.852.74±2.931.73±1.97300-4.70±1.18-0.77±2.33-2.17±1.50-1.40±1.90-12.46±5.46∗∗∗-8.90±4.48∗∗∗-9.47±9.20∗∗∗双环醇Bicyclol12.5-2.64±0.12-1.80±0.26-1.03±0.150.83±0.35-3.13±0.201.97±1.912.27±1.1025-3.64±1.59-1.63±0.76-1.23±1.57-0.47±1.56-2.46±1.292.64±0.800.23±7.8750-2.77±1.91-3.53±0.32-1.57±1.360.23±2.06-2.00±0.151.90±0.862.43±1.27100-3.10±0.06-3.37±0.55-0.33±0.761.23±1.50-0.90±1.994.54±1.460.63±4.19
注:与DMSO组比较,***P<0.001。
Note:Compared with DMSO group,***P<0.001.
3.4 甘草酸二铵对肝损伤小鼠肝细胞凋亡的影响
如图2所示,模型组小鼠肝组织中BAX/BCL-2显著升高,同时cleaved Caspase-3、cleaved PARP的表达也显著上调(P<0.01或P<0.001)。而58.5 mg/kg甘草酸二铵能降低肝组织中cleaved caspase-3、cleaved PARP、BAX/BCL-2表达水平(P<0.01或P<0.001)。因此推测甘草酸二铵能够改善Con A致小鼠肝损伤组织的凋亡。
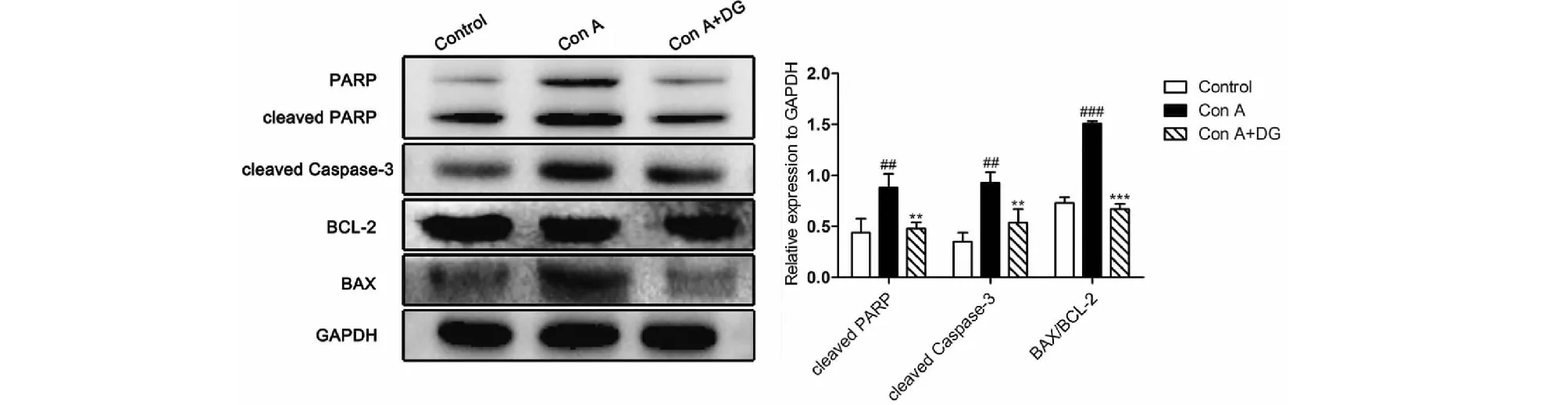
图2 甘草酸二铵对Con A所致肝损伤小鼠组织中凋亡蛋白的影响Fig.2 Effects of DG on hepatic apoptosis in mice with Con A-induced hepatic injury注:与空白组比较,##P<0.01;###P<0.001;与模型组比较,*P<0.01;***P<0.001。Note:Compared with control group,#P<0.05;##P<0.01;###P<0.001;Compared with Model group,*P<0.05;***P<0.001.
3.5 甘草酸二铵对肝损伤小鼠炎症反应的影响
如图3所示,模型组小鼠肝组织中Caspase-1、COX-2、TGF-β1、IL-6、IL-10、IL-1β、TNF-α和IFN-γ的表达升高,COX-1表达下降(P<0.01或P<0.001)。而58.5 mg/kg 甘草酸二铵能够降低TGF-β1、caspase-1以及COX-2表达水平,上调COX-1的表达,同时降低IL-6、IL-10、IL-1β、TNF-α和IFN-γ的表达水平(P<0.05、P<0.01或P<0.001)。因此推测甘草酸二铵能够保护小鼠免受Con A诱导的肝脏组织炎症反应。
4 讨论
Con A经尾静脉单次注射,能够引起TNF-α、IL-6、IFN-γ和IL-1β等多种细胞因子的分泌,导致肝脏组织炎性细胞浸润,诱发炎症和凋亡,进而导致急性肝损伤[5,6]。该模型与人类肝炎的发病机理及病理学特征极为相似,能够很好地模拟临床自身免疫性肝炎(AIH)、急性病毒性肝炎和药物中毒引起的肝炎等,因而在保肝药研究中被广泛应用[7]。水飞蓟素、双环醇分别为天然和人工合成的常见保肝药,保肝机制各不相同,在保肝药的研究中都常被用作阳性对照药[8,9]。水飞蓟素可以通过抗脂质过氧化反应维持细胞膜的流动性、从而改善肝功能;还可以中断肝肠循环,对抗毒物所致的肝损伤[10,11]。双环醇能够通过清除自由基、抑制氧化应激、保护肝细胞核DNA免受损伤、减轻线粒体损伤,从而发挥降低血清转氨酶和抗肝损伤、抗肝纤维化以及抗肝炎病毒的活性[12]。因此,本研究并以这两种保肝药作为对照药,通过复制Con A肝损伤模型,检测肝功能、肝脏病理组织和分子生物学指标来综合评判甘草酸二铵的肝保护作用,并初步探讨其作用机制。
AST、ALT升高是判断急性肝损伤严重程度的重要指标[5]。本研究表明,甘草酸二铵在保护小鼠免受Con A所致肝脏病理损伤的同时,可以降低小鼠血清中AST和ALT水平。人体药代动力学研究显示,甘草酸二铵肠溶胶囊口服摄入后,在体内被代谢成18α-GA和18β-GA,最高血药浓度为95.57±43.06 ng/mL[13]。为验证甘草酸二铵是否会直接降解血清中的AST和ALT,本文以苦参碱为阳性对照药[4],进行了药物-转氨酶异常血清共孵育实验。结果表明,18α-GA和18β-GA均不能直接降低血清中AST、ALT水平。因此,我们推测甘草酸二铵是通过保护肝细胞,减少AST、ALT外溢来发挥降酶作用的。

图3 甘草酸二铵对Con A所致肝损伤小鼠组织中炎症因子水平的影响Fig.3 DG inhibited inflammation in mice with Con A-induced hepatic injury注:与空白组比较,##P<0.01;###P<0.001;与模型组比较,*P<0.05;**P<0.01。Note:Compared with control group,##P<0.01;###P<0.001;Compared with Model group,*P<0.05;**P<0.01.
BAX与BCL-2是一对互相拮抗的凋亡相关蛋白,BAX/BCL-2的比值决定凋亡的启动,进而激活细胞凋亡下游的Caspase-3,而PARP剪切是Caspase-3激活的指标[14]。本研究结果显示,甘草酸二铵下调肝损伤小鼠肝脏中BAX/BCL-2的比值,抑制小鼠肝组织中凋亡蛋白PARP、cleaved Caspase-3的表达,说明甘草酸二铵具有抑制肝细胞凋亡的作用。在Con A诱导的肝损伤中,Caspase-1可以调节pro-IL-1β和pro-IL-18的活化,进而诱导T淋巴细胞增殖[15]。同时也伴随TGF-β1表达失衡和肝细胞内COX-2表达上调后前列腺素(PGs)的生成[16,17]。本研究结果表明,甘草酸二铵能抑制Con A所致小鼠肝组织中Caspase-1、TGF-β1、COX-2、IL-6、TNF-α和IFN-γ等炎性因子的上调,和COX-1的下调,显示其作用机理与抑制抗炎和细胞凋亡有关。
综上可见,甘草酸二铵肠溶胶囊能够改善Con A致小鼠肝损伤,并通过保护肝细胞来降低血清AST、ALT水平,其降酶保肝的作用可能与抑制小鼠肝脏组织细胞凋亡以及炎性细胞因子的水平相关。
