列当中Crenatoside神经保护作用的机制研究
2019-01-02韩雪峰苗鑫刘丹丹张晓菲邢海燕李刚
韩雪峰,苗鑫,刘丹丹,张晓菲,邢海燕,李刚*
(1.内蒙古人民医院,内蒙古 呼和浩特 010110; 2.内蒙古医科大学,内蒙古 呼和浩特 010110)
列当(OrobanchecaerulescensSteph)为列当科列当属药用植物,主要分布于黑龙江、甘肃、辽宁、内蒙古、河北、山西、青海及新疆等省区[1]。国内外学者研究表明苯乙醇苷类化合为是其特征性化学成分,具有抗菌消炎、抗氧化、抗肿瘤、免疫调节、神经保护、肝脏保护、改善心血管系统等多种药理作用。王晓琴等[2]发现毛蕊花糖苷和Crenatoside(OC4)是列当中含量最高的苯乙醇苷类化合物,关于毛蕊花糖苷药理作用的研究很多,如毛蕊花糖苷有改善D-半乳糖致急性衰老小鼠脑损伤的作用[2],而有关Crenatoside药理活性的研究相对较少。
大量国内外研究已证实,发生衰老的原因之一是细胞内半乳糖的大量堆积,导致细胞肿胀、代谢功能紊乱,而细胞内源源不断的半乳糖是由细胞外D-半乳糖供给的[3]。目前,细胞水平的衰老模型有肿瘤坏死因子诱导法、体外传代法、D-半乳糖诱导法等。王琳等研究发现体外原代心肌细胞在D-半乳糖诱导后有拟衰老作用[4],陈微等研究发现,D-半乳糖可对PC12细胞造成氧化损伤[5],为本实验造模提供了理论依据。环磷酸腺苷效应原件结合蛋白CREB是一种参与多种信号通路的重要核蛋白,在长期记忆形成过程中起着关键的调节作用,海兔、果蝇、大鼠和小鼠等动物试验中已得到证实[6]。目前研究表明,CREB分子是多种蛋白激酶的磷酸化底物,它的活化形式p-CREB可诱导下游基因BDNF等细胞因子表达或数目增加,从而影响学习记忆功能[7-8]。环腺苷酸cAMP是细胞内重要的第二信使,它在细胞内的浓度直接影响下游蛋白激酶A(PKA)的活性,只有活化的PKA可进入核内参与多种转录因子的磷酸化,其转录因子之一就是cAMP反应原件结合蛋白CREB。自由基是机体正常的代谢产物,它的产生和消除在正常情况下是处于动态平衡的,一旦打破,就会影响正常代谢[9],加速机体衰老过程。氧自由基又称活性氧,能消灭细胞膜上的不饱和脂肪酸而产生促进机体衰老的过氧化物,MDA是氧自由基与生物膜多聚不饱和脂肪酸发生脂质过氧化的产物,它的浓度间接反应氧自由基的含量,是反应细胞损伤程度的常用指标。抗氧化酶SOD是体内主要的自由基清除酶,能清除阴离子自由基继而保护细胞免受损伤,维持机体氧化与抗氧化平衡,是反应机体内源性抗氧化能力的常用指标。LDH和SOD同样均属于氧化还原酶类,研究发现,列当中苯乙醇苷类降低D-半乳糖造模后小鼠学习和记忆的错误次数、缩短学习反应期以及延长记忆潜伏期,主要与影响脑组织SOD的活性、MDA、LF含量,使海马CA1区神经细胞核圆,细胞器增多,染色质分布均匀,改变D-半乳糖脑化模型小鼠海马超微结构有关[10]。
基于这一现状本课题组前期展开了对OC4可改善D-半乳糖致衰老模型小鼠学习记忆能力的行为学研究,并进一步探讨其对D-半乳糖所致衰老小鼠脑组织SOD活性、MDA含量影响的实验结果中发现,OC4能够降低脑组织神经元损伤,可能与激活cAMP/PKA/CREB信号通路有关,以达到抗衰老,进而改善学习记忆障碍的作用。因此,本课题组着手从cAMP/PKA/CREB信号通路的方向,以PC12神经细胞为研究对象,展开对列当中Crenatoside抗衰老作用的分子机制研究。
1 实验材料
1.1 细胞
PC12细胞株(中国医学科学药物研究所陈乃宏教授提供)是大鼠肾上腺髓质嗜铬瘤分化细胞株,具有神经内分泌细胞的一般特征。
1.2 主要仪器
超净工作台(DPC 450C,LEICA公司);细胞培养箱(HERA cell 150i CO2 incubator,Thermo 公司);倒置显微镜(SN-CJ-αFD,Leica);低温高速离心机(Sigma 3-18K,德国);酶标仪(Bio-RAD Model 1680,日本);电泳仪(DYCZ-400,北京市六一仪器厂);稳压稳流电泳仪(EPS-100,上海天能科学仪器公司);旋涡混合器(wH-1,上海沪西分析仪器厂),恒温水浴锅(HH-6,国华电器有限公司);精密电子天平(UF3410,梅特勒-托利多仪器上海有限公司)
1.3 主要试剂
DMEM培养基(Gbico);FBS(Gbico);MTT(Sigma);大鼠BDNF酶联免疫试剂盒(武汉新启迪生物科技有限公司);大鼠PKA酶联免疫试剂盒(武汉新启迪生物科技有限公司);大鼠cAMP酶联免疫试剂盒(武汉新启迪生物科技有限公司);D-半乳糖(Sigma);Anti-CREB antibody ab32096(Abcam);彩色预染蛋白分子量标准(Sigma);ECL显色液(TheromoFisher Scientific);羊抗兔二抗(KPL);蛋白磷酸酶抑制剂混合物(康为世纪生物科技有限公司);肉苁蓉Crenatoside(王晓琴博士实验室自制,纯度>95%)。
1.4 主要溶液及配制
1.4.1 细胞用溶液
生长培养基: DMEM培养基,加入含体积分数为10%胎牛血清,5%马血清,0.6 ng/单位NGF,100/UmL青霉素和链霉素。MTT(5 g/L):称取0.1 g MTT粉末,溶于20 mL PBS缓冲液中,微孔滤膜过滤后,1 mL/vial分装为20vials,置于-20℃避光储存。D-gal:取0.16 g的D-gal加入10 mL的完全培养基中,混匀。终浓度16 g/L,现配现用。列当OC4:取0.001 g OC4,加入1 mL去离子水,配成1 mL原液,微孔滤膜过滤后,4℃保存。使用时用培养基稀释至所需浓度。磷酸盐缓冲液(PBS):高压灭菌,4℃保存备用。
1.4.2 Western blot用溶液
按照文献配制所需溶液[11]。
2 实验方法
2.1 细胞培养
PC12细胞株培养于DMEM培养基(含体积分数为10%的类胎牛血清,5%马血清),于37℃、体积分数为5%的CO2培养箱中培养,2~4 d,用吹打管吹打细胞,进行1:3传代。取对数生长期细胞进行实验。
2.2 MTT检测细胞存活率并提供剂量选择的依据
取对数生长期细胞,吹打混悬后调整细胞密度为1×105个/mL,以200 μL/孔接种于96孔板,37℃,5%的CO2孵箱中培养。48 h后取出吸弃旧培养基,正常对照组为200 μL的新鲜培养基,D-gal模型组为200 μL含有D-gal的培养基,使其终浓度为16 g/L,浓度6个复孔,造模组作用时间40 h。给药组为200 μL含有OC4的培养基,使其终浓度分别为50 μg/mL和100 μg/mL,给药时间24 h,每孔加5 mg/mL的MTT 20 μL,置于37℃、5%CO2培养箱中继续培养4 h,后弃培养液,逐孔吸去液体后加DMSO l50 μL/孔,轻轻振荡10 min,用酶标仪在490 nm处读取吸光度(A490)值,取5孔均值按下列公式计算,细胞存活率(%) =实验组A490/对照组A490×100%。实验重复3次,数据做统计分析。
2.3 双抗体夹心法测定cAMP、PKA和BDNF
2.3.1 待测样品的制备
药物处理后,收集PC12细胞培养液,2 500 rpm离心10 min,取上清测试。
2.3.2 标准曲线制作
标准品:加入标准品稀释液1.0 mL至冻干标准品中,静置10 min,待其充分溶解后,轻轻混匀(浓度为10 ng/mL),之后在管身标注①,然后根据需要进行稀释。保证冻干标准品彻底溶解和混匀。标准品稀释方法取7支洁净的试剂管,每管加入300 μL标准品稀释液。从第一管内取出300 μL加入到第二管,混匀后,再从第二管取出300 μL加入到第三管,以此类推至第七管第八管为标准品稀释液,作为阴性对照使用。
2.4 Western bloting
2.4.1 蛋白样品的制备
药物作用结束以后收集细胞沉淀于1.5 mL EP管中,按1×107·200 μL-1的比例加入裂解液RIPA缓冲液,冰上裂解5 min。4℃ 12 000 r/min离心5 min,收集上清液,-20℃保存备用。
2.4.2 蛋白浓度的测定
按照蛋白浓度测定试剂盒配制A液和B液的混合液(发光液),36孔板中加入不同浓度的蛋白标准品及发光液,酶标仪于595 nm处测量吸光度,每个样品管设置3个复孔,制作标准曲线,根据曲线方程y=0.109 0x+0.048 3计算各组样品的蛋白含量。蛋白质定量以后,以还原型5XSDS上样缓冲液混合调整蛋白终浓度至2 μg/μL,并于沸水中煮沸5 min变性,变性的蛋白质样品-80℃保存。
2.4.3 SDS-PAGE电泳
根据说明书安装玻璃板。将现配好的分离胶迅速向两玻璃板的缝隙中灌注,加入去离子水封胶,静置30 min,待聚合完全后,倾出上层水。将浓缩胶直接灌注约3 mL在分离胶上,立即在浓缩胶上方插入Teflon梳子,小心混入气泡。浓缩胶聚合完全后,拔出梳子,最左边孔道加入Macker,其他孔道加入样品15μL。连接电泳装置开始电泳,起始电压100 V,当染料前沿进入分离胶后,电压提高到120 V继续电泳,直至溴酚蓝到达分离胶底部。
2.4.4 转膜
准备6张3.0 cm×8.0 cm的滤纸和一张同样大小的PVDF膜置于培养皿中,甲醇浸泡10 min。将夹子打开,依次放入海绵垫、3层滤纸、胶(根据Macker的位置切下分离胶,约为3 cm×8 cm)、PVDF膜、3层滤纸、海绵垫。最后合起夹子,轻轻置于转移槽中,设置100 V转移2 h。
2.4.5 封闭
将5%脱脂奶粉置于培养皿中,PVDF膜浸入此封闭液摇床上震荡1 h。
2.4.6 抗体孵育
抗体CREB(1∶1 000),P-CREB(1∶1 000),β-actin(1∶1 500)分别用封闭液按比例稀释后,4℃孵育过夜。TBST在室温下脱色摇床上洗3次,每次10 min;再用TBS洗3次,每次10 min。二抗(1∶10 000)室温孵育1 h。TBST在室温下脱色摇床上洗3次,每次10 min;再用TBS洗3次,每次10 min。
2.4.7 化学发光显影
取ECL试剂盒中A、B两种工作液各50 μL,将膜蛋白面朝上小心放到凝胶图像成像系统,迅速将A、B两液混合,均匀滴至膜上。选择合适的曝光时间后,进行拍照。
2.4.8 凝胶图像分析
用Chemi Analysis凝胶蛋白分析软件对条带进行分析。
2.5 试剂盒检测SOD、MDA和LDH
超氧化物歧化酶(SOD)测试盒、细胞丙二醛(MDA)测试盒、乳酸脱氢酶(LDH)测定试剂盒按照说明书逐步操作。
2.6 统计学处理
3 结果
3.1 肉苁蓉Crenatoside(OC4)对D-半乳糖所致PC12神经细胞损伤的保护作用
D-半乳糖作用细胞40 h,细胞存活率已降低为(46.67±6.59)%,与空白组(85.52±6.18)%比较差异具有统计学意义(P<0.05)。而OC4(50、100 μg/mL)对于D-半乳糖所致的存活率降低有明显保护作用,并呈剂量依赖性(r=0.767,P<0.01)。但OC4大剂量升高细胞存活率的作用(68.21±6.89)%可被PKA抑制剂H-89显著翻转(53.21±6.21)%(P<0.05),结果见表1,提示肉苁蓉OC4对于急性衰老模型的保护作用,有可能与cAMP/PKA/CREB信号通路有关。见表1。
3.2 OC4对造模后PC12神经细胞中SOD、LDH活性和MDA含量的影响
结果显示,空白组中SOD活性为(27.30±1.83)U/mL;LDH含量为(285.75±17.65)μmol/mL;MDA含量为(360.74±26.38)nmol/mgprot。模型组与空白组比较,SOD活性明显下至(16.91±1.65)U/mL;LDH含量明显上升至(360.34±16.87)μmol/mL;MDA含量明显上升至(550.21±33.54)nmol/mgprot,差异具有统计学意义(P<0.05)。各给药组与模型组比较,SOD活性均有所上升呈剂量依赖性(r=0.907,P<0.01);LDH含量均有所下降有剂量依赖性(r=-0.927,P<0.05);MDA含量均有所下降呈剂量依赖性(r=-0.850,P<0.05)。OC4大剂量组SOD活性均恢复至(28.34±1.86)U·mL-1(P<0.05);LDH含量可恢复至(287.53±19.55)μmol·mL(P<0.05);MDA含量可恢复至(389.62±38.62)nmol·mgprot-1(P<0.05)。H-89干预可翻转OC4大剂量所致SOD活性升高(P<0.05);LDH含量有所上升(P<0.05);MDA含量有所上升(P<0.05)。结果见表2。

表1 OC4对于D-半乳糖干预后PC12细胞的细胞存活率的影响
注:与空白组比较,△P<0.05;与模型组比较,*P<0.05;与OC4大剂量组比较,★P<0.05
3.3 OC4对造模后PC12细胞中cAMP和PKA含量的影响
3.3.1 OC4对损伤的PC12细胞中cAMP含量的影响
结果显示,空白组中cAMP含量为(8.080±0.349)ng·mL,模型组与空白组比较,cAMP含量明显下至(4.017±0.286)ng·mL-1,差异具有统计学意义(P<0.05)。给药OC4组与模型组比较,cAMP含量均有所上升,且有剂量依赖性(r=0.895,P<0.05),OC4大剂量组cAMP含量可恢复至(8.289±0.283)ng/mL(P<0.05)。OC4大剂量组经过H-89干预后,cAMP含量有所下降,差异与给药OC4大剂量组相比有统计学意义(P<0.05)。见表3。
3.3.2 OC4对急性衰老细胞中PKA含量的影响
结果显示,空白组中PKA含量为(8.420±0.126)ng/mL,模型组与空白组比较,PKA含量明显降低,差异具有统计学意义(P<0.05)。给药OC4组与模型组比较,PKA含量均有所上升,且有剂量依赖性(r=0.937,P<0.01),OC4大剂量组PKA含量可恢复至(7.640±0.175)ng·mL(P<0.05)。OC4大剂量组经过H-89干预后,PKA含量有所下降,差异与给药OC4大剂量组相比有统计学意义(P<0.05)。见表3。

表2 OC4对造模后PC12细胞中SOD、MDA、LDH活性的影响
注:与空白组比较,△P<0.01;与模型组比较,**P<0.01;与给药大剂量组比较,★P<0.05

表3 OC4对造模后的PC12细胞PKA及cAMP的影响
注:与空白组比较,△P<0.05;与模型组比较,**P<0.01;与OC4大剂量组比较,★P<0.05
3.4 OC4对PC12细胞p-CREB、CREB蛋白表达的影响
结果显示,模型组与空白组比较,D-半乳糖显著抑制了p-CREB的入核作用(P<0.05),给药组与模型组比较,OC4显著上调了D-半乳糖所致急性衰老模型中p-CREB的表达(P<0.05),并且有剂量依赖性(r=0.903,P<0.01)。大剂量给药组经过H-89干预后,p-CREB的表达明显下调(P<0.05)。各组的CREB表达无明显变化。见图1、2。
3.5 OC4对造模后PC12细胞分泌的BDNF的影响
实验结果显示,模型组与空白组对比,BDNF含量明显下降至(0.710±0.026)ng/mL,差异具有统计学意义(P<0.05)。给药OC4组与模型组比较,BDNF含量明显上升(P<0.05),差异具有统计学意义。OC4大剂量组经阻断剂H-89干预后,BDNF水平又明显下降(P<0.05),结果为为(0.756±0.038)ng/mL。见表4。

图1 p-CREB、CREB表达结果
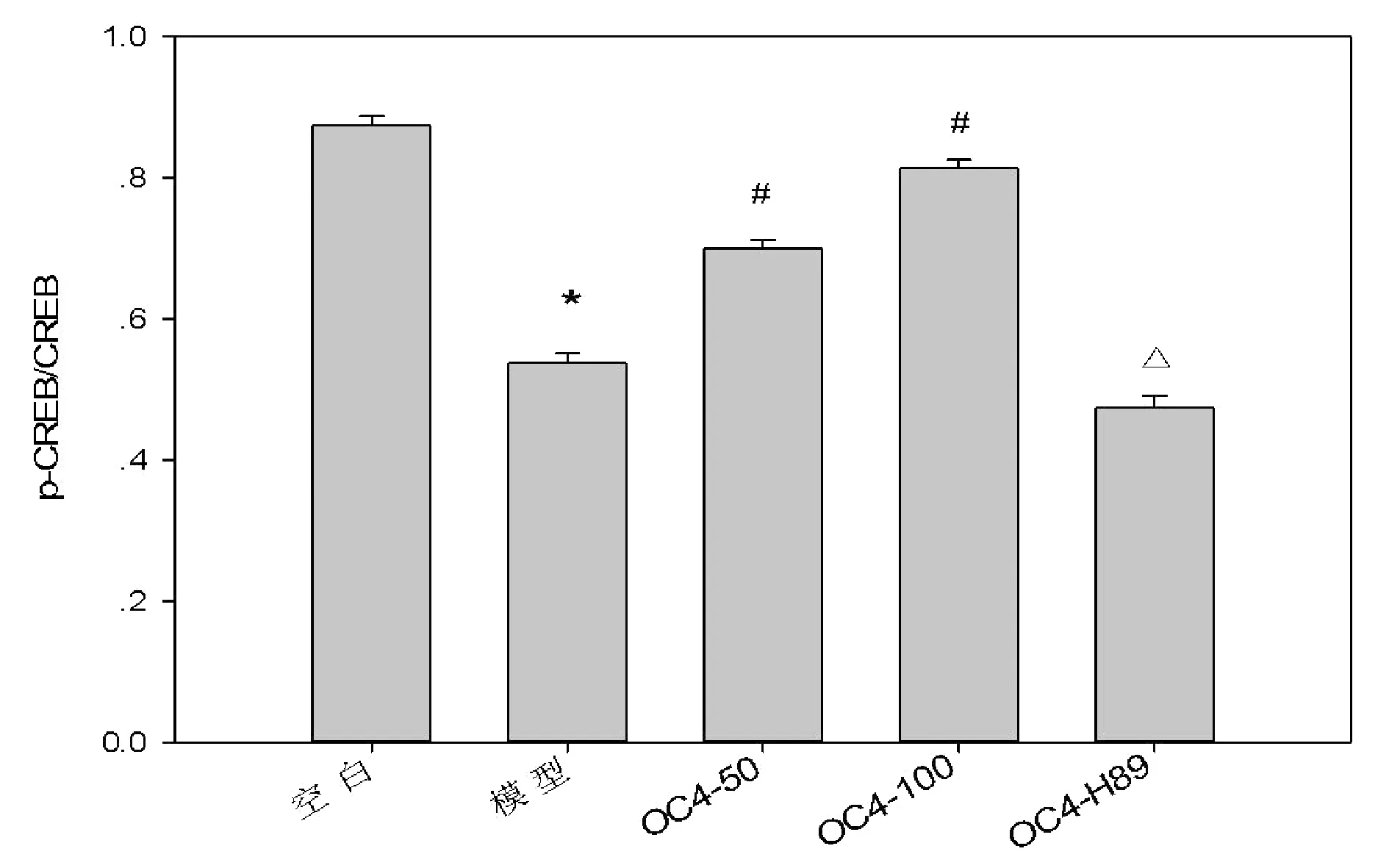
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与OC4-100组比较,△P<0.05图2 给药OC4作用PC12细胞急性衰老模型后p-CREB、CREB的表达

组别剂量(μg/mL)BDNF(ng/mL)空白组—1.653±0.030模型组16×1030.710±0.026*OC4低剂量组501.835±0.033△OC4大剂量组1001.634±0.044△OC4+H89100+1000.756±0.038★
注:与正常组比较,△P<0.05;与模型组比较,*P<0.05;与OC4大剂量组比较,★P<0.05
4 讨论
目前,关于列当中苯乙醇苷类Crenatoside的研究主要集中在分离提取工艺及含量测定方面。王晓琴课题组前期建立了列当中主要活性成分毛蕊花糖苷和crenatoside,以及总苯乙醇苷类化合物含量测定的方法,发现列当中总苯乙醇苷含量在6.78%~27.43%,含量最高的成分是毛蕊花糖苷,其次为crenatoside 含量在0.83%~4.47%。同时发现药材的采集时间对主要成分含量影响较大,盛花期采集的列当,苯乙醇苷类成分含量较高。但对于Crenatoside主要药效及药理学作用的研究目前相关邻域研究较少,仅有的研究只有初步涉及到其列当提取物苯乙醇总苷均具有较好的抗氧化能力,DPPH自由基清除试验显示其清除DPPH自由基能力接近于抗坏血酸[12];具有清除DPPH1-二苯基-2-三硝基苯肼的活性表现出显著的抗菌活性[13-14]。本实验中,各组BDNF的变化与cAMP/PKA/CREB信号通路变化一致,提示OC4通过cAMP/PKA/CREB信号通路[15]影响BDNF的分泌并进行探索实验。
实验结果证明OC4对于D-半乳糖所致PC12神经细胞损伤模型的cAMP/PKA/CREB信号通路水平有上调作用。D-半乳糖模型组cAMP和PKA水平降低,p-CREB表达减少,而各给药组与模型组比较,cAMP/PKA/CREB信号通路水平上调,提示肉苁Crenatoside改善D-半乳糖导致PC12细胞损伤的作用与调节cAMP/PKA/CREB信号通路水平有关。研究发现细胞内cAMP或钙浓度的升高可以使CREB的Ser133位发生磷酸化作用而活化,p-CREB与真核基因转录调控区TATA框上游的cAMP反应元件结合,启动下游基因的转录,影响蛋白质的表达水平,从而调节多种生物学功能,影响个体神经元直至整个神经网络的功能。
马新良等[16]在对JNK信号通路的支架蛋白JIP3的研究中发现,BDNF除了可以促进神经元存活和分化、调节突触可塑性外,BDNF/TrkB信号通路还可以通过激活CREB增加JIP3蛋白合成,促进长时的神经递质释放从而达到改善学习记忆功能的作用。此外,还有研究认为海马区突触前膜蛋白SD蛋白、Syntaxin蛋白以及SNAP蛋白的表达水平影响Glu和GABA等与记忆相关的神经递质释放[17],这些都为今后例如阿尔兹海默症,帕金森等相关疾病的研究提供必要的线索,同时也为我们下一步的研究工作奠定了基础。
