响应面法优化制黄精高压蒸制工艺研究*
2018-12-28宋艺君马存德彭秀娟刘世军王志彦王昌利
宋艺君,郭 涛,马存德,彭秀娟,刘世军,王志彦,孙 静,王昌利
(1.陕西中医药大学药学院 咸阳 712046;2.解放军第451医院 西安 710054;3.陕西步长制药有限公司 西安 710075;4.陕西国际商贸学院 咸阳 712046)
黄精属于百合科,其植物来源有滇黄精(PolygonatumkingianumColl.etHemsl.)、黄 精(Polygonatum sibiricum Red.)或多花黄精(Polygonatum cyrtonema Hua)。黄精始载于《名医别录》,被列为上品。黄精为我国传统名贵滋补中药,具有补气养阴、健脾润肺、益肾的功效[1],主要用于脾胃气虚、胃阴不足、精血不足、腰膝酸软等证的治疗。其[2-3]所含化学成分主要有多糖、甾体皂苷、蒽醌、氨基酸等,现代药理实验表明,黄精具有[4-5]抗衰老、调节免疫、降血脂、降血糖、抗癌、提高和改善记忆、抗炎、抗病毒等作用。2015版《四川省中药饮片炮制规范》收载了黑豆汁制黄精。生黄精具有刺人咽喉的副作用,经过黑豆汁制后,一方面增强健脾益肾作用,另一方面可除去麻味,同时外观颜色也由淡黄色或黄棕色变为棕褐色至黑色。
目前黄精的炮制多采用传统的常压蒸制工艺[6-8],蒸制时间长,生产效率低,资源浪费大,工艺参数不易控制,而高压蒸制工艺[9,10]采用先进设备,节省人力、物力资源,生产效率提高,使炮制参数得到控制,从而提高炮制品质量。本研究
在文献查阅和前期预实验的基础上,以总皂苷、5-HMF、多糖、醇浸出物含量和饮片外观性状的总评归一值为评价指标,采用响应面实验设计[11,12],考察炮制压力、闷润时间、炮制时间和黑豆用量4个因素,首次采用高压蒸制工艺优化黑豆汁制黄精炮制工艺,并将高压蒸制品与常压蒸制品进行比较,以期寻找一种更好的炮制方法。
1 实验材料
LDZX型立式压力蒸汽灭菌器(上海申安医疗器械厂);U3000型高效液相色谱仪(赛默飞世尔科技公司);UV-2550型紫外可见分光光度计(岛津公司);BT-25S型电子天平(北京赛多利斯仪器系统有限公司)。
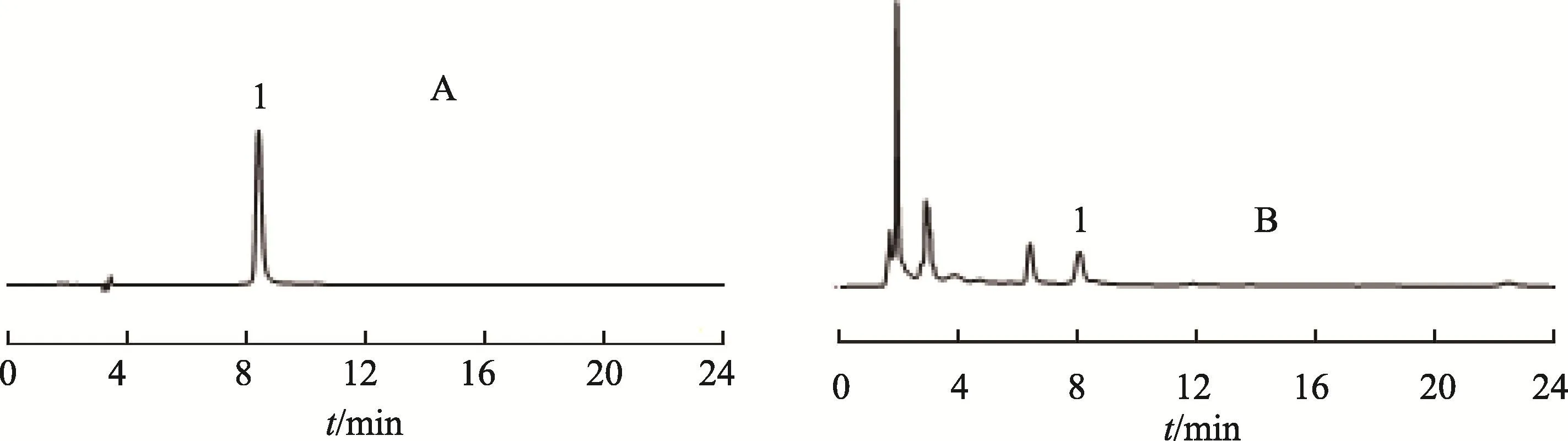
图1 5-HMF对照品(A)和高压蒸制品(B)的HPLC图
黄精采自陕西步长制药有限公司汉中基地,经陕西中医药大学药学院胡本祥教授鉴定为百合科植物黄精Polygonatum sibiricum Red.的干燥根茎。对照品5-HMF(批号111626-201711,纯度99.2%)、葡萄糖(批号110833-201707,纯度 99.9%)、人参皂苷 Rb1(批号110704-201625,纯度95.0%)均购于中国食品药品检定研究院,甲醇、乙腈为色谱纯,水为娃哈哈纯净水,其余试剂为分析纯。
2 方法与结果
2.1 多糖的定量测定[1]
2.1.1 对照品溶液制备
取无水葡萄糖对照品33 mg,精密称定,置100 mL量瓶中,加水溶解并稀释至刻度,摇匀,即得(每1 mL中含无水葡萄糖0.33 mg)。
2.1.2 供试品溶液制备
取本品细粉0.25 g,精密称定,置圆底烧瓶中,加80%乙醇150 mL,加热回流1 h,滤过,残渣用80%热乙醇洗涤(3次),每次10 mL,将残渣及滤纸放烧瓶中,加水150 mL,加热回流1 h,趁热滤过,残渣及烧瓶用热水洗涤4次(每次10 mL),合并滤液与洗液,转移至250 mL量瓶中,稀释定容。量取1 mL,置试管(10 mL)中,按2.1.3项下方法,自“加水至2.0 mL”起,测定吸光度,根据标准曲线计算供试品溶液中含无水葡萄糖的重量(mg)。
2.1.3 标准曲线制备
分别精密量取对照品溶液0.05、0.1、0.2、0.3、0.4、0.5、0.6 mL,置10 mL试管中,各加水至2.0 mL,摇匀,放置冰水浴中,缓缓滴加0.2%蒽酮-硫酸溶液至刻度,摇匀,放冷后于水浴中保温10 min,取出,立即置冰水浴中冷却10 min,取出,以相应试剂为空白,照紫外-可见分光光度法(通则0401),在582 nm处测定吸光度。以浓度(x)为横坐标,吸光度(y)为纵坐标作图,得回归方程y=32.519x+0.6383,r=0.9993。线性范围为0.0167-0.2001 mg。
2.1.4 精密度试验
取同一供试品溶液(响应面实验2号样品),按2.1.3项下方法测定y值,重复测定6次,结果RSD为0.05%,表明本方法精密度良好。
2.1.5 稳定性试验
取同一供试品溶液(响应面实验2号样品),按2.1.3项下方法,分别在0、30、60、90、120 min测定y值,结果RSD为0.50%,表明供试品溶液在2 h内基本稳定。
2.1.6 重复性试验
取同一样品6份,每份0.25 g,按2.1.2项下方法制备供试品溶液,每份量取1 mL,按2.1.3项下方法测定y值,结果RSD为2.06%,表明本方法重复性良好。
2.1.7 加样回收率试验
取已知黄精多糖含量的样品6份,每份0.25 g,分别加入等量葡萄糖对照品溶液,按2.1.2项下方法制备供试品溶液并测定y值,结果平均回收率为98.79%,RSD为1.14%,表明本方法回收率良好。
2.2 5-HMF的定量测定[13]
2.2.1 色谱条件
Hypurity C18色谱柱(250×4.6 mm,5 μm),流动相为甲醇-水(8∶92),检测波长280 nm,流速1.0 mL/min,进样量10 μL,柱温30℃。5-HMF对照品及高压蒸制品的HPLC图谱见图1。结果表明,样品中其它成分对5-HMF的测定无干扰。
2.2.2 对照品溶液制备
精密称定5-HMF对照品适量,用甲醇溶解制成浓度为100 μg·mL-1的对照品溶液。取上述5-HMF对照品1 mL,用甲醇稀释定容至5 mL的容量瓶,得到20 μg·mL-1的对照品溶液。
2.2.3 供试品溶液制备
精密称定样品(1-30号)约0.2 g,置锥形瓶中,加入80%甲醇25 mL,称重,加热回流1 h,放凉至常温,再称重,用80%甲醇补足减失的重量,摇匀,过滤,取续滤液,即可。
2.2.4 标准曲线制备
取 2.2.2项下对照品溶液,分别取 5、10、20、40、80 μL进样,以进样量为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,得到回归方程Y=111.64X-0.4583,r=0.9999(n=5),结果表明,5-HMF 在 0.1-1.6 μg范围内与峰面积有良好的线性关系。
2.2.5 精密度试验
取5-HMF对照品溶液,按2.2.1项下色谱条件,连续6次进样,结果5-HMF峰面积的RSD为0.62%,表明本仪器精密度良好。
2.2.6 稳定性试验
按2.2.3项下方法制备供试品溶液(响应面实验2号样品),分别在0、4、8、12、24 h测定,结果5-HMF峰面积的RSD为0.89%,表明供试品溶液在24 h内基本稳定。
2.2.7 重复性试验
取同一样品6份(响应面实验2号样品),每份0.2 g,按2.2.3项下方法制备供试品溶液,然后测定峰面积,结果5-HMF峰面积的RSD为1.02%,表明本实验方法重复性良好。
2.2.8 加样回收率试验
取已知5-HMF含量的样品6份,每份0.2 g,分别加入一定量5-HMF对照品溶液,按2.2.3项下方法制备供试品溶液并测定峰面积,结果平均回收率为99.32%,RSD为1.41%,表明本方法回收率良好。
2.3 浸出物的定量测定
按照《中华人民共和国药典》2015版第四部2201(浸出物测定热浸法)项下依法测定醇溶性浸出物。
2.4 总皂苷的定量测定[14]
2.4.1 对照品溶液制备
取人参皂苷Rb15.11 mg,精密称定,置容量瓶(10 mL)中,加甲醇溶解并稀释至刻度,得浓度为0.511 mg/mL的对照品溶液。
2.4.2 供试品溶液制备
取黄精粉末1 g,精密称定,加入15 mL 80%乙醇,超声30 min(2次),合并滤液至50 mL容量瓶中,加80%乙醇稀释至刻度,摇匀。
2.4.3 最大吸收波长的确定
取2.4.1,2.4.2项下所得对照品溶液240 μL、样品溶液100 μL水浴蒸干,按2.4.4项下方法显色,以不加样品溶液的空白试剂作为空白对照,分别把上述对照品和样品溶液在紫外分光光度计进行全波长扫描,结果均在550 nm处有最大吸收。故选择检测波长550 nm。
2.4.4 标准曲线制备
精密吸取对照品溶液120、240、360、480、600 μL,置试管中,挥干溶剂,加入0.2 mL新配置的5%香草醛-冰醋酸溶液,0.8 mL高氯酸,混合均匀,于60℃水浴加热15 min,冰浴5 min,取出,加入冰醋酸5 mL,以只加空白溶剂同法操作作为空白对照,在550 nm处测定吸光度。以人参皂苷Rb1质量浓度(X)为横坐标,吸光度(Y)为纵坐标绘制标准曲线,得到回归方程Y=70.429X+0.0217,r=0.9996,结果表明,总皂苷在61.32-306.60 μg与吸光度有良好的线性关系。
2.4.5 精密度试验
取人参皂苷Rb1对照品溶液,按2.4.4项下方法测定A值,重复测定6次,结果RSD为0.32%,表明本方法精密度良好。
2.4.6 稳定性试验
取同-供试品溶液(响应面实验2号样品),按2.4.4项下方法,分别在0、10,20、30、40 min测定A值,结果RSD为0.59%,表明供试品溶液在40 min内基本稳定。
2.4.7 重复性试验
取同一样品6份(响应面实验2号样品),每份1 g,按2.4.2项下方法制备供试品溶液,每份精密吸取100 μL,按2.4.4项下方法测定A值,结果RSD为2.31%,表明本方法重复性良好。
2.4.8 加样回收率试验
取已知总皂苷含量的样品6份,每份1 g,分别加入一定量人参皂苷Rb1对照品溶液,按2.4.2项下方法制备供试品溶液并测定A值,结果平均回收率为97.52%,RSD为1.34%,表明本方法回收率良好。
2.5 外观性状评分标准
参照《四川省中药饮片炮制规范》(2015版)黄精性状项下规定,确定评分。评分标准见表1。
2.6 制黄精的炮制[15]
2.6.1 常压蒸制
取净黄精,加入适量黑豆汁,拌匀,闷润,置蒸锅内蒸制,取出,稍晾,切厚片,干燥。
2.6.2 高压蒸制
取净黄精,加入适量黑豆汁,拌匀,闷润,置蒸汽灭菌器内高压蒸制,取出,稍晾,切厚片,干燥。
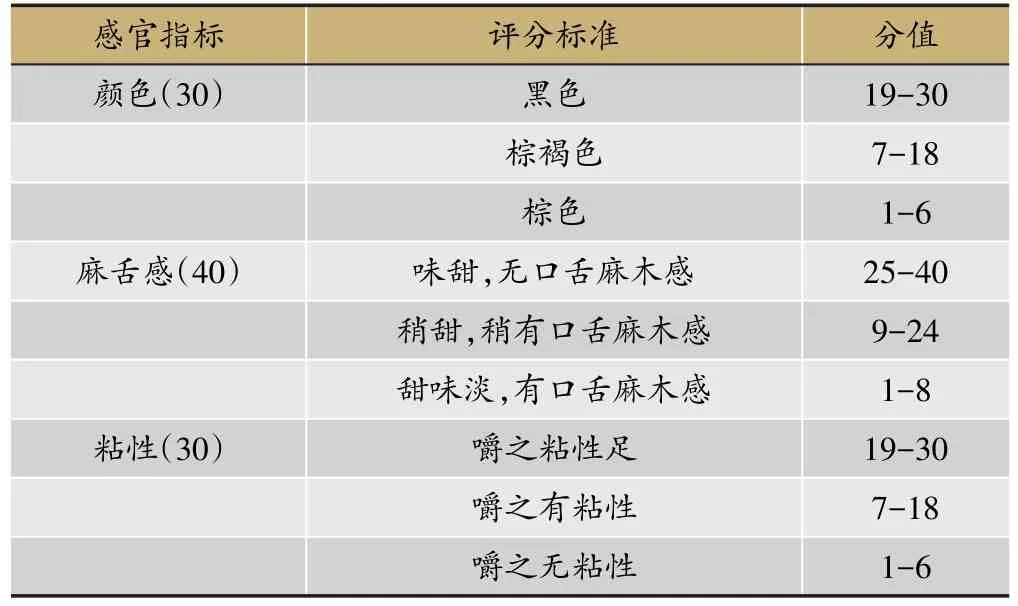
表1 制黄精感官评分标准
2.7 单因素实验确定各个因素水平
2.7.1 炮制压力考察
称取100 g黄精药材,共5份,设定黑豆用量10%,闷润时间1 h,炮制时间60 min,考察炮制压力0.1、0.125、0.15、0.175、0.2 Mpa对多糖、总皂苷、5-HMF、浸出物含量和外观评分的总评归一值的影响,结果OD值分别为0.5734、0.6470、0.7190、0.7412、0.7629。可见随着炮制压力的增加,OD值持续升高,尤其在0.1-0.15 Mpa,OD值增大显著,故选择0.1、0.2 Mpa为炮制压力后续实验优化范围。
2.7.2 闷润时间考察
称取100 g黄精药材,共4份,设定炮制压力0.15 Mpa,黑豆用量10%,炮制时间60 min,考察闷润时间0、30、60、120 min对多糖、总皂苷、5-HMF、浸出物含量和外观评分的总评归一值的影响,结果OD值分别为0.6407、0.6721、0.6542、0.6496。可知延长闷润时间后,OD值先升高,后又在小范围内有所降低,故选择0、120 min为闷润时间后续实验优化范围。
2.7.3 蒸制时间考察
称取100 g黄精药材,共5份,设定炮制压力0.15 Mpa,黑豆用量10%,闷润时间1 h,考察蒸制时间40、50、60、70、80 min对多糖、总皂苷、5-HMF、浸出物含量和外观评分的总评归一值的影响,结果OD值分别为0.6430、0.7401、0.7690、0.7850、0.8121。可知延长蒸制时间后,OD值一直升高,尤其在刚开始的10 min,升高显著,故选择40、80 min为蒸制时间后续实验优化范围。
2.7.4 辅料用量考察
称取100 g黄精药材,共4份,设定炮制压力0.15 Mpa,炮制时间60 min,闷润时间1 h,考察不同黑豆用量5%、10%、15%、20%对多糖、总皂苷、5-HMF、浸出物含量和外观评分的总评归一值的影响,结果OD值分别为0.5430、0.6301、0.6750、0.7121。可知增加黑豆用量后,OD值一直升高,尤其在5%-10%范围,升高显著,故选择5%、20%为黑豆用量后续实验优化范围。
2.8 响应面试验优化制黄精高压蒸制工艺
2.8.1 试验设计及结果
取黄精药材,放置于高压蒸汽灭菌器中,在单因素试验结果的基础上,采用Design-Expert 7.0.0软件,利用响应面法[11]对制黄精的高压蒸制工艺进行优化。在试验设计过程中,将炮制压力(X1)、闷润时间(X2)、炮制时间 (X3)、黑豆用量 (X4)、设定为考察因素,按2、1、0、-1、-2的最高、高、中、低、最低5水平进行编码,以总皂苷、5-HMF、多糖、浸出物和外观评分的OD值(Y)作为响应值。响应面试验设计及结果见表2。
2.8.2 响应面试验结果
采用Design-Expert 7.0.0软件进行数据拟合,结果Y与X1、X2、X3、X4的 多 项 式 方 程 为Y=3.12943+7.20667X1-0.028766X3-0.2225X4-0.58875X2-0.7052X1X4+1.903×10−3X3X4+0.0417X2X4+4.77768 ×10−3。
实验结果的方差分析见表3,当P<0.05为显著项,P<0.01为极显著项。由表3可知,4个因素中,X2不显著(P值=0.0759),其余因素为显著项,其中X1的P值为0.0372,X3的P值为0.0119,X4的P值为0.0295,且显著程度X3>X4>X1;2 次项为极显著项(P=0.0005),表明黑豆用量与响应值并非简单的线性关系,交互项X1X4、X3X4、X2X4的P值分别为 0.007、0.0041、0.002,表明考察因素X1和X4、X3和X4、X2和X4之间具有特别明显的交互作用。模型整体显著性很好(P<0.0001),且失拟程度不显著(P=0.6904),即4个因素炮制压力(X1)、闷润时间(X2)、炮制时间(X3)、黑豆用量(X4)、与OD值(Y)之间的变化关系能够通过本模型较好反映,即本模型可用来对蒸制工艺进行分析和预测。
按所得模型绘制4个因素的交互作用对制黄精高压蒸制工艺影响的3D响应面图见图2。由软件得出制黄精高压蒸制工艺为先将黄精加入8.75%黑豆,闷润1.5 h,在0.17 Mpa压力下蒸制50 min,取出,放凉,切厚片,干燥,OD值为0.7880。
2.9 验证试验及工艺比较
根据最优工艺筛选结果,结合实际情况,将最优工艺调整为压力0.17 Mpa、闷润时间1.5 h、炮制时间50 min、黑豆用量9%。该工艺经验证,实验结果见表4。根据验证试验结果,黄精经蒸制后,总皂苷、5-HMF、浸出物含量和外观评分均有一定程度的增加,多糖含量减少,与常压蒸黄精比较,高压蒸制品中总皂苷、5-HMF、多糖、浸出物含量和外观评分均较高,表
明本实验优选的最佳工艺具有一定的稳定性。
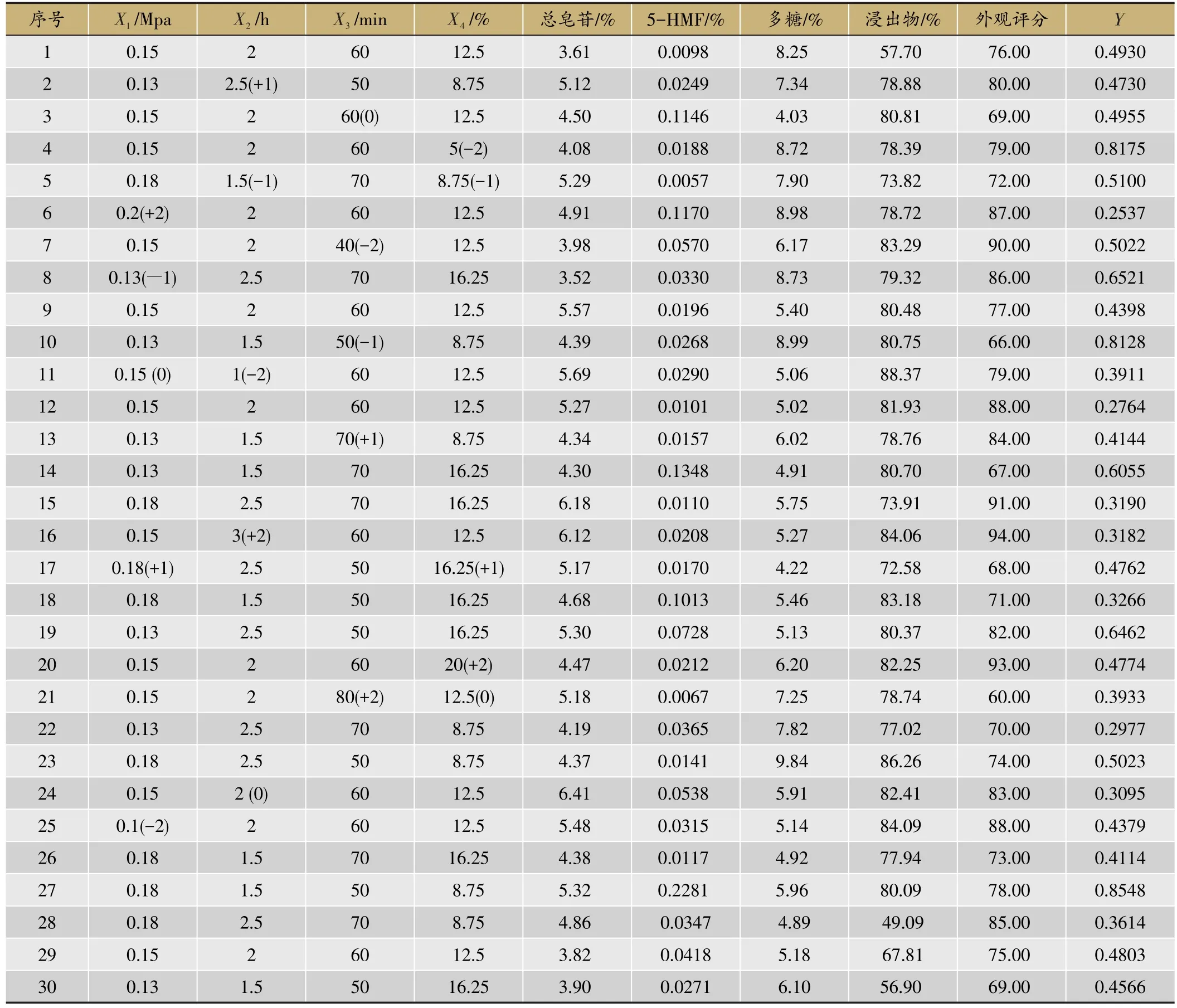
表2 高压蒸黄精响应面试验设计及结果
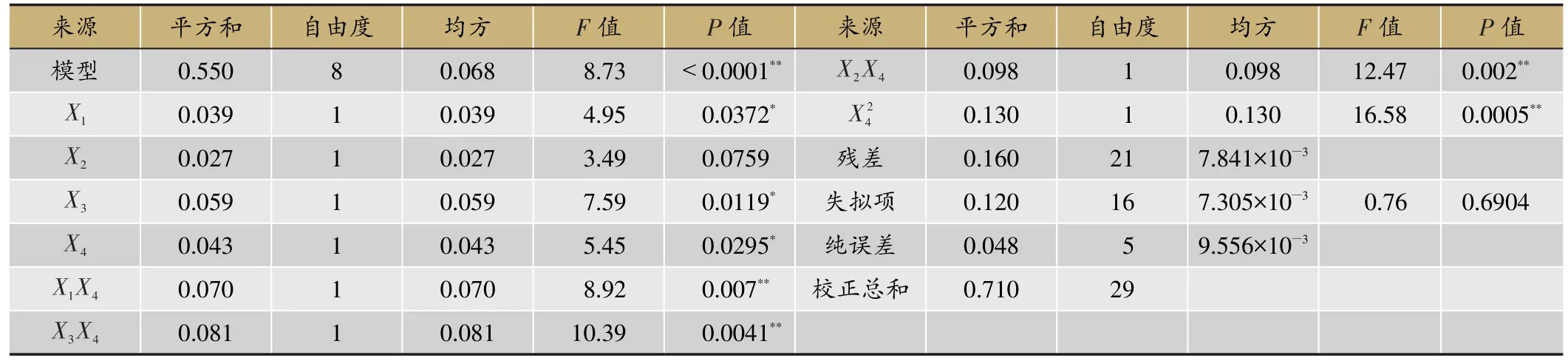
表3 方差分析
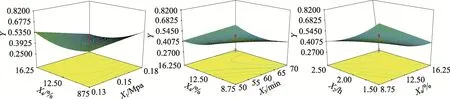
图2 4个因素交互作用的三维响应面图
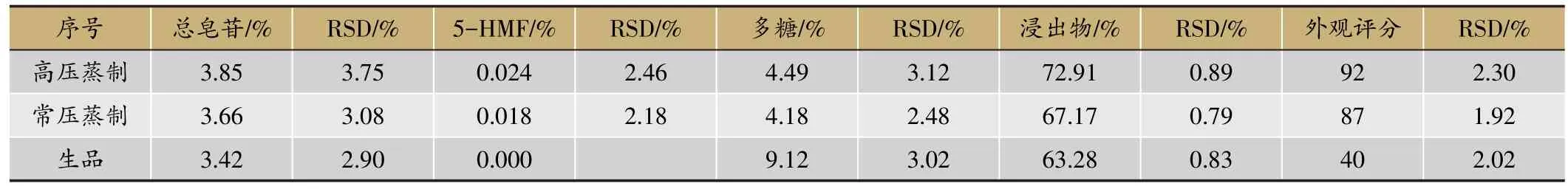
表4 黄精生品及各炮制品的定量测定结果(n=3)
3 讨论
高压蒸制是借助高温和高压的非常强的热穿透作用,使药材容易被蒸透,从而达到炮制的目的。本方法操作简单,方便控制温度、压力和时间,且省工省时,节约能源,提高了工作效率,便于生产,已成为现代研究的热点。本研究发现,高压蒸制与常压蒸制黄精相比,可最大程度保持总皂苷、多糖等有效成分的含量,可很大程度缩短炮制时间[16],提示高压蒸制法可能成为制黄精炮制的一种有效、快捷的新方法。
在总皂苷的测定中,有学者采用薯蓣皂苷元作为对照[17],也有学者以人参皂苷Rb1[18]作为对照,本研究以人参皂苷Rb1为对照采用分光光度法测定总皂苷含量。在总皂苷供试品溶液的制备中,比较了回流法、超声法和微波提取法,发现总皂苷含量加热回流法>超声波法>微波法,考虑到加热回流法温度高可能造成皂苷的破坏,而超声法简便、高效、且温度低,可有效保护皂苷不被破坏,故选择超声法提取总皂苷。考虑到黄精总皂苷中既有极性较大的皂苷,也有极性较小的皂苷和皂苷元,所以提取溶剂极性需要慎重选择,据预试结果,80%乙醇作为提取溶剂合适。
黄精因为含有大量的多糖,在加热炮制时可能发生氨基酸类成分与还原糖类成分的美拉德反应,从而产生5-羟甲基糠醛等反应产物。目前,5-HMF的药理作用仍存在争议。有研究认为5-HMF能够有效防治神经退行性疾病、认知损害和抗心肌缺血[19],可改变血液流变学,抗氧化,增进血红细胞变性[20],也有研究发现其具有刺激性(皮肤、黏膜、眼睛),可通过和人体蛋白结合而引起中毒,从而造成内脏损害和横纹肌麻痹,且具有潜在的生殖及遗传毒性[21]。
5-HMF的抗氧化作用、防治神经退行性疾病和认知损害作用支持了黄精的抗氧化、避免缺氧的神经细胞凋亡、改善学习记忆能力的药理作用,以上说明5-HMF对黄精的药理作用具有一定的贡献度,因此测定5-HMF在炮制过程中含量的变化情况对黄精的炮制工艺研究具有重要的价值。
