rL-hIFN-λ1对THP-1源巨噬细胞极化作用的影响
2018-12-28张日婷张垚章安伟张烜烽严玉兰
张日婷, 张垚, 章安伟, 张烜烽, 严玉兰
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 江苏大学附属人民医院呼吸内科, 江苏 镇江 212001)
巨噬细胞是一类由血液中单核细胞分化而来, 具有很强可塑性和多功能性的固有免疫细胞[1],当体内外微环境发生变化时,可分化为具有不同表型和功能的巨噬细胞,此过程称为巨噬细胞极化[2]。巨噬细胞可通过经典活化途径极化成M1型巨噬细胞,或是进入替代极化途径成为M2型巨噬细胞。
新城疫病毒(newcastle disease virus, NDV)是一种对人类无致病性的溶瘤病毒[3],可参与多种免疫效应[4-5]。本课题组前期研究发现,表达IFN-λ1的重组新城疫病毒(recombinant NDV expressing human IFN-lambda1, rL-hIFN-λ1)可更强地抑制肿瘤细胞生长和促进肿瘤细胞凋亡(如肺癌),同时可促进外周血单核细胞产生较高水平Th1细胞因子及抑制Th2细胞因子产生[3,6];但rL-hIFN-λ1在抑制肺癌发展过程中的具体免疫机制尚不清楚。本研究旨在探讨rL-hIFN-λ1诱导巨噬细胞极化进而调控外周免疫应答实现抑制肺癌的机制,并分析不同临床分期肺癌组织及恶性胸腔积液中巨噬细胞浸润表型特点。
1 材料与方法
1.1 材料
人外周血THP-1单核细胞系购自美国模式培养物保藏所 (ATCC; Rockville, MD, USA);rL-hIFN-λ1由本实验组成员于中国农业科学院哈尔滨研究所重组[6]。临床肺癌组织标本及胸腔积液标本取自2017年1月至2018年1月于江苏大学附属人民医院胸外科行手术切除的18例肺癌患者。 所有标本均经病理检查确诊为肺腺癌。按照国际抗癌联盟2017年肺癌TNM 分期标准进行分期,Ⅰ期、Ⅱ期、Ⅲ期各6 例。RPMI 1640培养基、胎牛血清(美国Gibco公司);青霉素/链霉素双抗溶液、胰蛋白酶、脂多糖(LPS)、佛波酯、Triton X-100、4%低聚甲醛(美国Sigma公司);CO2恒温培养箱(美国Thermo Fisher Scientific 公司);IFN-γ、IL-4(美国Peprotech公司);CD86兔抗鼠单克隆抗体、CD163兔抗鼠单克隆抗体(美国CST公司);Alexa Fluor 488标记羊抗兔IgG、Cy3标记兔抗羊 IgG (美国KPL公司);IL-2、IL-13、IL-10、TNF-α ELISA试剂盒(北京四正柏生物科技有限公司);Trizol(北京鼎国生物技术有限责任公司);SYBR Premix ExTaq试剂盒(日本TaKaRa公司);CD86、CD163及内参基因 GAPDH引物均由生工生物工程(上海)股份有限公司合成。
超净工作台(苏州净化设备有限公司);倒置显微镜(日本Olympus公司);荧光显微镜(德国Leica公司);紫外-可见分光光度计(Beckman Du730,美国);CFX96型实时定量PC仪,酶标仪(美国Bio-Rad公司);台式低温高速离心机(德国Eppendorf公司);荧光定量PCR仪(日本TaKaRa公司)。
1.2 细胞培养及诱导
THP-1细胞用含10%胎牛血清、100 U/mL链霉素、100 μg/mL青霉素的RPMI 1640培养基培养,孵育于37 ℃,5% CO2的细胞培养箱中。
1.3 构建THP-1来源的M0、M1、M2巨噬细胞模型
参照文献[7]报道的诱导方法将THP-1单核细胞系(3×105/mL) 铺于6孔板中,每孔2 mL培养基,加入佛波酯150 ng/mL刺激24 h,诱导其成为M0型巨噬细胞(未激活型);在M0基础上更换培养基,加入LPS(10 pg/mL)、IFN-γ(20 ng/mL)刺激24 h,诱导得到M1型巨噬细胞(经典途径激活型);向M0加入IL-4(20ng /mL)刺激24 h,诱导得到M2型巨噬细胞(替代途径激活型),倒置相差显微镜观察3组巨噬细胞形态。
1.4 免疫荧光检测rL-hIFN-λ1诱导巨噬细胞极化
用MOI=1.0的rL-hIFN-λ1病毒悬液干预M0型巨噬细胞,将得到的rL-hIFN-λ1-M0型巨噬细胞与M0、M1以及M2 4组巨噬细胞分别接种于免疫荧光专用培养皿,PBS洗3次×5 min/次;4%低聚甲醛4 ℃固定24 h;PBS 洗3次×5 min/次;0.1% Triton X-100 37 ℃恒温通透30 min;PBS洗3 次×5 min/次;3% BSA 37 ℃ 封闭30 min。弃封闭液,加入兔抗CD86 抗体(1 ∶200) 、山羊抗CD163抗体(1 ∶200),4 ℃孵育过夜;37 ℃复温30 min,PBS洗3次×5 min/次;加入Alexa Fluor 488标记羊抗兔IgG (1 ∶800)、Cy3标记兔抗羊 IgG (1 ∶800),37 ℃孵育1 h;PBS洗 3次×5 min/次,核荧光染料Hoechst 33342染色细胞核;随后加入防荧光淬灭封片剂,在荧光显微镜下以波长569 nm激光激发红色荧光,以波长488 nm激发绿色荧光,并观察。阳性细胞计数方法:随机选取9个视野,然后进行3 次单独重复实验,将视野中所有细胞纳入统计计算结果。
1.5 实时荧光定量PCR(qRT-PCR)检测巨噬细胞表型
离心收集上述各组巨噬细胞,Trizol 法提取各组巨噬细胞RNA,紫外分光光度计检测总RNA的D(260 nm)/D(280 nm)比值和浓度。根据说明书将所提取的RNA反转录为cDNA,然后作为模板行实时定量PCR反应,以GADPH为内参,检测各组巨噬细胞中CD86、CD163 mRNA表达。内参GAPDH上游引物:5′-CAGGAGGCATTGCTGATGAT-3′,下游引物:5′-GAAGGCTGGGGCTCATTT-3′;CD86上游引物:5′-TGCTCATCTATACACGGTTACC3′;下游引物:5′-TGCATAACACCATCATACTCGA-3′;CD163上游引物:5′-ATCAACCCTGCATCTTTAGACA-3′;下游引物:5′-CTTGTTGTCACATGTGATCCAG-3′。反应条件:95 ℃ 预变性10 s;95 ℃ 30 s,55 ℃ 60 s,72 ℃ 30 s,共40个循环。每个样品设3个复孔,重复3次,取均值。采用 2-ΔΔCt法计算基因相对表达量。
1.6 ELISA检测各型巨噬细胞分泌的细胞因子
收集各组巨噬细胞上清液,分别命名为CM-M0、CM-M1、CM-M2、CM-rL-hIFN-λ1,1 000 r/min 离心5 min,取上清液。按照人源 IL-2、IL-13、 IL-10及 TNF-α ELISA 试剂盒说明书操作,测定各组上清液450 nm波长处D值,绘制标准曲线并计算上述上清液中各种细胞因子浓度。每组样本设3个复孔,实验重复 3 次。
1.7 免疫组织化学法检测肺癌组织及胸腔积液中巨噬细胞表型
收集各组不同临床分期肺癌组织及胸腔积液,胸腔积液予2 500 r/min离心5 min,弃上清液;标本加入4%低聚甲醛固定、脱水、透明,常规石蜡包埋,制成4 μm切片;石蜡切片经二甲苯透明10 min,梯度乙醇脱水。3% H2O2室温孵育10 min,5% BSA室温孵育20 min。分别滴加兔抗CD86 抗体(1 ∶200)、山羊抗CD163(1 ∶200),PBS代替一抗作为阴性对照,4 ℃孵育过夜。次日滴加山羊抗兔IgG-HRP和兔抗山羊IgG-HRP抗体(均1 ∶1 000) ,室温孵育30 min。PBS冲洗,DAB显色剂染色,苏木素复染2 min,脱水,树胶封片,镜检。使用Image-Pro Plus 6.0扫描肺癌组织及胸腔积液中CD86、CD163平均光密度。
1.8 统计学分析
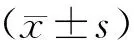
2 结果
2.1 THP-1来源各型巨噬细胞形态
THP-1诱导分化而来的THP-1-M0型巨噬细胞由悬浮生长转变成贴壁生长,细胞大小均一,分布均匀,呈规则圆形;LPS/IFN-γ诱导分化的THP-1-M1型巨噬细胞形态多样,广泛聚集贴壁生长,伸出伪足,呈长梭形;IL-4诱导细胞分化为THP-1-M2 细胞,同样呈聚集贴壁生长趋势,部分伸出伪足,但长梭形细胞相对较少。3组巨噬细胞形态之间存在差异,提示THP-1经不同刺激物诱导后可朝向不同类型巨噬细胞极化。见图1。
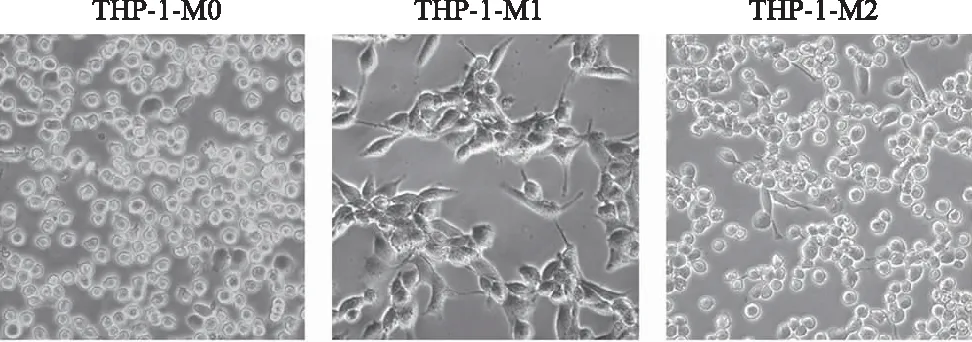
图1 M0、M1、M2型巨噬细胞形态(相差显微镜×400)
2.2 M1型巨噬细胞高表达CD86 mRNA, M2型巨噬细胞高表达CD163 mRNA
qRT-PCR结果显示,与THP-1-M0相比,THP-1-M1高表达M1型巨噬细胞表型特异标志物CD86 mRNA(t=10.51,P<0.01),THP-1-M2高表达M2型巨噬细胞表型特异性标志物CD163 mRNA (t=3.44,P<0.05)。综上,LPS/IFN-γ和IL-4可分别有效诱导THP-1-M0巨噬细胞成功分化为M1和M2型巨噬细胞。见图2。
a: P<0.01,b: P<0.05
2.3 rL-hIFN-λ1促进THP-1-M0巨噬细胞向M1型巨噬细胞极化
由图3可见,与THP-1-M0相比,rL-hIFN-λ1诱导得到的巨噬细胞高表达M1标志物CD86 mRNA(t=4.58,P<0.05),而低表达M2标志物mRNA(t=2.96,P<0.05),提示rL-hIFN-λ1可促进THP-1-M0巨噬细胞向M1型巨噬细胞而非M2型巨噬细胞极化。免疫荧光结果显示,THP-1-M1型巨噬细胞CD86阳性率明显高于THP-1-M2型巨噬细胞,而CD163阳性率低于THP-1-M2组。同时rL-hIFN-λ1极化的巨噬细胞的CD86阳性率同样高于CD163,进一步证实rL-hIFN-λ1可以促进THP-1 M0巨噬细胞向M1型巨噬细胞极化。见图4。

图3 qRT-PCR检测rL-hIFN-λ1组巨噬细胞相关mRNA的表达
2.4 各型巨噬细胞炎症因子分泌
ELISA检测结果显示,与THP-1-M0组相比,THP-1-M2组巨噬细胞上清液中IL-10和IL-13表达明显增加(t=5.80,8.45,P均<0.01),TNF-α和IL-2表达明显减少(t=3.67,12.92,P均<0.05),而THP-1-M1组巨噬细胞上清液则与之相反。同时,与THP-1-M0组相比,THP-1-rL-hIFN-λ1组上清液中TNF-α和IL-2明显升高(t=24.74,7.14,P均<0.01),而IL-10和IL-13表达明显降低(t=3.46,19.05,P均<0.05)。见表1。

图4 各组巨噬细胞CD86及CD163水平比较


组别IL-2IL-10IL-13TNF-αTHP-1-M051.21±9.1558.14±6.96132.77±19.2541.73±4.34THP-1-M190.13±12.20a42.31±6.13b56.95±13.96a227.88±24.59aTHP-1-M229.31±8.49b77.21±14.89a173.07±11.28a31.02±6.66bTHP-1-rL-hIFN-λ174.64±5.22a44.56±4.93b51.73±6.60b218.15±19.64aF值9.489.306.9842.72P值<0.01<0.01<0.05<0.01
a:P<0.01,b:P<0.05,与THP-1-M0组比较
2.5 肺癌组织及胸腔积液中相关蛋白的表达
免疫组化结果显示,临床Ⅰ期肺癌组织中CD86表达明显多于Ⅱ、Ⅲ期肺癌组织(t=4.53,6.82,P均<0.01),而CD163表达则明显低于临床Ⅱ、Ⅲ期肺癌组织(t=3.88,6.39,P均<0.01);同时癌性胸腔积液中CD86表达较CD163表达少(t=11.19,P<0.01)。由此提示,肺癌的临床分期进展与M1型巨噬细胞浸润程度呈负相关。见图5。
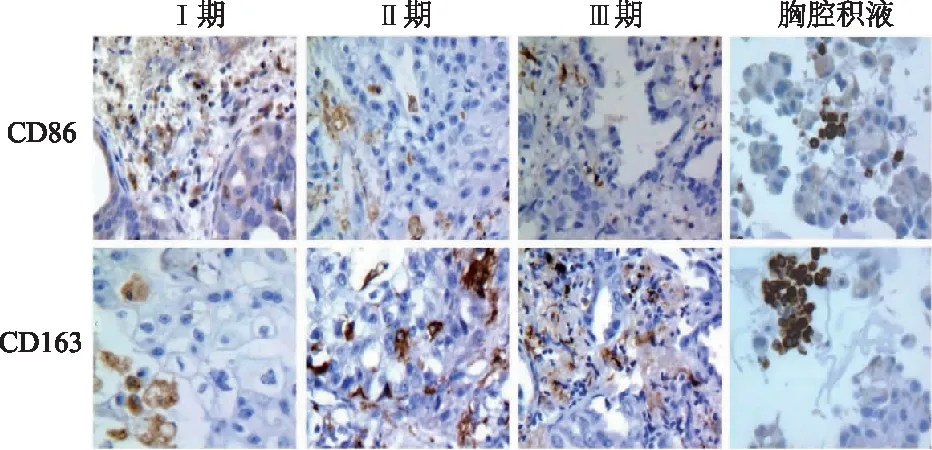
图5 不同临床分期肺癌组织和胸腔积液中CD86和CD163蛋白的表达( SP染色×200 )
3 讨论
巨噬细胞在肿瘤进展中发挥重要的作用,在外界不同的刺激下可分别向抑制肿瘤生长的M1型巨噬细胞和促进肿瘤的发生、发展、侵袭和转移、抑制适应性免疫应答的M2型巨噬细胞极化[8]。本实验利用THP-1人源外周血单核淋巴细胞构建巨噬细胞模型,经从形态到表面分子以及分泌的细胞因子的检测,证实LPS/IFN-γ 和IL-4可以分别诱导THP-1-M0型巨噬细胞向M1、M2型巨噬细胞极化,证实巨噬细胞具有很强的可塑性。
研究发现,促进M1型巨噬细胞极化可有效抑制肿瘤进展。rL-hIFN-λ1是可稳定表达IFN-λ1的新城疫病毒,其受体广泛存在于CD4+T、PBMCs及NK细胞,与受体结合可发挥类似IFN-γ的作用,促进人源巨噬细胞分泌IL-12 p40调动机体免疫应答[9-11],故我们推测rL-hIFN-λ1的抗肿瘤效应可能与其能够促进M0型巨噬细胞向M1型巨噬细胞极化密切相关。本研究结果显示,rL-hIFN-λ1能发挥类似LPS/IFN-γ的作用,诱导THP-1-M0型巨噬细胞高表达M1型巨噬细胞标志物CD86 mRNA,并且释放M1型巨噬细胞因子,如IL-2、TNF-α,同时抑制M2型巨噬细胞标志物CD163 mRNA的表达和抑制M2型巨噬细胞因子IL-13、 IL-10的释放,提示 rL-hIFN-λ1具有促进M0巨噬细胞向 M1 极化,抑制其向 M2极化的能力。
浸润到肿瘤基质中的巨噬细胞主要以M2型为主,又被称作肿瘤相关巨噬细胞,且与肿瘤的良好预后呈负相关,而 M1型巨噬细胞数量与良好预后呈正相关[8,12]。本研究免疫组化结果显示,临床Ⅰ期肺腺癌组织中浸润的巨噬细胞以M1型为主,而临床Ⅱ期、Ⅲ期肺腺癌组织中以M2型巨噬细胞浸润为主,且恶性胸腔积液中也以M2型巨噬细胞浸润为主,与上述文献报道一致。由此提示巨噬细胞表型与肺腺癌临床分期及肿瘤恶性生物学行为密切相关,巨噬细胞的极化状态可作为判断肺腺癌患者临床预后的参考指标,但巨噬细胞浸润表型特点与其他病理类型肺癌临床预后之间的相关性有待进一步探讨。
综上所述,肺癌临床发展进程与巨噬细胞浸润表型密切相关,rL-hIFN-λ1可促进THP-1源巨噬细胞向M1极化。巨噬细胞高度的异质性和可塑性决定了M1型巨噬细胞不仅可由M0型巨噬细胞极化而来,也可以由M2型巨噬细胞极化而来[13]。因此我们推测rL-hIFN-λ1 不仅可以促进M0型巨噬细胞向M1型巨噬细胞转化,还可能诱导M2型巨噬细胞向M1型巨噬细胞转化,从而减少促肿瘤发生发展的M2型比例,但具体机制仍有待进一步研究证实。
