补骨脂酚对阿霉素心肌细胞损伤的保护作用及机制研究
2018-12-24陆晨曦韩跃虎辛振龙闫娟娟韩梦珍王立伟吕德文金振晓
陆晨曦,韩跃虎,辛振龙,闫娟娟,李 天,韩梦珍,姬 婷,王立伟,吕德文,金振晓,杨 阳
(1.西北大学 生命科学学院,陕西 西安 710069;2.空军军医大学 第一附属医院 心血管外科,陕西 西安 710032;3.空军军医大学 基础医学院,陕西 西安 710032)
阿霉素(Adriamycin,ADR)属于蒽环类抗癌药,是目前应用最广泛和有效的抗肿瘤药之一[1],其主要的严重副作用是累积性、剂量依赖性的心肌毒性反应,可进一步发展成不可逆性心肌损伤,最终导致心力衰竭[2],严重限制了ADR的临床应用。心肌细胞凋亡和坏死被认为是ADR诱导心肌病变发展过程中的主要因素,自我吞噬和细胞老化等其他细胞死亡方式也参与此过程。ADR诱导心肌细胞死亡的机制可能包括:促进氧化应激、细胞内钙失调、线粒体损伤、DNA损伤、相关转化因子的活化以及细胞凋亡通路紊乱等[3-4]。有关ADR诱导心脏毒性的确切机制至今未完全阐明,由于ADR的化学结构使其在代谢过程中易产生活性氧,许多研究表明氧化应激可能在其中扮演关键的角色[5]。因此,寻找减轻ADR诱导心肌损伤的有效物质,对促进ADR更好地应用于抗肿瘤治疗以及降低ADR诱发心脏毒性的风险有十分重要的意义。
补骨脂为豆科植物补骨脂(PsoraleacorylifoliaLinn)的果实,是一种常见的中药材。研究发现,补骨脂中含有多种化学物质,如补骨脂酚(Bakuchiol,BAK)、补骨脂素、补骨脂定、异补骨脂素、巴库查耳酮、补骨脂二氢黄酮甲醚等单萜酚类、香豆素类、黄酮类化合物[6]。1966年,Mehta等[7]首次从补骨脂中提取分离得到BAK。目前国内外关于BAK的研究报道日益增多,已发现BAK具有降糖降血脂、抗炎、抗菌、抗氧化保护肝细胞、抑癌、抗抑郁、植物雌激素等多种药理活性,极具开发应用前景[8-10]。但是,BAK对于ADR心肌损伤是否有保护作用及其具体机制尚未见报道。本研究旨在评价BAK处理对ADR心肌细胞损伤的保护作用及其具体的作用机制。
1 材料和方法
1.1 实验材料
BAK(陕西省宝鸡市辰光生物科技有限公司)、二甲基亚砜(生工生物科技有限公司,上海)、MUSE细胞活力试剂盒(Merck Millipore公司,德国)、蛋白酶抑制剂、磷酸酶抑制剂和ROS活性检测试剂盒(碧云天生物科技有限公司);AMPK,p-AMPK,PGC1-α和β-actin抗体(博奥森生物科技有限公司);BCA蛋白定量试剂盒(北京索莱宝科技有限公司);羊抗兔二抗(赛维尔生物科技有限公司);乳酸脱氢酶(LDH)检测试剂盒(南京建成生物工程研究所)。
1.2 实验方法
1.2.1 细胞ADR损伤模型建立 通过细胞实验来模拟ADR诱导心肌损伤模型。具体操作流程如下:复苏H9c2细胞,传代3次,细胞融合度达到70%~80%后,将培养液换成无血清培养液,给予梯度浓度的ADR处理24h,随后使用MUSE细胞活力分析仪进行活力检测。
1.2.2 实验分组及给药方式 细胞实验分为3组,即对照组(Control组);ADR处理组(ADR组);不同浓度BAK保护组(BAK+ADR组)。BAK溶解于DMSO,ADR溶解于DMEM,对照组加入等体积的DMSO。
1.2.3 H9c2心肌细胞活力检测 各组心肌细胞处理结束后,吸取上清液,加入胰蛋白酶消化5min,再加入10%(体积分数)血清的DMEM培养液终止消化,离心,1 500r/min,3min,弃上清,将细胞团悬浮于2mL PBS中,根据MUSE细胞活力分析仪使用说明,吹打均匀细胞悬液,吸取20μL,加入380μL MUSE细胞活力试剂,混匀后避光孵育5min,将待检测液置于细胞活力分析仪进行检测。
1.2.4 H9c2心肌细胞中LDH水平检测 处理结束后,收集细胞培养液上清,使用 2,4 二硝基苯肼显色法检测上清中LDH,检测步骤严格依照LDH含量检测试剂盒说明书进行。
1.2.5 H9c2心肌细胞中ROS含量检测 处理结束后,弃上清,用预冷的PBS洗涤细胞,随后严格按照试剂盒说明书进行ROS含量的检测。
1.2.6 H9c2心肌细胞凋亡检测 胰酶消化,收取实验样品,严格按照MUSE细胞活力分析仪操作说明和MUSE凋亡试剂盒说明进行检测。
1.2.7 心肌细胞中AMPK,p-AMPK和PGC1-α蛋白表达检测 具体操作流程如前所述[11],在电泳加样孔内蛋白样品经电泳、转膜、封闭等步骤后于4℃孵育抗AMPK(体积比1∶500),p-AMPK(体积比1∶500),PGC1α(体积比1∶500)和β-actin(体积比1∶2 000)一抗,过夜;继而室温孵育相应二抗(体积比1∶5 000)1 h。使用MiNiChemi610成像系统检测蛋白质条带并使用Image J软件定量。
1.3 统计分析
用GraphPad6.0统计学软件进行统计分析,实验数据均以均数±标准差(mean±SD)表示;差异显著性检验采用单因素方差分析,比较两组间差异用 LSD-t检验。P< 0.05表示有统计学意义。
2 结 果
2.1 ADR处理可以引起心肌细胞损伤
不同浓度ADR损伤可显著降低H9c2细胞活力,并呈浓度依赖性(与Control组相比,P<0.05),中当ADR浓度为2μM时,细胞活力下降约50%,损伤程度合适,将该浓度用于进一步实验(图1)。

A为H9c2细胞损伤后显微镜下照片(200×);B为细胞活力的统计图。结果用mean±SD表示,n=6。* vs. Control,P<0.05;# vs. 0.5μmol/L ADR,P<0.05;# vs. 0.5μmol/L ADR,P<0.05;& vs. 0.5μmol/L ADR,P<0.05;@vs. 0.5μmol/L ADR,P<0.05;$ vs. 0.5μmol/L ADR,P<0.05。图1 不同浓度ADR损伤H9c2心肌细胞的细胞活力检测Fig.1 Effects of ADR with different the viability of H9c2 cells
2.2 BAK处理可逆转ADR引起的心肌细胞的活力降低
与ADR损伤组相比,不同浓度BAK可减轻H9c2细胞损伤,增加细胞活力(P<0.05),当BAK浓度为1.25μmol/L保护效果最佳(图2)。

A为H9c2细胞损伤后显微镜下照片(200×);B为细胞活力的统计图。结果用mean±SD表示,n=6。* vs. Control,P<0.05;# vs. 0.5μmol/L ADR,P<0.05;# vs. 0.5μmol/L ADR,P<0.05;& vs. 0.5μmol/L ADR,P<0.05;@vs. 0.5μmol/L ADR,P<0.05;$ vs. 0.5μmol/L ADR,P<0.05。图2 不同浓度BAK对ADR损伤后细胞活力的影响Fig.2 Effects of BAK with different concentratiorts on the cell viability injured by ADR
2.3 BAK处理可降低ADR引起的心肌细胞LDH水平
采用LDH检测试剂盒检测H9c2心肌细胞上清液中LDH水平。与Control组相比,ADR组心肌细胞培养液中LDH水平明显上升(P<0.05),而BAK处理可逆转此效果(图3)。

结果用mean±SD表示,n=6。* vs. Control,P<0.05;# vs. ADR,P<0.05。图3 BAK对ADR损伤后培养液中LDH水平检测Fig.3 Effects of BAK on the LDH release in the culture medium injured by ADR
2.4 BAK处理可减轻ADR引起的心肌细胞氧化应激损伤
采用活性氧检测试剂盒检测H9c2心肌细胞内ROS水平。结果显示,与Control组相比,ADR组心肌细胞内ROS水平明显上升(P<0.05),而BAK处理可以明显降低ADR引起的心肌细胞内ROS水平(P<0.05)。

A为荧光检测的照片(100×);B为细胞ROS水平统计图。结果用mean±SD表示,n=6。* vs. Control,P<0.05;# vs. ADR,P<0.05。图4 BAK对ADR损伤后细胞内ROS水平的影响Fig.4 Effects of BAK on the cellular ROS level in jured by ADR
2.5 BAK处理可减轻ADR引起的心肌细胞凋亡
采用MUSE细胞活力分析仪检测细胞的凋亡率。结果显示,与Control组相比,ADR组心肌细胞的凋亡率显著上升(P<0.05),而BAK处理可以明显减轻ADR引起的心肌细胞凋亡(图5)。
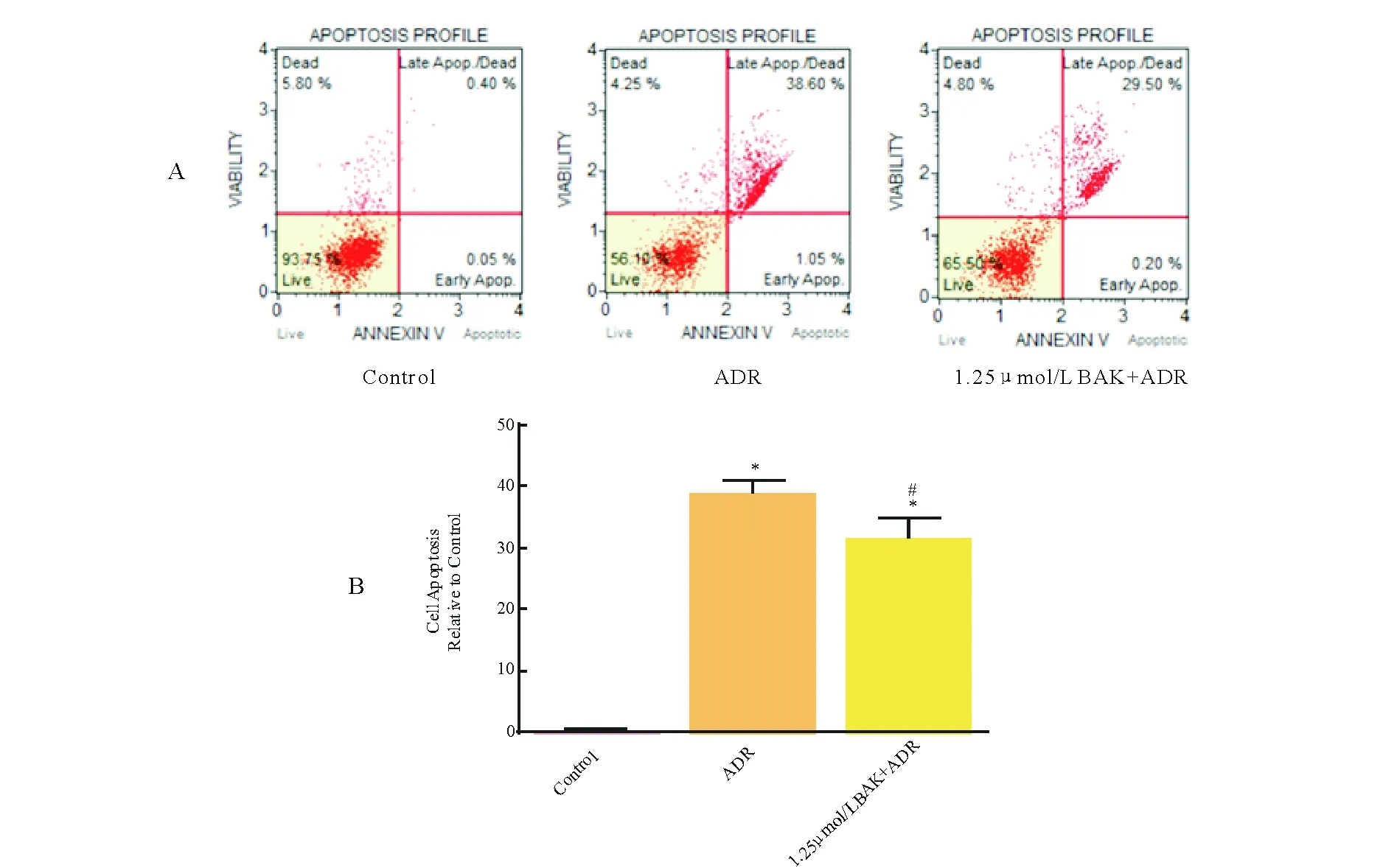
A为MUSE细胞活力分析仪检测结果;B为细胞凋亡统计图。结果用mean±SD表示,n=6。* vs. Control,P<0.05;# vs. ADR,P<0.05。图5 BAK对ADR损伤后细胞凋亡率的影响Fig.5 Effects of bAK on the cell apoptotic rate unjured by ADR
2.6 BAK可以逆转ADR下调的AMPK/PGC-1α信号通路相关分子蛋白水平
采用Western blot方法检测p-AMPK,AMPK和PGC1α蛋白表达水平。与Control组相比,ADR处理可显著下调p-AMPK和PGC1α的表达(P<0.05),BAK处理可以逆转该作用(图6)。

A为典型的Western blot条带图,B为各条带灰度值统计图。结果用mean±SD表示,n=3。* vs. Control,P<0.05;# vs. ADR,P<0.05。图6 BAK对ADR损伤后细胞中AMPK/PGC-1α信号通路相关分子的影响Fig.6 Effects of BAK on the AMPK/PGC-12 signaling pathway in jured by ADR
3 讨 论
ADR为一种蒽环类广谱抗肿瘤药物,可直接嵌入肿瘤细胞DNA抑制其核酸合成,从而发挥抗肿瘤活性[12]。大量的临床实践以及实验研究表明,ADR在发挥抗肿瘤活性的同时可对正常细胞产生毒性作用,对机体产生不可逆的损伤。由于ADR具有易于在心肌细胞中积累的特性,其毒性作用在心肌组织中尤为明显,并且呈现剂量依赖性[13]。ADR的心肌毒性作用极大地限制了其在肿瘤治疗中的应用,当其累积剂量较大造成严重心肌损伤时还可增加肿瘤患者的死亡率[12, 14]。因此寻找有效的治疗药物缓解ADR引起的心肌损伤具有重要临床意义。
ADR作用于心肌细胞会产生大量的ROS,这是目前被普遍研究并得到广泛认可的毒性机制。ADR进入心肌细胞后,可利用还原型辅酶Ⅱ(NADPH) 或内皮型一氧化氮合酶(eNOS)转变为半醌ADR,半醌自由基再进一步转变成 C7 自由基[15]。该自由基十分活跃,可以和氧分子、细胞内其他分子发生作用。尤其可作用于细胞膜及各种细胞器膜上磷脂中的多价不饱和脂肪酸,引发脂质过氧化,使细胞膜的结构发生改变、扭曲,并影响生物膜上功能蛋白质的位置或构型,降低膜的流动性,增加通透性,从而影响细胞膜的生物调节功能及离子转运功能,并最终导致膜的完整性遭到破坏,造成心肌细胞损伤[16]。
值得关注的是,BAK具有多种生物学活性,如抗氧化应激、抗凋亡、抗炎、抗菌和抗老化等[17]。但是,BAK能否减轻ADR引起的心肌损伤目前尚无报道。氧化应激是造成细胞毒性的关键因素。正常情况下,机体内只有少量氧气被转化为ROS,且可以被机体内抗氧化酶及时清除。但在细胞受损后,可产生过量活性氧和活性氮,进而引起脂质、DNA 和蛋白质等过氧化[18],最终导致细胞凋亡和坏死。Adhikari[19]等针对脂质和蛋白质的氧化损伤,研究了BAK对各种氧化剂如Cl3CO2、亚油酸过氧化氢自由基、脂类自由基(LOO-)、DPPH自由基和OH-自由基等的清除活性,通过光脉冲辐解技术分析,首次证明了BAK可以通过清除自由基来发挥其抗氧化作用。本研究通过对ROS检测发现,ADR损伤会引起ROS的显著上调,而BAK处理可以逆转该作用。
LDH是存在于细胞浆内的酶,当心肌细胞受损时,细胞膜通透性增大,有的甚至导致膜破裂,由此大量释放出LDH,并且研究发现LDH的释放量随心肌细胞损伤程度的增加而增加。因此,在体外实验中,LDH是一个可以被信赖并且被普遍接受的损伤指标。本研究发现ADR对H9c2心肌细胞的LDH释放有显著上调的作用,而BAK可以显著降低H9c2心肌细胞培养液上清中LDH的水平,证实其可缓解ADR对H9c2心肌细胞的损伤作用。
细胞凋亡是由基因控制的主动有序的死亡。心肌细胞凋亡是心力衰竭发生、发展中的一个重要的病理生理基础。研究发现,细胞凋亡促使心脏疾病由代偿期向失代偿期转化[20],此外心衰的严重程度与心肌细胞凋亡的程度呈正相关[21]。因此,细胞凋亡可以作为在体外实验中检测心脏疾病严重程度的一个重要指标[22]。本研究验证了ADR可促进H9c2心肌细胞凋亡,而BAK可抑制ADR对心肌细胞凋亡的诱导。
AMPK作为机体的能量调控器,当器官出现异常尤其是当心脏受损后对能量需求会显著增加[23],活化的AMPK会加速糖的摄取和脂肪酸氧化给心肌组织提供能量,并且抑制心肌细胞的凋亡,从而减轻心肌组织的损伤[11]。本研究结果显示,ADR损伤可以降低细胞p-AMPK和其下游分子PGC1α的表达,而BAK可以逆转此作用,提示AMPK/PGC1α通路在BAK抗ADR心肌损伤中发挥重要作用。
综上所述,ADR可对H9c2心肌细胞造成明显损伤,并导致AMPK/PGC1α通路抑制。BAK可显著减轻ARD引起的H9c2心肌细胞损伤,其作用与激活AMPK/PGC1α信号通路有关。
