罗氏沼虾转录组SSR标记信息分析
2018-12-19王传聪唐修阳欧江涛
王传聪, 唐修阳, 项 杰, 欧江涛
(盐城工学院海洋与生物工程学院,江苏盐城 224051)
罗氏沼虾别称马来西亚大虾,隶属节肢动物门、甲壳纲、十足目、长臂虾科、沼虾属。原产于南亚、东南亚以及大洋洲北部等地区,生活在淡水或咸淡水水域,自然栖息于受潮汐影响的河口区,是一种较大型的热带经济虾类[1],具有生长快、肉质营养成分好以及养殖周期短等优点,素有“淡水虾王”之称[2]。然而,随着集约化养殖的快速发展,一些严重的疾病已在罗氏沼虾中流行,包括由新型病原——螺原体引起的2010年罗氏沼虾螺原体病,引发大规模的死亡,给水产养殖业造成重大经济损失。这些水产动物病害在带来巨大经济效益损失的同时,也严重制约了罗氏沼虾产业的可持续发展[3]。因此,及时开展罗氏沼虾的抗病研究是极为重要的。
微卫星标记是目前最常用的分子标记之一。由于与其他分子标记相比,它具有保守性高、多态性丰富、在基因组中分布广泛等特点[3],近年来,在动物遗传连锁图谱的构建、种质鉴定、遗传多样性分析以及分子标记辅助育种等领域被广泛应用。目前在水生动物的相关研究中,研究者已经对牙鲆、二长棘鲷、兴国红鲤、中国明对虾等品种进行了转录组测序,并基于测序结果对所得数据进行了深入分析[4-7]。因此,开展罗氏沼虾转录组简单重复序列(simple sequence repeat,简称SSR)的研究具有重要的理论和现实意义。本研究通过对罗氏沼虾转录组测序,筛选出SSR位点,对其进行数量分析和多态性评价等,从而为罗氏沼虾基因克隆、遗传图谱构建、遗传多样性分析以及为罗氏沼虾病害防治和选育种工作等提供基础数据。
1 材料与方法
1.1 试验材料
罗氏沼虾:购于江苏省南京市仙林农贸市场,个体质量在20~25 g,共计100尾,用PCR方法检测螺原体,结果均呈阴性,在26~28 ℃水温条件下养殖备用。螺原体MR-1008:分离于江苏省高邮市自然发病的罗氏沼虾,在R2液体培养基中于30 ℃孵育48 h,待其生长到最具有侵染能力的对数期备用。
1.2 总RNA提取
采用TRIzol提取法提取罗氏沼虾肝胰腺组织总RNA,提取产物用15 g/L琼脂糖凝胶电泳进行质检。质检合格的样品保存在干冰中送往联川生物公司进行测序。
1.3 RNA测序及组装
经Illumina HiSeq2000/2500进行测序,在健康罗氏沼虾和螺原体感染罗氏沼虾的肝胰腺组织中得到总mRNA原始数据(raw reads)分别为 53 070 612、61 244 504条,对raw reads进行过滤得到有效数据(clean reads)分别为 52 757 004、60 719 728条(表1)。将得到的有效数据使用Trinity软件进行拼接,最终得到33 450条Unigenes(总长度 29 327.225 kb)对应43 405个转录本,长度在200~2 000 bp之间的超过85%,符合基因转录本的长度规律(表2)。

表1 测序数据预处理结果
注:Q20和Q30分别代表碱基被测错的概率P为1%和1‰,其计算公式为Q= -10lgP。GC为G和C的数量总和占总碱基数量的百分比,用于检测有无AT、GC分离现象。
1.4 SSR标记筛选
SSR检测是以组装出来的Unigene作为参考序列,使用MISA软件批量识别和定位所有SSR,然后对罗氏沼虾转录组SSR数据进行分类统计分析。
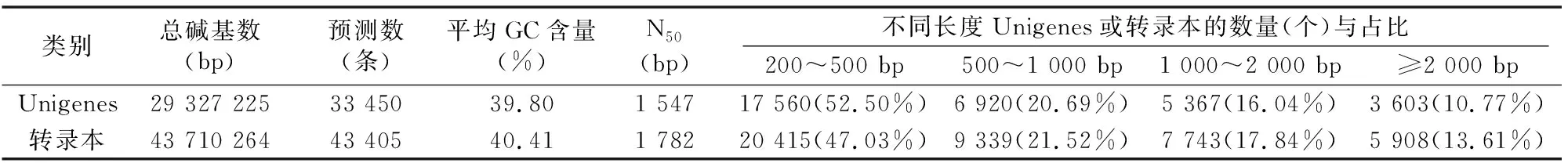
表2 拼接结果统计
注:N50表示将Unigenes从长到短排序,依次累加Unigenes碱基数后,Unigenes总碱基数50%的Unigenes的长度,转录本同。
2 结果与分析
2.1 罗氏沼虾转录组中SSR位点的数量与分布
对组装所得的33 450条unigenes序列进行比对筛选,结果发现15 356个SSR位点,分布在12 930条Unigenes上,发生频率(含有SSR的Unigenes条数占总Unigenes条数的比例)为38.65%,其中10 504条Unigenes序列只含有单个SSR位点,2 426条Unigenes序列含有2个或2个以上的SSR位点。由表3可知,罗氏沼虾的SSR序列平均距离为1.91 kb,总长度为230 820 bp,平均长度为15 bp。
罗氏沼虾转录组中各种SSR出现频率差异较大,各类型出现的频率不同,主要为单核苷酸、二核苷酸、三核苷酸重复(图1)。单核苷酸重复的SSR数量最多,其分布频率为17.70%,占罗氏沼虾总SSR的38.56%,其次为二核苷酸重复,其分布频率为16.53%,占罗氏沼虾总SSR的36.00%,三核苷酸重复的SSR分布频率为10.71%,占罗氏沼虾总SSR的23.32%。四核苷酸、五核苷酸、六核苷酸重复类型的SSR类型较少,分布频率分别为0.53%、0.24%、0.21%,分别占罗氏沼虾总SSR的1.15%、0.52%、0.45%。
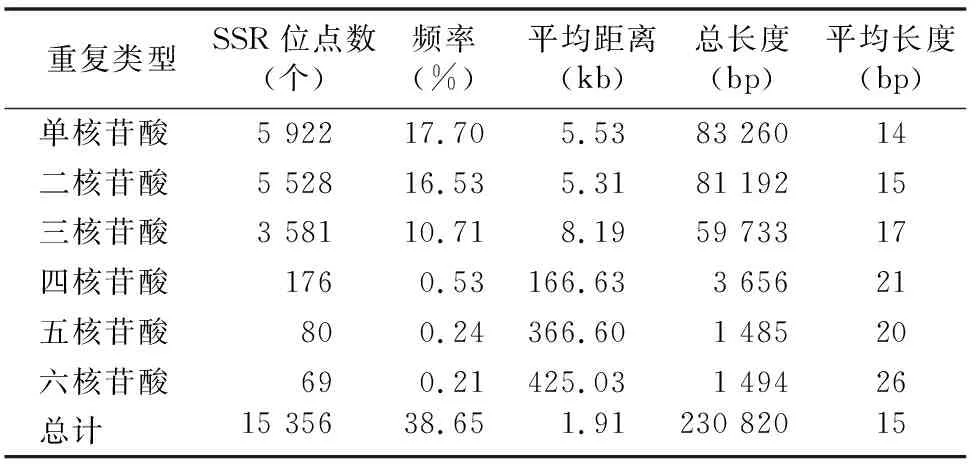
表3 SSR在罗氏沼虾转录组中出现的频率

由表4可知,罗氏沼虾SSR重复次数为5、6、7、12次的SSR位点较多,分别为2 245、4 540、1 647、1 796个,分别占罗氏沼虾总SSR的14.62%、29.56%、10.73%、11.70%,其次为重复8、13、14次的SSR位点,分别为938、1 216、925个,分别占总SSR的6.11%、7.92%、6.02%,重复次数≥16次的SSR位点相对较少,总共为1 277个,占总SSR的8.32%。
2.2 罗氏沼虾转录组中SSR的特点
罗氏沼虾转录组中共搜索到512种不同序列类型的SSR,其中单核苷酸、二核苷酸、三核苷酸、四核苷酸、五核苷酸和六核苷酸重复序列类型分别有40、66、201、89、60、56种。单核苷酸中出现的重复类型多为A/T,分别占罗氏沼虾总SSR的39.33%,C/G类型单核苷酸序列的SSR非常少。在二核苷酸重复中主要以GA/TC、AG/CT和AT/TA为主,分别为1 184、1 501、1 300个,分别占二核苷酸重复SSR的21.42%、27.15%、23.52%,分别占罗氏沼虾总SSR的7.71%、9.77%、8.47%。三核苷酸重复在罗氏沼虾总SSR中的占比较大,其重复类型见表5。各种三核苷酸重复类型出现的数量差别较大,其中AAT/TTA出现的数量最多,为216个,出现频率为0.65%,占罗氏沼虾总SSR的1.41%;其次为AAG/TTC、ATT/TAA、CCT/GGA、CTC/GAG、CTT/GAA,分别为204、187、197、191、215个,分别占罗氏沼虾总SSR的1.33%、1.22%、1.28%、1.24%、1.40%;其中CGG/GCC出现的数量最少,仅为8个,占罗氏沼虾总SSR的0.05%。
2.3 罗氏沼虾转录组SSR多态性评价
由图2可知,罗氏沼虾SSR重复长度分布中重复长度最小为12 bp,最大为25 bp,平均长度为15 bp。其中重复长度主要为12~16 bp及18 bp,占罗氏沼虾总SSR的86.33%,其次是重复长度为17 bp及20~22 bp,占罗氏沼虾总SSR的11.91%,重复长度在19 bp和≥23 bp的SSR位点数相对较少,分别仅占罗氏沼虾总SSR的0.79%、0.96%。根据该结果,可推测该研究中Ⅱ型SSR(长度为12~<20 bp)的比例为89.07%,具有中等多态性,有较高的潜在可用性。而具有高度多态性的Ⅰ型SSR(长度≥20 bp)则较少。
2.4 含SSR位点Unigene的功能注释
利用软件对成功筛查到的SSR位点所在的12 930条Unigene序列进行功能注释。通过Blast比对,有410个Unigene被注释到NCBI Nr数据库的已知序列,并呈现较高的相似性和同源性,但有96.83%的Unigene未得到任何注释。
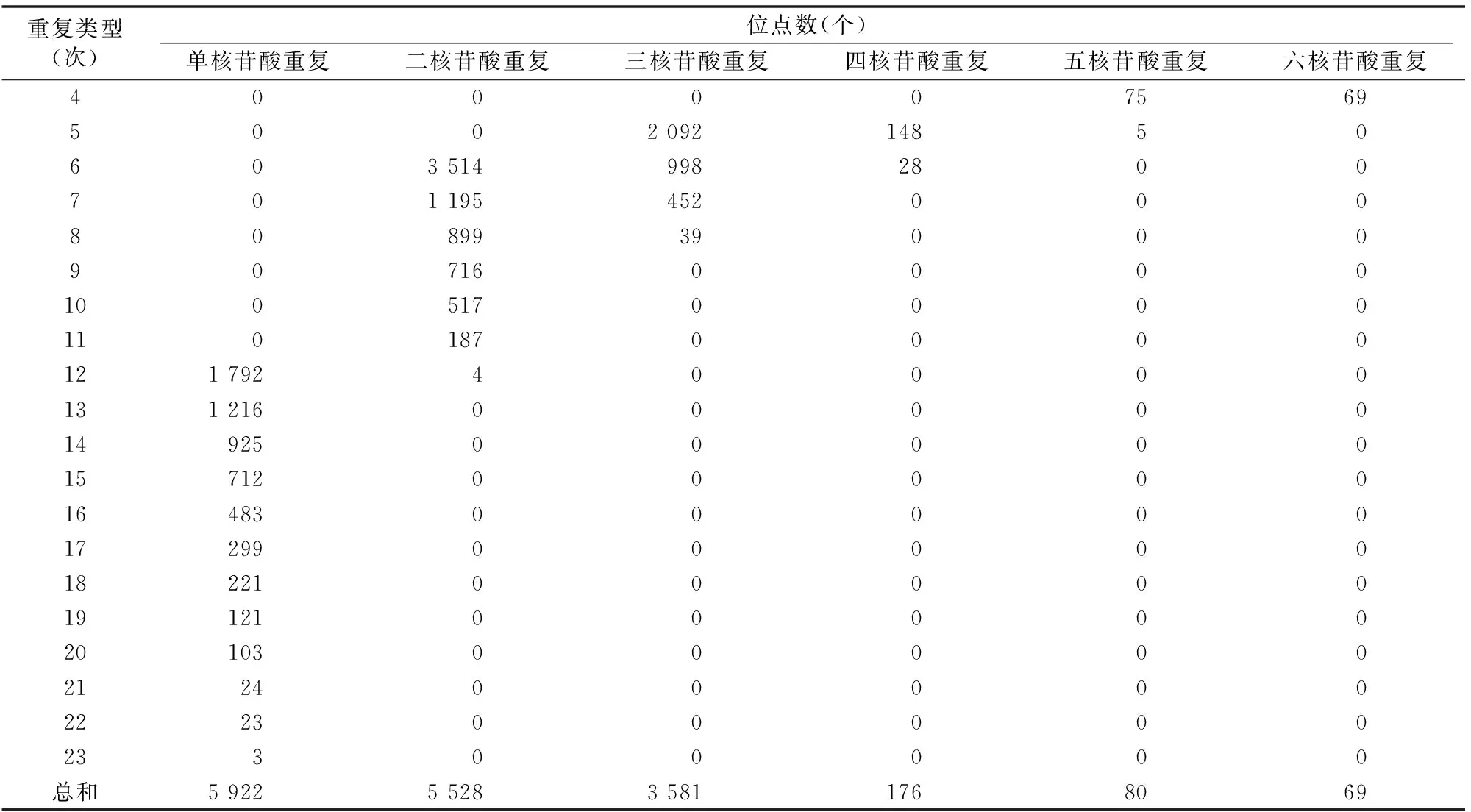
表4 罗氏沼虾SSR重复次数分布

将15 356条SSR位点所在的12 930条Unigene序列注释到KOG数据库中进行相关基因功能的预测和分类。结果显示其中的275条Unigene(2.13%)能够在KOG找到相应的注释信息,根据其功能可以被分为22类(图3),并对其进行数量统计。从分析结果可以看出,这275条被注释的Unigene功能种类较为全面,涉及大多数的生命活动过程或功能。“一般功能预测”是最大的一个分类,包含57条Unigene。其次是“信号转导机制”“翻译后修饰,蛋白质周转,分子伴侣”和“RNA加工和修饰”,分别包含34、26和19条Unigene。“核结构”这个分类中包含的Unigene数最少,仅有1条。
3 讨论
本研究通过IlluminaHiSeq2000/2500高通量测序平台对罗氏沼虾肝胰腺组织转录组测序,从大量组装所得转录组Unigene序列中筛选获得15 356个SSR位点。相对于传统微卫星标记的筛选方式,此方法筛选效率较高,工作量相对较小,适合大范围开拓SSR标记位点[7]。
SSR在整个基因组的不同位点都有分布,多态信息含量(polymorphism information content,简称PIC)起衡量基因位点多态性的作用,通常PIC能反映某个群体的遗传变异程度、位点多样性等[8]。另外SSR片段长度也是判断其多态性的重要依据[9]。从转录组数据筛选得到的SSR中,重复序列长度在12 bp以上的SSR标记位点数占总SSR数的76.95%,多态性较丰富,基于该研究结果能够进行有针对性的引物设计。在数量性状位点(QTL)定位研究及遗传连锁图谱的构建中,SSR多态性越高,所建立的图谱越精密和精确,基因的定位越精准[10-11]。
随着微卫星辅助育种技术的广泛应用,通过遗传操作培养出罗氏沼虾抗病品种,是虾病控制中一个值得选择的方法。已有的研究表明,疾病发生时群体内会有显著的变异,通过微卫星等标记对发病动物中死亡群体和存活群体的遗传变异进行研究,有望获得与抗病性状相连锁的标记,进而对抗病基因进行标记和定位以培育出具有持久抗病能力的优良品种[12]。
本研究对罗氏沼虾SSR的分布特征进行分析,不仅在RNA水平上体现了罗氏沼虾SSR的分布特点和规律,而且也为开发罗氏沼虾功能基因奠定了SSR分子标记基础,同时也为罗氏沼虾QTL定位、基因克隆、遗传结构分析及其他遗传学研究提供了有效的分子标记。
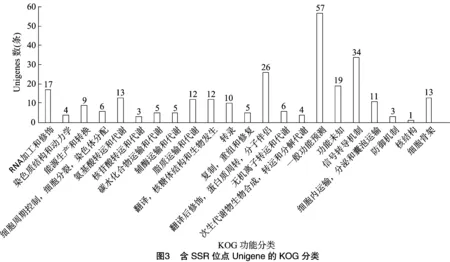

表5 三核苷酸SSR不同重复单元的比例
注:频率为含有SSR的Unigenes数与总Unigenes数之比;占比为该重复基元SSR占总SSR的比例。
