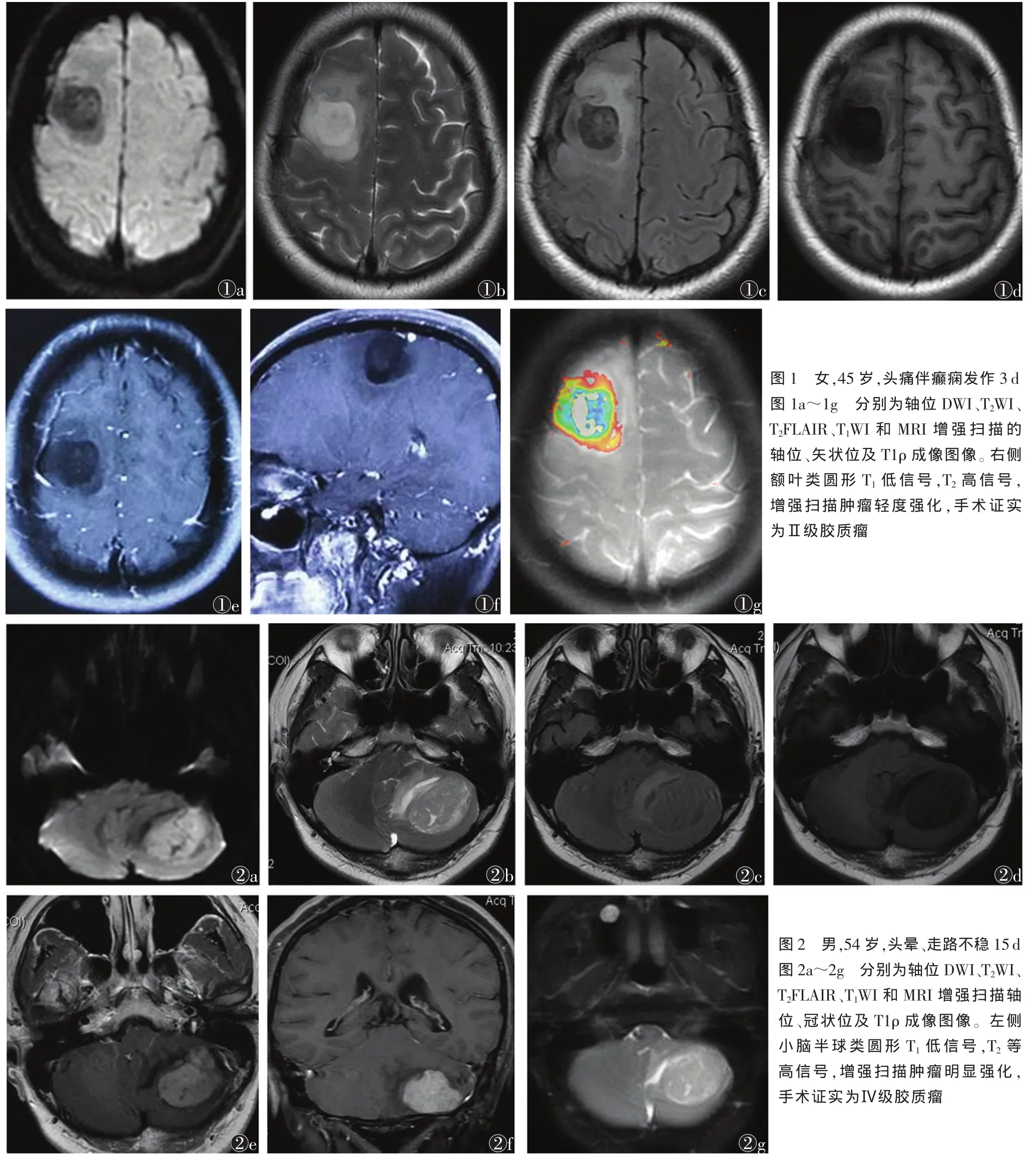
MRI T1ρ成像对脑胶质瘤术前病理分级的应用价值
2018-12-17刘松国孟祥福于秀英李芳君
刘松国 ,韩 广,李 强 ,孟祥福 ,于秀英 ,李芳君
(1.山东省临沂市中医医院医学影像科,山东 临沂 276000;2.山东省临沂市科技合作与应用研究院,山东 临沂 276000)
在我国,脑肿瘤发病约占全身肿瘤的2%,其中胶质瘤是最常见的原发性脑内肿瘤,而高级别胶质瘤由于其浸润生长,与正常组织的分界难以确定,手术难以彻底切除,生存率低,预后差。因此,术前评估对脑胶质瘤治疗方案的制订和预后判断有着重要的临床意义。MRI对颅内肿瘤的全面评估虽然得到了广泛认可,但常规MRI序列对脑肿瘤的诊断及分级仍显不足[1]。MRI T1ρ成像是一种通过探索缓慢运动中分子相互作用从而引起弛豫的成像方法,近年来被用于多种疾病的检查中。肿瘤的生长及恶性程度与肿瘤细胞的大小及排列的紧密程度密切相关,T1ρ成像能反映肿瘤细胞大小及排列紧密程度。本研究将T1ρ成像与常规扫描序列联合应用,探讨其在脑胶质瘤术前分级中的应用价值。
1 资料与方法
1.1 一般资料 回顾性分析临沂市中医医院2015年2月至2016年12月经手术病理证实的37例颅内胶质瘤患者资料,男22例,女15例;年龄18~65岁,中位年龄41岁。37例均为初诊,在术前均行颅脑MRI常规及T1ρ成像检查,肿瘤除外囊变、坏死、钙化或出血后的实性成分最短径>3 cm。术后肿瘤按照《2007年WHO中枢神经系肿瘤分类标准》[2]进行分类,其中Ⅰ级9例,Ⅱ级12例,Ⅲ级9例,Ⅳ级7例。将Ⅰ、Ⅱ级归为低级别胶质瘤,Ⅲ、Ⅳ级归为高级别胶质瘤[3],37 例中,低级别 21 例,高级别 16 例。
1.2 仪器与方法 采用GE Discovery MR750 3.0 T MRI扫描仪,头部8通道线圈。37例均行T1FLAIR、T2PROPELLER、T2FLAIR、DWI Asset及静脉注射 Gd-DTPA(剂量0.2 mmol/kg体质量)对比增强扫描(流率3.0 mL/s)。T1ρ成像自选锁频率500 Hz,自旋锁时间分别是10、20、40及80 ms。上述序列具体扫描参数见表1。

表1 MRI各序列具体参数
1.3 图像分析及影像学评价 采用GE MR ADW 4.6工作站中Functool软件进行图像后处理,得出T1ρ图。结合常规序列扫描图像,找到瘤体实性最大层面为测量层面,在瘤体实性最大区域、对侧半球、对侧白质及对侧灰质设定4个ROI(约35 mm2),每处测量4次,求平均值,分别获得相应的T1ρ值;然后将肿瘤实性最大层面的T1ρ值分别除以对侧半球、白质、灰质的T1ρ值,计算比值。
1.4 统计学分析 所得数据经SPSS 17.0统计软件处理,以±s表示。肿瘤实质区T1ρ值与对侧半球、白质、灰质T1ρ值的比值在高低级别胶质瘤间分别行独立t检验;肿瘤实质区T1ρ值和对侧半球、白质、灰质T1ρ值的比值与肿瘤级别的相关性分析采用Spearman非参数相关分析。以P<0.05为差异有统计学意义。
2 结果
37例胶质瘤实质区的T1ρ值较对侧正常区均不同程度升高。高低级别胶质瘤实质区T1ρ值及各项比值见表2。高低级别肿瘤实质区T1ρ值和对侧半球、白质、灰质T1ρ值的比值差异均有统计学意义(t=3.09,t=2.18,t=4,43;均 P<0.05);肿瘤实质区T1ρ值和对侧半球、白质、灰质T1ρ值的比值与肿瘤级别均呈负相关(r=-0.77,P=0.037;r=-0.81,P=0.031;r=-0.72,P=0.027)。 受检者常规扫描、T1ρ 成像图见图 1,2。
表2 不同级别脑胶质瘤实质区与对侧半球、白质及灰质的T1ρ比值(±s)

表2 不同级别脑胶质瘤实质区与对侧半球、白质及灰质的T1ρ比值(±s)
级别 例数 肿瘤实质区/对侧半球 肿瘤实质区/对侧白质 肿瘤实质区/对侧灰质低级别 21 1.75±0.91 1.62±0.98 1.99±0.82高级别 16 1.35±0.81 1.24±5.67 1.53±0.88
3 讨论
目前,对胶质瘤的术前分级主要应用MRI平扫及对比增强扫描,通常依据肿瘤有无强化、瘤周水肿、出血、坏死和占位效应等影像学表现对脑胶质瘤进行分级诊断。MRI平扫提供的软组织对比是根据组织的T1及T2弛豫时间,MRI对比增强扫描反映的是肿瘤的微循环血液供应、血管生成等情况,但不能反映肿瘤细胞分子的密度及大小等信息,而这一指标在脑内胶质瘤分级诊断方面很重要[3]。T1ρ成像机制在微观上反映水分子与周围大分子之间发生能量交换或质子交换,在许多水和蛋白共存并部分捆绑结合的区域,T1ρ的表现与T2截然不同,且随自选锁场强度的增加,差异更明显[4-6]。当肿瘤发生时,机体的微观构造或环境发生改变,表现为细胞构成(细胞密度、数量、体积大小和细胞外间隙)、细胞膜结构完整性和细胞内外大分子分布等的改变。此外,各种原因,如坏死、细胞密度的改变等,都将导致肿瘤内与邻近肿瘤(如血管源性水肿)水分子的不同,进而影响 T1ρ 成像时信号的改变[7-9]。 因此,T1ρWI可对肿瘤的细胞特性进行无创性评估,并可通过测量T1ρ值进行定量分析。
不同类型、不同级别的胶质瘤成分及构成不同,级别越高,胶质瘤内部成分越复杂,越易发生出血坏死。本研究选择肿瘤实质区测量T1ρ值,是因为肿瘤的实质成分最能反映其恶性程度[10-11]。本研究发现,胶质瘤实质区的T1ρ值较对侧正常区均不同程度升高,推测可能与肿瘤实质部分细胞体积大、排列紧密,造成周围水分子与肿瘤细胞发生能量交换的改变有关。级别越高的胶质瘤实质区域内部肿瘤细胞越大且排列越不均匀,因此T1ρ成像对胶质瘤的分级有重要意义。T1ρ成像可很好地显示肿瘤的边界[12-13]、探测细胞凋亡,并能反映脑肿瘤行非外科手术治疗的效果,评估脑肿瘤细胞的大小及排列情况,对确定脑肿瘤性质有一定价值,可作为常规序列有效补充。总之,高级别胶质瘤的肿瘤细胞增殖越活跃,其相应的肿瘤细胞密度越高,肿瘤内自由水受生物膜结构的限制作用越明显,在其肿瘤实质区测得的T1ρ值越低。目前,T1ρ成像技术在肿瘤中的应用研究较少,郑兴菊等[14]报道,利用T1ρ成像技术可提高原发性肝癌的诊断符合率。郑泽宇[15]研究认为,T1ρ成像能准确、敏感地反映胶质瘤的组织特性,可作为判别高低级别胶质瘤的量化指标之一,与本研究结论相符。
T1ρ成像使对脑肿瘤的诊断上升到微观水平,达到形态与生理生化等功能并重,并能在一定程度上进行量化分析,是常规MRI检查的重要补充。本研究应用GE公司最先进的MR Discovery 750扫描仪进行脑胶质瘤的对比研究,并将其定量指标与病理分级联系起来,从而在体内无创性了解肿瘤的增殖和肿瘤的微观结构改变等生物学行为,实现个体治疗,提高患者的生活质量和预后。
本研究不足:①采集速度较慢。②样本量偏小。③组织病理学标本的光学显微镜分析是临床确定胶质瘤级别的金标准,但须考虑到神经病理学检查的局限性,如胶质瘤的不均质性、采样过疏均可导致对肿瘤级别的低估[16]。
综上所述,常规MRI假设水分子处于自由状态,但实际上组织中的水分子与大分子捆绑在一起,两者之间常发生能量或质子交换等相互作用,因此结合T1ρ成像对胶质瘤进行分级具有非常重要的临床意义。本研究表明,高低级别胶质瘤T1ρ值有明显差异性,可能与肿瘤恶性程度越高,肿瘤细胞体积越大,排列越紧密有关。T1ρ成像技术无创、无需注射对比剂、可重复性强、简单易行,肾功能不全或存在出血病灶者也可行此检查,对脑肿瘤治疗方案的制订有重要的参考价值,有助于对其进行术前定性及分级,值得临床推广应用。