PARP1和APE1在三阴乳腺癌中表达的相关性及临床意义
2018-12-14张诗珩李梦侠陆军特色医学中心肿瘤中心重庆400042
罗 皓,杨 博,何 乐,张诗珩,戴 楠,李梦侠,王 东(陆军特色医学中心肿瘤中心,重庆400042)
乳腺癌是女性常见的恶性肿瘤,2012年全球癌症统计显示,与2008年相比,全球乳腺癌患者例数增大20%以上,死亡率增加14%,其中我国乳腺癌患病人数为69.7万,死亡人数为4.8万[1]。在2011年乳腺癌分型中[2],Luminal型和Her-2过表达型目前均有成熟的靶向治疗药物,但三阴乳腺癌(TNBC)尚缺少特异性靶向药物,采用常规化疗不敏感,面临复发早、进展快、生存期短的严峻问题。目前,TNBC的5年生存率仅为60%[3],因此,寻找TNBC的治疗靶点迫在眉睫。
大多数TNBC存在BRCA1基因突变,突变率约为70.4%。2009年美国临床肿瘤学会(ASCO)报道,抑制聚APP核糖聚合酶1(PARP1)作为DNA修复相关的关键酶,可使BRCA1/2基因突变的细胞选择性凋亡,以PARP1为靶点的分子治疗可能成为TNBC新的治疗手段。目前,临床研究发现,PARP1抑制剂联合放化疗可明显提高临床受益率、无进展生存时间和总生存时间,但单用PARP1抑制剂治疗TNBC的有效率为41%,其可能存在不敏感或耐药等问题[4-6]。与传统放化疗耐药不同的是,单一分子靶向治疗可能存在旁路途径的激活,因此,寻找旁路途径的分子靶点具有重要作用。
脱嘧啶(AP)核酸内切酶(APE1)/氧化还原因子(Ref-1)具有DNA损伤修复和氧化还原双功能,是碱基切除修复(BER)通路中的重要成员之一。在DNA损伤修复通路中,PARP1与APE1可竞争性参与BER修复通路,PARP1的抑制可能引起APE1介导的BER修复途径的激活,从而影响PARP-1抑制剂的治疗疗效。本文对本院收治的60例三阴乳腺浸润性癌患者,采用免疫组化方法检测BRCA1、PARP1与APE1在三阴乳腺浸润性癌组织中的表达,分析其相关性表达及与肿瘤预后的关联,为TNBC开展PARP-1抑制剂的靶向治疗提供参考和依据。
1 资料与方法
1.1 一般资料 选取2008年1月至2012年12月就诊于第三军医大学第三附属医院大坪医院肿瘤中心的乳腺癌患者60例作为研究对象,年龄28~82岁,平均50.06岁,中位年龄47岁。所有患者均有明确术后病理诊断结果,所有标本来自本院病理科标本库,病理诊断均为乳腺浸润性导管癌,并且ER、PR、HER-2结果均为阴性。2014年11月进行随访,2015年1月完成随访,生存期起止时间由手术当日至死亡时间,或末次随访时间。所有患者均为汉族,相互间无血缘关系,本研究设计、临床病例资料和标本获得第三军医大学大坪医院伦理委员会批准,遵循伦理学要求。
1.2 方法 免疫组化结果显示,组织呈棕色或棕黄色颗粒状为阳性表达,APE1、PARP1和BRCA1表达均主要集中于细胞核,偶可见细胞质表达,BRCA1还可出现细胞膜表达。免疫组化分级方法采用阳性细胞数联合染色强度评价方式,光镜下,取肿瘤组织中癌细胞较多的5个高倍视野(400×),分别计数500个细胞,计算其中阳性细胞数量,≤10%计1分,>10%~50%计2分,>50%~75%计3分,>75%则计4分;染色强度分级为:无染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。综合评分判定标准为:将上述2项得分相乘,结果 0~2分计为“-”,3~4分计为(+),6~8分计为(++),9~12计为(+++),其中(-~+)定义为阴性表达,(++~+++)定义为阳性表达。实验中所需的试剂配置、石蜡切片步骤及免疫组化方法参照张诗珩[7]报道。
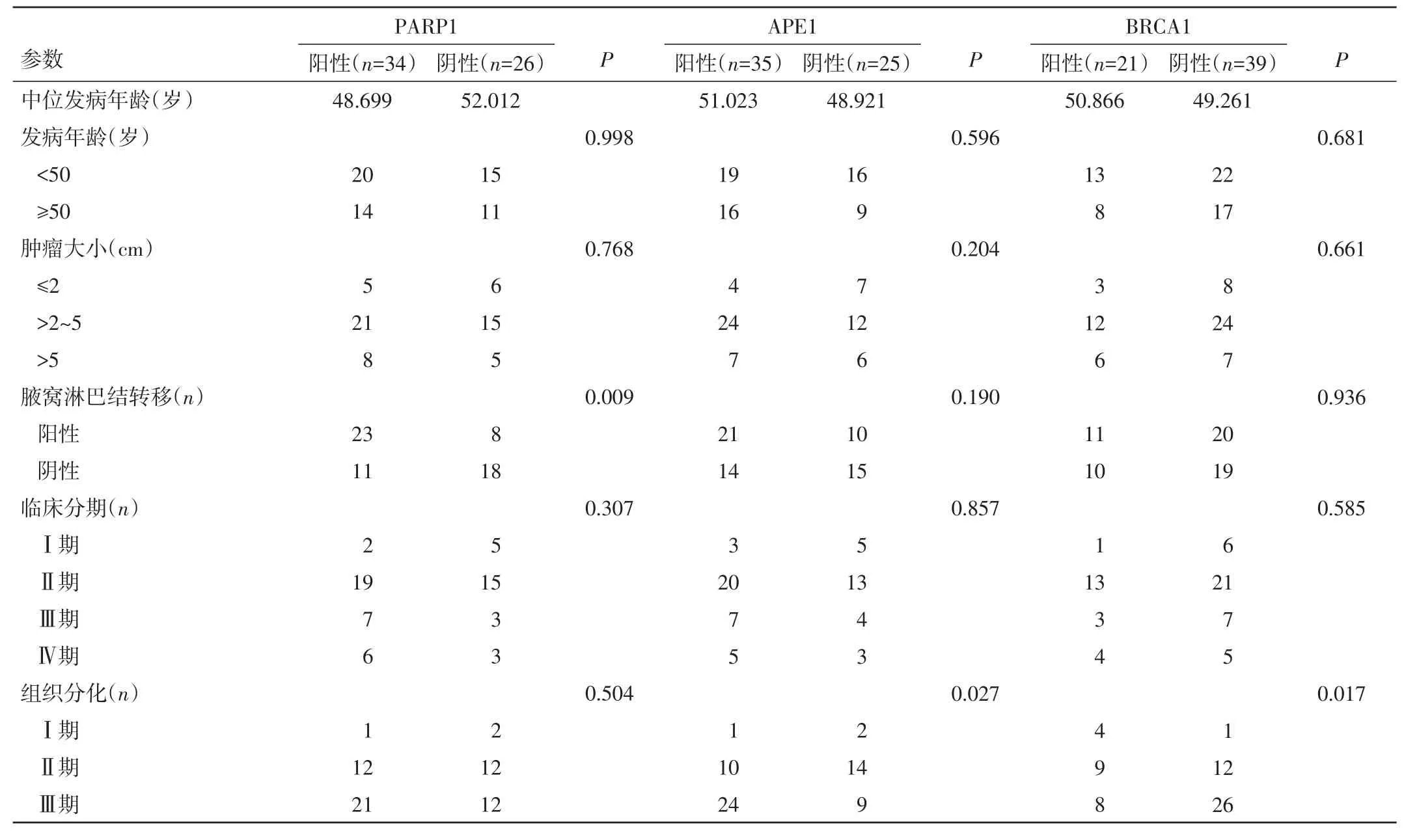
表1 3种标志物与乳腺癌患者临床病理学参数的关系
1.3 统计学处理 应用SPSS19.0统计软件进行数据分析,采用χ2检验分析PARP1、APE1和BRCA1表达与临床病理参数的相关性;PARP1与APE1表达的相关性采用Spearman非参数等级相关分析,采用Kaplan-Meier法分析患者生存时间,生存率差别采用Log-Rank检验,多变量Cox回归评估各临床病理参数对预后的相对危险度,所有检验为双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 3种标志物在TNBC中的表达特点 APE1与PARP1表达定位于细胞核和(或)胞质,BRCA1表达主要位于细胞核,也可见于细胞质和(或)细胞膜,其表达情况见图1。三者阳性表达率分别为:APE1阳性35例(58.3%),阴性25例(41.7%);PARP1阳性34例(56.7%),阴性26例(43.3%);BRCA1阳性 21例(35.0%),阴性 39例(65.0%)。
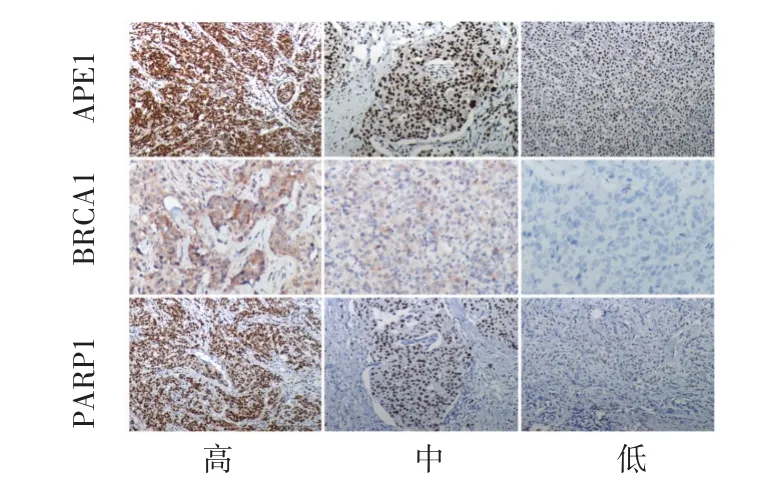
图1 3种标志物在TNBC组织中的表达(400×)
2.2 3种标志物与乳腺癌患者临床病理学参数的关系 PARP1表达在腋窝淋巴结转移的分组中明显有差异,在腋窝淋巴结转移阳性的癌组织中表达明显高于腋窝淋巴结转移阴性,差异有统计学意义(P=0.009);而PARP1表达在发病年龄、肿瘤大小、组织分化及临床分期的分组间无明显差异,差异无统计学意义(P>0.05));APE1和 BRCA1在组织分化的分组间存在统计学差异,且在分化程度差的癌组织中APE1表达显著增高(P=0.027),而 BRCA1表达显著降低(P=0.017)。见表1。
2.3 3种标志物表达的相关性 Spearman等级相关分析发现,APE1与 PARP1表达呈正相关(r=0.489,P<0.001),与BRCA1的表达无相关性;同样,BRCA1与PARP1表达无明显相关性(P>0.05)。见表2。
2.4 3种标志物表达与患者生存时间及预后的关系 寿命表分析显示,APE1阳性表达患者的3年生存率为43%,阴性表达患者为79%,二者比较,差异有统计学意义(P=0.021),见表3,图 2、3。比较 APE1 和PARP1均阳性患者(27例)生存时间与均阴性患者(18例)3年生存率的差异,寿命表分析显示,与共表达阴性患者相比,共表达阳性患者3年生存率明显缩短,分别为37%和75%(P=0.032)。通过多因素Cox回归分析,对60例患者临床病理参数的风险预测发现,年龄、腋窝淋巴结转移、组织分化差及APE1阳性表达是TNBC独立的预后因子,显著降低患者生存时间,见表4。

表2 3种标志物两两表达相关性
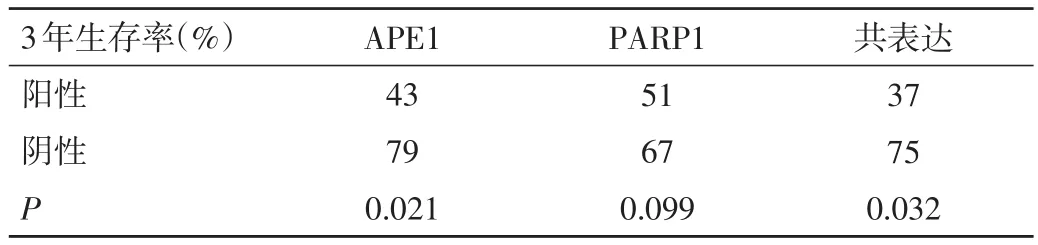
表3 APE1、PARP1及共表达的3年生存率

图2 APE1表达生存曲线
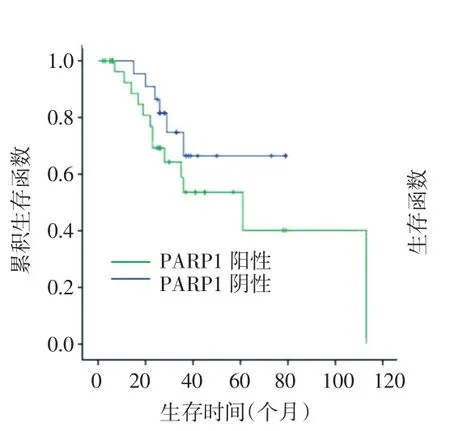
图3 PARP1表达生存曲线

表4 多因素Cox回归分析临床病理参数风险预测

续表4 多因素Cox回归分析临床病理参数风险预测
3 讨 论
TNBC即ER、PR、HER2三者均阴性表达,其恶性程度高、侵袭性强、预后差、具有独立的临床病理类型。有研究表明,大多数TNBC存在BRCA1基因突变,BRCA1缺陷细胞其DNA双链断裂修复减弱,主要以PARP1通路代偿[8]。PARP1广泛表达于高等真核细胞中,介导DNA单链及双链损伤修复,PARP1识别DNA缺口,通过N端DNA结合域中2个锌指模序结合于单链或双链DNA缺口。识别DNA缺口后活化的PARP1形成同型二聚体并催化NAD分解成ADP核糖与烟酰胺,再利用前者作为主要原料,促使受体蛋白发生聚ADP核糖化,进一步影响相关蛋白的修复能力。乳腺癌易感基因BRCA1和BRCA2在同源重组和单核苷酸切除修复中发挥重要作用,其突变或缺失可导致肿瘤发生。当BRCA1/2介导的DNA损伤修复通路缺失时,PARP1的功能对双链断裂修复有重要意义,因此,以PARP1为靶点的分子治疗可能成为TNBC的治疗希望[9-10]。本研究发现,在TNBC组织中PARP1阳性表达率较高,且在发生腋窝淋巴结专一的患者中,PARP1表达增高,生存分析也提示PARP1阳性表达的患者生存时间更短。上述结果均提示,PARP1蛋白可能参与TNBC的发生、发展,其表达水平升高可能参与了乳腺上皮细胞的恶性转化及侵袭。
BER是真核细胞中重要的DNA损伤修复途径,其主要负责内生活性氧物质引起的碱基损伤和外源性电离辐射、烷化剂等化学物质诱导的DNA氧化损伤,糖基化酶又称糖苷水解酶,可特异性切除受损核苷酸上的N-β-糖苷键,形成AP位点,AP核酸内切酶切除含有AP位点的脱氧核糖-5-磷酸,再由DNA聚合酶合成新的DNA片断,最终由DNA连接酶将断端连接。BER包含长补丁及短补丁2种修复途径,PARP-1除了参与DNA双链修复途径外,也是BER修复途径中的重要参与者[11]。PARP-1 可通过与 polβ、FEN1、DNA 连接酶Ⅰ、XRCC1等相关修复蛋白酶作用介导长补丁BER途径[12]。APE1具有DNA修复活性,是BER途径的限速酶,其主要通过2种机制参与BER修复途径[13]:(1)在短补丁BER中,甲基嘌呤DNA糖基化酶切除受损的碱基后,DNA骨架仍然保持完整性,APE1发挥5'-核酸内切酶活性,使DNA链出现5'-断端,然后由polβ发挥5'-端脱氧核糖磷酸酶活性产生3'-端磷酸基团,APE1以此3'-端磷酸盐为底物在AP位点处产生一个3'-端羟基基团和一个5'-端脱氧核糖磷酸基团,最终在polβ、XRCC1/DNA连接酶Ⅲ或DNA连接酶Ⅰ的作用下连接断端,完成修复。(2)长链修复在BER途径中起次要作用,主要对AP位点附近4~8个碱基进行替换,糖基化酶切除受损碱基,产生AP位点,再由APE1发挥5'-核酸内切酶活性,使DNA链出现5'-断端,进而polβ依赖复制因子C、增殖细胞核抗原等完成核苷酸的再次合成,DNA连接酶Ⅰ、DNA连接酶Ⅲ/XRCCl封闭缺口,修复完成。由此可见,APE1与PARP-1均可介导BER修复活性,二者可竞争性结合BER途径的中间产物,参与BER修复通路。研究中发现,APE1在TNBC中阳性表达率高,且与组织分化差相关,生存分析也揭示APE1阳性表达患者生存时间显著低于APE1阴性表达患者,其可作为TNBC预后的独立因素[OR=6.853,95%CI(1.648~28.501),P=0.008];进一步分析APE1与 PARP1表达相关性,我们发现,APE1和PARP1在 TNBC中表达呈正相关,[R2=0.489,P<0.001),且APE1与PARP1表达均阳性的患者生存时间更短,上述结果提示,APE1和PARP1可能存在相互作用,影响TNBC的发生、发展及预后。
在TNBC组织中,APE1与PARP1表达呈正相关,二者联合检测对TNBC的预后评估具有一定价值。因此,阻断APE1及PARP1信号通路有望成为TNBC的治疗新策略。
